роизводство уксусной кислоты окислением ацетальдегида. роизводство уксусной кислоты окислением ацетальдегида». Производство уксусной кислоты окислением ацетальдегида
 Скачать 182.41 Kb. Скачать 182.41 Kb.
|
Москва − 2022г Оглавление Ведение 2 Применение 3 Исходное сырье 4 Характеристика целевого продукта. 6 Физические свойства 6 Химические свойства 6 Способы получения 7 Физико-химические основы процесса 9 Схема установки 10 Структурная схема 12 Исходные данные 13 Расчет основных технологических показателей процесса 17 Выводы 17 Список литературы. 19 ВедениеУксусная кислота — первая из органических кислот, которая стала известна человеку. Впервые она была получена И.Глаубером в 1648 г. А в концентрированном виде путем вымораживания ее водных растворов и разложением ацетата кальция серной кислотой Г.Шталем в 1666—1667 гг. Элементный состав уксусной кислоты был установлен Я.Берцелиусом в 1814 г. До начала XIX века уксусную кислоту производили исключительно из природного сырья: пирогенетической обработкой древесины и окислительным уксуснокислым брожением пищевого этанола. ПрименениеУксусная кислота широко применяется во многих отраслях промышленности, но главным образом в органическом синтезе. Уксусная кислота используется: как ацетилирующий агент в производстве ацетатов; для получения уксусного ангидрида и ацетилхлорида; в производстве красителей; в изготовлении фармацевтических препаратов; для получения ацетона; в производстве ацетилцеллюлозы и винилацетата; для получения монохлоруксусной кислоты, которая является промежуточным продуктом в производстве инсектофунгицидов и моющих средств; в качестве растворителя и коагулянта латексов; в пищевой и текстильной промышленности. Основную массу уксусной кислоты потребляют производства ацетилцеллюлозы и винилацетата. Исходное сырьеАцетальдегид - один из многотоннажных продуктов переработки ацетилена и этилена. Он широко встречается в природе, а также производится в больших масштабах. Ацетальдегид занимает первое место по производству среди всех альдегидов, что означает его ценность, в качестве промежуточного продукта в промышленности органического синтеза. Использование ацетальдегида: производство молочной кислоты, акрилонитрила, эфиров акриловой кислоты; конденсация с аммиаком для последующего образования винилпиридинов и гомологов пиридина; конденсация с формальдегидом для образования пентаэритрита; реакции альдольной конденсации и получение кротонового альдегида, бутандиола-1,3, бутандиена-1,3, н-бутанола; соединение с мочевиной в производстве различных полезных смол; реакция с уксусным ангидридом для образования этилидендиацетата, который, в свою очередь, используется для производства поливинилацетата. производство этилацетата, глиоксаля, 2-этилгексанола, алкиламинов, ацетатов целлюлозы; применение в качестве восстановителя при производстве зеркал. Но в данной работе мы прежде всего рассмотрим его окисление в уксусный ангидрид и уксусную кислоту. На данный момент на производство уксусной кислоты и ее ангидрида, 2-этилгексанола и этилацетата в мире расходуется 95%, а в России – 75% всего производимого ацетальдегида. Получение ацетальдегида. Из всех методов получения ацетальдегида чаще всего встречается процесс прямого окисления этилена при PdCl2.Таким способом получают 85% мирового ацетальдегида. Производство ацетальдегида окислением на палладиевом катализаторе имеет экономические преимущества перед другими методами. Среди всех альдегидов по масштабам производства ацетальдегид на первом месте. Для ясности масштабов стоит отметить, что Германии в 1958 году произвели 220 тыс. т. ацетальдегида, в США – 386 тыс. т. ацетальдегида. В 2003 году мировое производство составило примерно 1 миллион тонн. Но в то же время на мировом рынке спрос на ацетальдегид постепенно снижается, из-за того, что сокращается доля его использования при производстве уксусной кислоты. Производители переходят на более эффективные и экономически выгодные методы производства, такие, как нпример карбонилирование метанола. В России в 1948 году промышленное производство ацетальдегида было освоено по методике Кучерова из этилена через этанол. До 1962 года ацетилен и этанол являлись основными источниками данного продукта. Но в наше время этилен используют в больших количествах, так что редполагается, что производство ацетальдегида в дальнейшем перейдет полностью на этиленовую базу. В 1959 г. Я.К. Сыркиным, И.И. Моисеевым и М.Н. Варгафтиком был предложен непрерывный процесс получения ацетальдегида, в котором восстановление до металлического палладия совмещается с постоянным его окислением кислородом воздуха. В 1970 году Омский завод синтетического каучука запустил более дешевое производство прямого окисления этилена воздухом по двухстадийной системе для получения ацетальдегида мощностью 270 тыс. тонн в год. Характеристика целевого продукта.Физические свойстваУксусная кислота (или же этановая кислота) представляет из себя бесцветную жидкость с резким запахом, с температурой кипения 118ºС, температурой плавления 16,75°С и плотностью 1,05 т/м3. Безводная, так называемая «ледяная» уксусная кислота образует за счет водородных связей димерциклического строения. Критическая температура составляет 321,6°С. Химические свойстваУксусная кислота смешивается во всех отношениях с этанолом, диэтиловым эфиром, бензолом и другими органическими растворителями и с водой. Растворяет некоторые неорганические и органические вещества, например, серу, фосфор, ацетаты целлюлозы. С воздухом уксусная кислота образует взрывчатые смеси с пределами воспламенения от 3,3 до 22,0% об. Температура вспышки равна 34°С, температура самовоспламенения 354С.Уксусная кислота слабая. Константа ее диссоциации 1,75*10-5. Образует многочисленные растворимые в воде соли (ацетаты) и этерифицируется спиртами с получением сложных эфиров. Уксусная кислота обладает высокой коррозионной активностью по отношению ко многим металлам, особенно в парах и при температуре кипения, что необходимо учитывать при выборе материалов для аппаратуры. В ледяной кислоте стойки как на холоде, так и при температуре кипения, алюминий, кремнистый и хромистый чугуны, некоторые сорта нержавеющей стали, но разрушается медь. Техническая уксусная кислота обладает большей коррозионной активностью, которая усиливается в контакте с воздухом. Из неметаллических материалов стойки по отношению к уксуснойкислоте специальные сорта керамики и эмали, кислотоупорные цементы и бетоны и некоторые виды полимерных материалов (полихлорвиниловые и фенолальдегидные пластмассы). Ингибитор коррозии в растворах уксусной кислоты —перманганат калия. В парах уксусная кислота обладает раздражающим действием на дыхательные пути, ПДК для нее составляет 5 мг/м3. Способы полученияВ настоящее время производство уксусной кислоты из лесохимического сырья имеет второстепенное значение, хотя масштабы его измеряются сотнями тысяч тонн. В этом методе уксусную кислоту выделяют из сконденсированной части парообразных продуктов термической обработки древесины (так называемой жижки), получаемой в процессе углежжения. Выход кислоты составляет около 20 кг на 1 м3 древесины. Так же существует биохимический метод производства уксусной кислоты, который используют только для производства натурального пищевого уксуса. Появление синтетических методов производства уксусной кислоты связано с разработкой и промышленной реализацией реакции получения ацетальдегида по Кучерову. В1910—1911 гг. был запатентован способ производства уксусной кислоты окислением ацетальдегида, а в годы первой мировой войны в Германии и Канаде по этому методу было организовано промышленное производство. С некоторыми технологическими изменениями этот метод сохранил свой изначальный вид и в течение уже более пятидесяти лет является одним из основных. Кроме метода окисления ацетальдегида уксусная кислота в промышленных масштабах производится следующими методами. 1) Из ацетона пиролизом его до кетена с последующей гидратацией последнего (с 1940-х годов): CH3 – C(O) – CH3 →CH2=C=O + CH4 CH2=C=O + H2O → CH3COOH 2) Из метанола карбонилированием его на кобальтовом катализаторе (с 1964 года): CH3OH + CO → CH3COOH 3) Из алканов окислением их в жидкой и паровой фазе: — пропанбутановых фракций (с 1952 года), — бензиновых фракций прямой перегонки (с 1966 года); 4) Из продуктов окисления парафина при синтезе высших жирных кислот. Следует также учесть в балансе производимой уксусной кислоты кислоту, рекуперированную из производства ацетата целлюлозы, получаемого этерификацией целлюлозы уксусным ангидридом: Цел – OH + (CH3CO)2O → Цел – OCOCH3 + CH3COOH Мировое производство уксусной кислоты составляет в настоящее время свыше 3,5 млн. т в год, для сравнения, в нашей стране в 1980 г. было произведено 250 тыс. т. Основная масса уксусной кислоты производится из ацетальдегида, окислением бутановой и бензиновой фракций. Первая установка по производству синтетической уксусной кислоты каталитическим окислением ацетальдегида была изготовлена и запущена на Чернореченском химическом заводе в 1932 г., а уже в 1948 г. было организовано ее промышленное производство. К 60-м годам уксусная кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос почти в три раза. В 1963 г. были введены в строй новые предприятия по совместному производству уксусной кислоты и уксусного ангидрида каталитическим окислением ацетальдегида в жидкой фазе и к 1965 г. производство уксусной кислоты этим методом составляло уже 17% от общего объема ее производства в стране. В эти же годы было освоено в промышленном масштабе производство уксусной кислоты карбонилированием метанола. Физико-химические основы процессаОкисление ацетальдегида молекулярным кислородом представляет гомогенную каталитическую реакцию, протекающую в жидкой фазе и выражаемую общим уравнением: CH3CHO + 0,5O2 → CH3COOH – ΔH (а) Реакция протекает по цепному механизму через стадию образования надуксусной кислоты (НУК): CH3 – CHO + O2 → CH3 – C(O) – OOH (б) которая, являясь сильным окислителем, окисляет ацетальдегид до уксусного ангидрида: CH3 – CHO + CH3 – C(O) – OOH → (CH3CO)2O + H2O (в) Уксусный ангидрид при достаточном количестве воды гидролизуется до уксусной кислоты: (СН3СО)2O + Н2O → 2СН3СНО (г) Таким образом, в системе всегда сосуществуют уксусная кислота, уксусный ангидрид и вода. Очевидно, что, остановив процесс на стадии реакции (в), можно получить в качестве конечного продукта не уксусную кислоту, а уксусный ангидрид. Из этого вытекают два технологических процесса окисления ацетальдегида: получение индивидуальной уксусной кислоты и получение совместно уксусной кислоты и уксусного ангидрида. Эти процессы различаются природой катализатора, температурой, составом окислительного газа, методом удаления воды. В обоих методах производства в качестве побочных продуктов образуются ацетон, этилидендиацетат, формальдегид, метилацетат, муравьиная кислота и оксид углерода (IV), которые удаляются при ректификации сырого продукта. Схема установкиТехнологический процесс производства уксусной кислоты окислением ацетальдегида состоит из трех последовательных стадий: —окисление ацетальдегида, —выделение непрореагировавшего ацетальдегида из парогаза, —выделение уксусной кислоты из реакционной смеси и ее очистка. На рис. 1.1 представлена технологическая схема производства уксусной кислоты из ацетальдегида на марганцевом катализаторе. 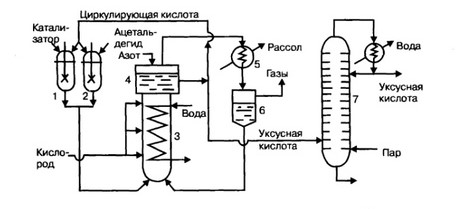 Рис. 1.1. Технологическая схема производства уксусной кислоты: 1 — смеситель катализаторного раствора, 2 — смеситель раствора ацетальдегида, 3 — окислительная колонна (реактор), 4 — брызгоулови тель, 5 — рассольный конденсатор, 6 — сепаратор жидкости и газа, 7 —ректификационная колонна Растворы катализатора и ацетальдегида в циркуляционной уксусной кислоте подаются из смесителей 1 и 2 в нижнюю часть окислительной колонны — реактора барботажного типа 3. Температурный режим в колонне поддерживается с помощью размещенных в ней охлаждающих змеевиков, по которым циркулирует вода. По всей высоте в колонну через несколько труб подается под давлением 4-105 Па кислород, который барботирует через жидкость, заполняющую колонну. Парогазовая смесь, содержащая продукты окисления, выводится из колонны 3 через брызгоуловитель 4 и поступает в конденсатор 5, охлаждаемый рассолом, и из него в сепаратор 6. Из сепаратора конденсат, состоящий из уксусной кислоты и ацетальдегида, возвращается в окислительную колонну, а несконденсировавшиеся газы промываются водой и выпускаются в атмосферу. Для предотвращения возможности взрыва НУК парогазовая смесь, выходящая из колонны, разбавляется азотом, который подается в брызгоуловитель 4. Жидкая уксусная кислота, выходящая из брызгоуловителя колонны 3, делится на два потока. Меньший из них (циркуляционная кислота) направляется в смесители 1 и 2 для приготовления растворов катализатора и ацетальдегида, а больший поступает на ректификацию в колонну 7 для получения товарного продукта. Из нижней части колонны 7 выводится в виде кубового остатка раствор катализатора, поступающий на регенерацию. Основной аппарат технологической схемы — окислительная колонна. Она представляет цилиндр с расширенной верхней частью, играющей роль брызгоуловителя, высотой 12 и диаметром 1 м. Колонна изготовлена из алюминия или хромоникелевой стали, мало подверженных коррозии в уксуснокислой среде. Внутри колонна имеет полки, между которыми размещены змеевиковые холодильники для отвода реакционного тепла и несколько труб для подачи кислорода. Товарным продуктом в этом методе является уксусная кислота концентрацией после двухкратной ректификации 97,5—98,5% мае. Выход уксусной кислоты составляет 92% при степени превращения ацетальдегида 0,98. Структурная схема В данной структурной схеме элементы химико-технологической системы представлены в виде блоков, имеющих входы и выходы. Блоки соответствуют декомпозиционному элементу в зависимости от цели декомпозиции и от исходной информации. 1- смешение 2- окисление; 3- конденсация и разделение газовых и жидких потоков; 4- ректификация с рециклом по ацетальдегиду. N011– катализатор N012 – свежий технический ацетальдегид N12 – ацетальдегид пошедший на окисление N023 – поступающий кислород N300 – выхлопные газы N402 – ацетальдегид после ректификации N401 – получаемая уксусная кислота N403 – метилацетат N404 – этилидендиацетат Исходные данные
Пукс. к-ты(100%)=1650*0.998=1646,7 кг Уравнения: СН3СНО + 0,5O2 → CH3СOOH 2CH3CHO + 1,5O2 → СН3СООСН3 + CO2 + H2O 3СН3СНО + O2 → СН3СН(ОСОСН3)2 + H2O Составление уравнений материального баланса. 1)Уравнение по поступающему на окисление ацетальдегиду: (G012*γацет)/Мацет+N12*(1- Хацет)* γацетжидк=N12 2)Образующийся метилацетат. Хацет*N12*0,5* φметилацетацет=N403 3)Образующийся этилендиацетат. Хацет*N12*0,333* φэтилендиацетацет=N404 4)Базисное уравнение по уксусной кислоте. Пукс. к-ты(100%)/Mукс=N12* Хацет* φуксацет+(G012*γукс.)/Мацет 5)Баланс по прореагировавшему кислороду. (G023*Хкисл* γкисл)/Мкисл=N403*1,5+N404+ (Пукс. к-ты(100%)/Mукс)*0,5 6)Общее кол-во воды по реакции. (G012*γвода)/Мвода+N403+N404=nвод 7)Баланс по выхлопным газам. N300=(G023*(1-Хкисл)* γкисл)/Мкисл+(G023*γазот)/Мазот+ N12* γацетвыхлоп+ N403 N403=NCO2
Производится переименование переменных Ni на Хi для составления уравнений и решения СЛАУ. Х1*0,02259+Х2*0,0655=Х2 Х2*0,0113=Х3 Х2*0,00452=Х4 27,445=Х2*0,8688+Х1*0,00005682 Х5*0,028336=Х3*1,5+Х4+13,7225 Х1*0,000194+Х3+Х4=Х6 Х7=Х5*0,002133+Х5*0,000893+Х2*0,31+Х3 Определение масс потоков: G12 = N12* Мацет =31,5 кмоль*44 кг/ кмоль = 1386 кг, G403 = N403* Мметилацет = 0,356 кмоль*74 кг/кмоль = 26,3кг, G404 = N404* Мэтилиденди. =0,142 кмоль*146 кг/кмоль=20,73 кг Gацет = G012 * γацет = 1303,27 кг * 0,994 = 1295,45 кг Gацет после ректи = G12-Gацет = 1386 кг-1295,45 кг = 90,55 кг Gвод из ацет = G012 * γвода = 1303,27 кг * 0,0035 = 4,56 кг Gвода реакц = (nвод*Мвод) - Gвод из ацет = (0,75 кмоль*18 кг/кмоль) - 4,56 кг = =8,94 кг Gкисл исх = G023 * γкисл = 508,15 кг * 0,975 = 495,45 кг Gкислор. непрореаг= Gкисл исх*(1-Xкисл)=495,45*(1-0,93)=34,7 кг Gацетальд непрореа= Gацетальд*(1-Xацетал) =1295,45 кг * (1-0,905) =123,07 кг NCO2=N403 G CO2= N403*М CO2=0,356кмоль*44 кг/кмоль=15,66 кг Gукс. у-ты = G012 - Gацет - Gвод из ацет = 1303,27 - 1295,45 – 4,56 = 3,26 кг Gвод = nвод * Мвода = 13,5 кг Материальный баланс.
Расчет основных технологических показателей процессаТеоретический расходный коэффициент ацетальд. (стех) стех =М ацет/Mуксусн. к-та =44/60=0,73 Практический расходный коэффициент ацетальд(пр) пр =G ацет/Gуксусн. к-та=1295,45/1646,7=0,787 Выход уксусной кислоты по ацетальдегиду. = G уксус.к-та/G уксус.к-та стех= G уксус.к-та /G ацетальд*(M уксус.к-та /Мацетальд) =1646,7/[1295,45*(60/44)]=0,932=93,2% Теоретический расходный коэффициент кислород (стех) стех =М кисл/Mуксусн. к-та *a/b=32*0,5/60=0,26 Практический расходный коэффициент ацетальд(пр) пр =G кисл/Gуксусн. к-та=495,45/1646,7=0,3 Выход уксусной кислоты по кислороду. = G уксус.к-та/G уксус.к-та стех= G уксус.к-та /G кислород*(M уксус.к-та /Мкислород)/0,5 =1646,7/[495,45*(60/32)/0,5]=0,886=88,6% ВыводыТехнологический процесс получения уксусной кислоты путём окисления ацетальдегида техническим кислородом является сложным многостадийным каталитическим гомогенным процессом, протекающим в жидкой фазе. Процесс характеризуется высокими значениями основных критериев эффективности, соответствует принципам общей химической технологии. Список литературы.[Электронныйресурс] // URL: marketpublishers.ru/lists/7136/news.html Проект узла синтеза ацетальдегида окислением этилена[Электронныйресурс]: http://earchive.tpu.ru/bitstream/11683/29550/1/TPU197743.pdf Соколов Р.С. Химическая технология: Учебн. пособие для студ. высш. учеб. заведений в 2-х т. Т. 2. – М.: Гуманит. изд. центр. ВЛАДОС, 2000. – 448 с. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. - М.: Химия, 1988. - 592 с. Краткий справочник физико-химических величин» под редакцией К.П. Мищенко и А.А. Равделя, Л.: Химия, 1974 г. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


