3.Тепловой баланс процессов горения Количество тепла, выделяющееся при полном сгорании одного моля вещества, называется теплотой сгорания этого вещества (Q гop, Н гор).  кСогласно следствию из закона Гесса кСогласно следствию из закона Гесса теплота горения вещества равна разности между суммой теплот образования продуктов горения с учетом их коэффициентов n i в уравнении реакции горения и теплотой образования Н обр исходного вещества: Расчет теплового эффекта реакции горения индивидуального вещества
Энтальпией горения (𝛥𝐻гор, кДж/моль) вещества называется тепловой эффект реакции окисления 1 моль горючего вещества с образованием высших оксидов.
Теплота горения (𝑄гор) численно равна энтальпии горения, но противоположна по знаку.
Для индивидуальных веществ тепловой эффект реакции может быть рассчитан по следствию из закона Гесса:
𝛥𝐻реакции = n*𝛥𝐻обр(𝐶𝑂2)+n*𝛥𝐻обр(𝐻2𝑂)-n*𝛥𝐻обр (𝐶7𝐻16) =
= 7× (-393,5) + 8× (-241,8) -7,9 = -4696,8 кДж/кг
𝑄гор = 4696,8 кДж/моль
Перевод значения энтальпии горения из кДж/моль в кДж/кг: 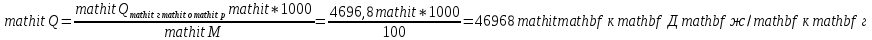 
𝒓
Расчет низшей теплоты сгорания 𝑸низпо формуле Д.И.
Менделеева

𝑟
𝑄низ = 339,4 ∗ (𝐶%) + 1257 ∗ (𝐻%) − 108,9 ∗ (𝑂%) − 25,1 ∗ 9 ∗ (𝐻%)
= 339,4 ∗ 84 + 1257 ∗ 16 – 25,1 ∗ 9*16= 45007 кДж/кг
Ответ: Низшая теплота сгорания составляет 45007 кДж/кг.
Расчет действительной температуры горения индивидуального вещества
В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения.
Теоретическая температура горения – это температура, при которой выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация продуктов горения начинается при температуре выше 2000 К.
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси, с начальной температурой 273 К. и при отсутствии потерь в окружающую среду.
Адиабатическая температура горения – это температура полного сгорания смесей любого состава при отсутствии тепловых потерь в окружающую среду.
Действительная температура горения – это температура горения, достигаемая в условиях реального пожара. Она намного ниже теоретической, калориметрической и адиабатической, т.к. в реальных условиях до 40% теплоты горения обычно теряется на излучение, недожог, нагрев избытка воздуха и т.д.
Вычислить действительную температуру горения гептана 𝐶7𝐻16, если потери тепла излучением составляют 0%, а горение протекает с коэффициентом избытка воздуха 3,75.
Решение:
Записываем уравнение реакции горения гептана:
C7H16 + 11(O2 + 3,76N2)→ 7CO2 + 8H2O + 11× 3,76N2
По уравнению реакции горения определяем количество кломоль продуктов горения:
n(CO2) = 7 кмоль
n(H2O) = 8 кмоль
n(N2) = 11*3,76 = 41.36 кмоль
Поскольку в рассматриваемом случае горение протекает с избытком воздуха (α > 1), необходимо учесть остаточный кислород в продуктах сгорания и азот в избытке воздуха:
∆𝑛𝑂2 = 𝛽 ∗ (𝛼 − 1) = 11 ∗ (3,75 − 1) = 30,25 кмоль
∆𝑛𝑁2 = 3,76 ∗ 𝛽 ∗ (𝛼 − 1) = 3,76 ∗ 11 ∗ (3,75 − 1) = 38,6 кмоль
Таким образом, практический состав продуктов сгорания следующий: n(CO2) = 7 кмоль
n(H2O) = 8 кмоль
nпракт(N2) = n(N2) + ∆n(N2) = 41,36+ 38,6 = 79.96 кмоль
nпракт (O2) = 30,25 кмоль
Определяем общее количество продуктов сгорания при сжигании 1 киломоля горючего:
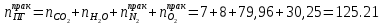 кмоль кмоль
Определяем среднее теплосодержание продуктов горения. Теплота горения гептана составляет:
𝑄гор = 45007 кДж/кг
Поскольку расчет ведется на 1 к.моль, необходимо перевести эту величину в кДж/кмоль:
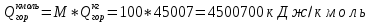
По условию задачи теплопотери составляют 0%, следовательно, η = 0,0.
𝑄пг =  ∗ 1 = ∗ 1 = 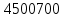 кДж/кмоль. кДж/кмоль.
Среднее теплосодержание продуктов горения:
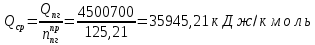
По справочным данным, приложению таблицы 1, ориентируясь на азот Т1 = 1000оС.
Рассчитываем теплосодержание продуктов горения:

пг
𝑄1000 = n(CO2)×Q1(CO2) +n(H2O)×Q1(H2O)+ n(N2)×Q1(N2)+ воздух =
= 7×55140,4+ 8×43198,9+ 41,36×34760,2+ 20,9 ×35074,5= 2902312,92 кДж.
𝑄1000 = 2902312,92 <𝑄 = 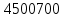 , следовательно, выбираем 𝑇2 , следовательно, выбираем 𝑇2

.
то выбираем = 1100оС
Рассчитываем теплосодержание продуктов горения при 1100оС:

пг
𝑄1100 = n(CO2)×Q2(CO2) +n(H2O)×Q2(H2O)+ n(N2)×Q2(N2) + воздух
=7×49442+8×38648,5+ 41,36×31337+ 20,9 ×31621,9 =2612278,03кДж.
𝑄1100 = 2612278,03< 𝑄 = 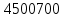 ,, следовательно температура ,, следовательно температура
горения находится в интервале от 1000 до 1100 оС.
Методом интерполяции рассчитываем температуру горения:
Tг = T1 +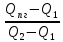 × (T2 – T1)= 1000 + × (T2 – T1)= 1000 +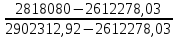 × 100 = 1971,75 °С × 100 = 1971,75 °С
Ответ: Температура горения гептана при заданных условиях составляет 1971,75 оС.
|
 Скачать 366.62 Kb.
Скачать 366.62 Kb.

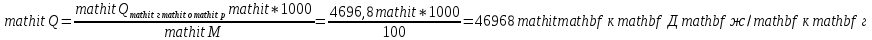

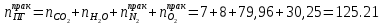 кмоль
кмоль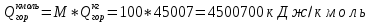
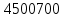
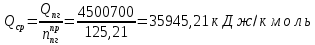


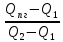 × (T2 – T1)= 1000 +
× (T2 – T1)= 1000 +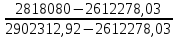 × 100 = 1971,75 °С
× 100 = 1971,75 °С