ТГиВ гептан. Курсовик-ТгиВ. Исследование пожароопасных свойств гептана
 Скачать 366.62 Kb. Скачать 366.62 Kb.
|
Теоретический и практический расход воздуха на горение,расчет продуктов горения Удельным теоретическим расходом воздуха Vв° называется минималь- ное его количество, необходимое для полного сгорания единицы массы горюче- го вещества при нормальных условиях. Теоретическое количество воздуха (или другого окислителя) рассчитывается по уравнению материального баланса горения с учетом стехиометрических коэф- фициентов, то есть когда горючее и окислитель находятся в стехиометрическом соотношении. Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реак- ции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим (Vвтеор). Горение может происходить не только при стехиометрическом соотно- шении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем опре- деляется теоретическим расчетом. Избыточный воздух Vв в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения.. . Расчет теоретического объема воздуха, необходимого для горения индивидуального веществаУравнение реакции горения в воздухе: 𝐶7𝐻16 + 11(𝑂2 + 3,76𝑁2) = 7𝐶𝑂2 + 8𝐻2𝑂 + 11∗ 3,76𝑁2 β=11коэфициент по воздуху М=7·12+1*16=100 кг. Определяем сколько кмолей воздуха необходимо для сжигания одного килограмма горючего 𝑛возд = 𝛽 ∗ (1 + 3,76) 𝑛возд = 11∗ (1 + 3,76) = 53,36 Для сжигания 1кг. горючего – требуется n кмолей воздуха отсюда: 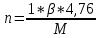 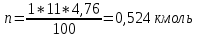 Определяем какой объем занимает найденное количество кмолей воздуха при заданных условиях. 1 кмоль любого газа или пара при нормальных условиях занимает объем равный 22,4 м3 Условия отличаются от нормальных Расчет VM ведут по формуле объединенного газового закона: 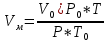 Для заданных в задаче условий: 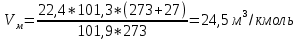 Исходя из этого, 0,524 кмоль воздуха при заданных условиях займут следующий объем: Vвтеор = ( Расчет объема воздуха, необходимого для горения индивидуального веществаПоскольку согласно условию задачи, при горении расходуется не весь кислород воздуха, то коэффициент избытка воздуха α>1, поэтому следует учесть избыток воздуха при горении. 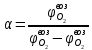 a = 1,4 a = 1,4Практический расход воздуха равен: 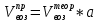 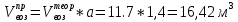 Удельный теоретический расход воздуха при горении гептана при заданных условиях составляет 11,7 м3/кг, практический расход 16,42 м3/кг. Расчет объема воздуха, необходимого для горения вещества сложного элементного состава Состав подобных веществ выражается в массовых долях каждого элемента. При горении кислород воздуха расходуется на окисление углерода, водорода, серы и других горючих составляющих. Рассчитаем, какой теоретический объем воздуха является необходимым для полного сгорания: Vвтеор = m×0,267 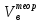 = 0,267 = 0,267Коэффициент избытка воздуха составляет 1,4 Практический расход воздуха равен: Vвпр= Vвтеор×a = 11,7× 1,4 = 16,4 м3 Удельный теоретический расход воздуха при горении гептана при заданных условиях составляет 11,7 м3/кг, практический расход 16,4м3/кг. |
