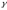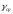Лабораторная работа 29 определение отношения удельных теплоемкостей воздуха методом адиабатического расширения
 Скачать 96.42 Kb. Скачать 96.42 Kb.
|
Лабораторная работа №29ОПРЕДЕЛЕНИЕ отношения удельных теплоемкостей воздуха методом адиабатического расширенияФамилия И.О. _________________ Группа __________ Дата ______ ВведениеУдельной теплоемкостью называется количество тепловой энергии, необходимое для нагревания единицы массы вещества на 1К. К 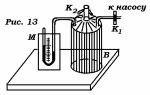 роме удельной теплоемкости вводится понятие молярной теплоемкости, которая определяется количеством тепловой энергии, необходимой для нагревания одного моля вещества на 1К. Таким образом, если обозначить удельную теплоемкость через с, а молярную теплоемкость через С, то очевидно, С = μс, где μ – масса одного моля вещества. Для газов удельная теплоемкость, а также молярная теплоемкость, зависит от условий, при которых газ нагревается. Вводится понятие двух теплоемкостей: удельная теплоемкость при постоянном давлении ср и удельная теплоемкость при постоянном объеме сV. Так как газ при расширении совершает работу против сил внешнего давления, то удельная теплоемкость газа при постоянном давлении больше удельной теплоемкости при постоянном объеме. То есть ср > сV. Разность величин ср - сV для идеального газа вычисляется теоретически: она равна газовой постоянной, отнесенной к массе одного моля вещества 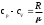 Адиабатический процесс, при котором отсутствует тепловой обмен между газом и окружающей средой, описывается уравнением Пуассона 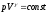 где γ – есть отношение удельной теплоемкости идеального при постоянном давлении к удельной теплоемкости того же газа при постоянном объеме, то есть 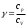 Из теоретических соображений следует, что для двухатомного газа отношение 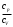 равно 1,4. Опыт показывает, что для двухатомных газов, например, для водорода, кислорода и т.д., а также для воздуха это отношение близко к его теоретической величине. равно 1,4. Опыт показывает, что для двухатомных газов, например, для водорода, кислорода и т.д., а также для воздуха это отношение близко к его теоретической величине.Описание прибора и метода Прибор, с помощью которого определяют отношение 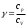 , состоит из баллона В, манометра М, двух кранов К1 и К2 и насоса (рис. 13). , состоит из баллона В, манометра М, двух кранов К1 и К2 и насоса (рис. 13).До начала работы в баллоне имеется масса воздуха m, которая при открытых кранах К1 и К2, то есть при атмосферном давлении р0, занимает объем V0. Температура комнатная ТК. С помощью насоса нагнетаем в баллон некоторую массу воздуха, закрываем кран К1. Та масса воздуха m, которая была в баллоне, сжимается, уступая часть объема баллона новой порции воздуха. Теперь масса воздуха занимает объем меньше объема баллона V1 < V0, давление внутри баллона возрастает до р1 = р0 +Δh1. Содержимое баллона при нагнетании дополнительной порции воздуха несколько нагрелось. Вследствие адиабатического сжатия процесс протекает быстро и теплообмен с внешней средой не успевает произойти. Поэтому необходимо подождать, пока температура в баллоне станет равной ТК и установится разность уровней в манометре Δh1. Итак, первое состояние массы воздуха m характеризуется параметрами: р1, V1, Тк. р1 = р0 +Δh1 Открываем быстро кран К2 и выпускаем воздух, пока давление внутри баллона не станет равным атмосферному р0, затем снова закрываем кран К2. Масса m займет объем всего баллона V0, но, так как процесс происходил очень быстро, то обмена теплом с внешней средой не произошло, температура содержимого баллона упала до Т2 < Т0, то есть имеет место адиабатическое расширение. Итак, второе состояние газа характеризуется параметрами: р2 = р0; V2 = V0; Т2 < ТК. При закрытых кранах К1 и К2 ждем несколько минут, пока температура повысится до комнатной температуры ТК. В результате этого давление внутри баллона возрастает до р3 = р0 +Δh2 где Δh2 – разность уровней жидкости в манометре. Объем, который занимает масса m воздуха, равен объему баллона V3 = V0. Температура стала комнатной ТК. Третье состояние воздуха характеризуется параметрами: р3 = р0 +Δh2; V3 = V0; ТК. Итак, масса воздуха, содержащаяся в баллоне, прошла такие состояния: I. р1 = р0 +Δh1; V1 < V0; ТК. II. р2 = р0; V2 = V0; Т2 < ТК. III. р3 = р0 +Δh3; V3 = V0; ТК. Переход из I во II состояние – адиабатический процесс. Для него выполнимо уравнение 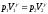 (40) (40)Переход из I в III состояние – изотермический. Для него выполнимо уравнение Бойля-Мариотта  (41) (41)Преобразуем уравнения (40) и (41)  но р1 = р0 +Δh1, V2 = V3 = V0, р3 = р0 +Δh3, р2 = р0 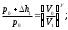 (42) (42) 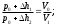 (43) (43)Подставляем в (42) вместо отношения 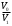 его значение из (43), получим: его значение из (43), получим: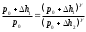 Логарифмируя это уравнение, имеем 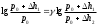 Разделим числитель и знаменатель правой части уравнения на р0, тогда 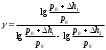 или 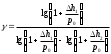 из теории приближенных вычислений известно, что при малых значения х: 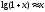 , ,тогда 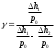 или 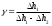 (44) (44)Таким образом, измеряя на опыте 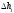 и и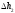 , мы можем определить отношение удельных теплоемкостей воздуха: , мы можем определить отношение удельных теплоемкостей воздуха: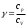 II. Порядок выполнения работы. Закрыть кран К2 и открыть кран К1. Накачать насосом воздух в баллон до давления, соответствующего разности уровней жидкости Δh = 10 ÷ 15 см, и закрыть кран. Подождать, пока разность уровней в манометре установится, записать эту разность. Открыть кран К2 и в момент, когда уровни в манометре сравняются, закрыть его, не ожидая, пока закончатся колебания жидкости в манометре. Подождать, пока воздух в баллоне, охладившийся при адиабатическом расширении, прогреется до комнатной температуры. Записать эту разность Δh2. По полученным значениям Δh1 и Δh2 вычислить 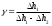 Опыт проделать пять раз и по полученным данным вычислить среднее значение 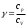 Выпустить воздух из баллона, открыв на некоторое время кран К2. Вычислить абсолютную и относительную погрешности определения γ
Контрольные вопросы Что называется теплоемкостью? удельной теплоемкостью? молярной теплоемкостью? Запишите связь между удельной и молярной теплоемкостями. Дайте определение ср и сV, Ср и СV. От чего зависит теплоемкость? Выведите уравнение Майера (связь Ср и СV). Что больше и почему Ср или СV? Какой процесс называется адиабатическим. Запишите уравнение адиабаты. Что и почему идет круче адиабата или изотерма? Запишите первое начало термодинамики для адиабатического процесса. Чему равны: количество теплоты, внутренняя энергия и работа при адиабатическом процессе? Выведите уравнение Пуассона. Чему равен показатель адиабаты? От чего он зависит? Сколько раз и когда в лабораторной работе происходит адиабатический процесс? Дайте определение энтропии. Какой параметр постоянен при адиабатном процессе? Запишите второе начало термодинамики. Какой процесс называется циклическим? Цикл Карно. КПД цикла Карно. На каких участках цикла Карно тепло подводится, забирается, и на каких совершается работа газом и над газом? |