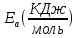Исследование скорости химический реакций и химического равновесия
 Скачать 171.8 Kb. Скачать 171.8 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра общей химии ОТЧЁТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №7 Тема: Исследование скорости химический реакций и химического равновесия Выполнил: студент гр. БТБ-21 Котов Я.И. (номергруппы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил: (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2021 Цель работы: изучить зависимость скорости реакции от концентрации реагентов и температуры, а также ознакомиться с влиянием концентрации реагентов на химическое равновесие. Общие сведения Средняя скорость реакции равна изменению молярной концентрации реагента в единицу времени при постоянстве объёма системы. Единицы измерения в СИ: моль/м3٠с. Истинная скорость реакции равна модулю производной концентрации по времени:  Скорость реакции пропорциональна числу столкновений между молекулами реагентов, которое определяется произведение их концентраций. Если в акте реакции участвуют несколько молекул одного из реагентов, то его концентрацию надо перемножить соответствующее число раз, то есть возвести в степень. Для одностадийной реакции типа: αА+βB→ … скорость будет равна:  = k [A]α * [B]β, = k [A]α * [B]β,Где [A] и [B] – молекулярные концентрации реагентов; k – константа скорости реакции. Константа скорости не зависит от времени протекания реакции и концентрации реагентов, но зависит от природы участников реакции, температуры и присутствия катализаторов. Если реакция протекает в несколько стадий, то значения α и β равны стехиометрическим коэффициентам в уравнении самой медленной стадии реакции. Их называют частными порядками реакции по данным реагентам. Общий порядок реакции равен сумме частных порядков: n = α + β. Реакция разложения тиосульфата натрия является процессом первого порядка, n = 1. Следовательно, скорость пропорциональна концентрации тиосульфата в первой степени.  Проинтегрируем это уравнение от исходной концентрации С0 до концентрации в текущий момент времени Cτ.  Полученное уравнение позволяет рассчитать концентрацию реагента в любой момент времени. Необходимое для расчетов значение константы скорости определяют по экспериментальной зависимости концентрации реагента от времени протекания реакции. Для реакции первого порядка зависимость Inc = f(t) прямолинейная, при этом её угловой коэффициент равен константе скорости. Скорость реакции резко зависит от температуры. Известно экспериментально правило Вант-Гоффа: «При увеличении температуры на 10 К скорость химической реакции возрастает в 2 – 4 раза»: 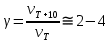 где γ – температурный коэффициент скорости реакции. Для перестройки химических связей в молекулах в ходе элементарного акта реакции требуются большие затраты энергии. Минимальное количество кинетической энергии молекул, необходимое для протекания элементарного акта реакции при столкновении, называют энергией активации. Домножив её на число Авогадро, получим молярную энергию активацию Еа, которую измеряют Дж/моль. Из закона Максвелла и Больцмана следует, что число частиц с высокими энергиями теплого движения увеличивается экспоненциально с ростом температуры, чем и обусловлено высокие температурные коэффициенты скорости химических реакции. Согласно уравнению Аррениуса, константа скорости находиться в экспоненциальной зависимости от температуры: 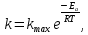 где R, - универсальная газовая постоянная, равная 8,314 Дж/моль*K; 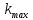 – предэкспоненциальный фактор, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуры, когда все столкновения молекул реагентов становятся активными. Уравнение Аррениуса используют чаще в логарифмической форме: – предэкспоненциальный фактор, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуры, когда все столкновения молекул реагентов становятся активными. Уравнение Аррениуса используют чаще в логарифмической форме: Переход от одного равновесного состояния к другому в результате изменения внешних условий (температуры, давления, добавки одного из реагентов) называют смещением равновесия в сторону обратной реакции. Принцип Ле-Шателье: «Равновесие смещается в сторону реакции, ослабляющей оказываемое на систему внешнее воздействие». Большинство химических реакции являются обратимыми, то есть могут протекать так в прямом, так и в обратном направлениях. Рассмотрим обратимую реакцию: aA + bB ↔ cC + dD. Скорости прямой и обратной реакции связаны с концентрациями реагентов следующими уравнениями:  пр = Kпр[A]a*[B]b пр = Kпр[A]a*[B]b обр = Kобр[C]c*[D]d обр = Kобр[C]c*[D]dС течением времени скорость прямой реакции будет уменьшаться в следствии расхода реагентов А и B при понижении их концентрации. Напротив, скорость обратной реакции по мере накопления продуктов С и D будет возрастать. Поэтому через некоторый промежуток времени скорость прямой и обратной реакции сравняются друг с другом. Установится состояние системы, в котором отсутствует потоки вещества и энергии, вызываемые химическим равновесием. Все обратимые процессы протекают не полностью, а лишь до состояния равновесия, в котором из условия  пр = пр =  обр следует: обр следует: = =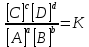 Где 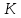 – константа химического равновесия, которая зависит от температуры и природы регентов, но не зависит от концентрации последних. – константа химического равновесия, которая зависит от температуры и природы регентов, но не зависит от концентрации последних. Ход работы: Опыт 1. Влияние концентрации тиосульфата натрия на скорость разложения в кислой среде.
Таблица №1. Приготовление раствора.
Таблица №2. Результаты опыта. Найдем значение скорости реакций:  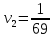 = 0,014 = 0,014  Вывод: В ходе опыта установили, что скорость химической реакции находится в прямой зависимости от концентрации веществ. С увеличением концентрации происходит и увеличение скорости реакций. 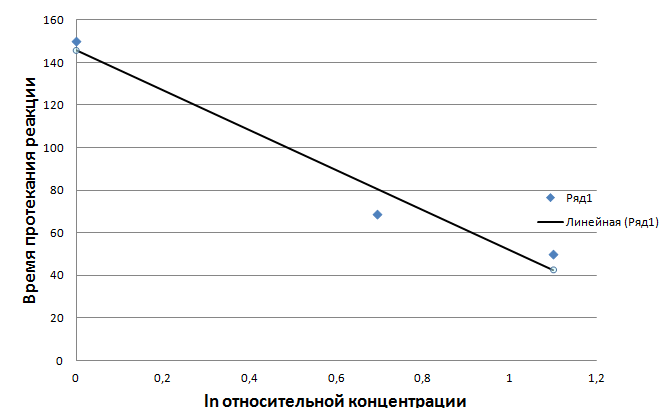 Опыт№2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
Среднее значение 𝛾=1,24 Среднее значение энергии активации 15,3 кДж/моль Вывод: скорость реакции увеличилась в 1,24 раза при увеличении температуры на 10 К Опыт №3. Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе.
Вывод:При увеличении площади поверхности, реакция начинает происходить быстрее и увеличивается скорость. Вывод: в ходе экспериментов удалось определить, что скорость химической реакции зависит от концентрации веществ, температуры, а также площади поверхности. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||