БХ з-1. Источники и пути использования аминокислот в клетке
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
|
Источники и пути использования аминокислот в клетке. Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем равно 3565 мг/дл. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений (рис. 9-1). Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триаци-лглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи. Обмен серина и глицина. Образование и использование одноуглеродных фрагментов. Серин и глицин являются полярными и заменимыми аминокислотами. Роль реакции превращения серина в глицин состоит в образовании активной формы тетрагидрофолиевой кислоты – N5,N10-метилен-ТГФК. 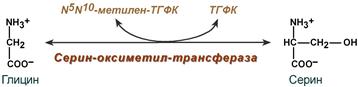 Реакция взаимопревращения глицина и серина Одновременно данная реакция является первой на пути катаболизма серина. В других реакциях своего метаболизма серин при синтезе глюкозы подвергается неокислительному дезаминированию под действием фермента сериндегидратазы с образованием пирувата, на пути образования холина или бетаина декарбоксилируется, при образовании сфингозина – конденсируется с пальмитиновой кислотой. Несмотря на простоту строения, глицин и серин являются весьма востребованными аминокислотами в клетках. Благодаря взаимопревращению перечень возможных путей метаболизма этих аминокислот еще больше расширяется. Образование и использование одноуглеродных фрагментов Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH) Ещё один источник формального и форми-мино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат. Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных (формиминоглицина и т.д.) Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени. Роль фолиевой кислоты в обмене аминокислот. Недостаточность фолиевой кислоты. Витамин В9 (Вс, фолиевая кислота, витамин роста)ИсточникиРастительные продукты, дрожжи, мясо, печень, почки, желток яиц. Витамин активно синтезируется дружественной кишечной микрофлорой. Суточная потребность 400 мкг.СтроениеВитамин представляет собой комплекс из трех составляющих – птеридина, пара-аминобензойной кислоты и глутаминовой кислоты. Остатков глутамата, соединенных через γ-карбоксильную группу, может быть разное количество. Роль: В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Этот витамин широко распространён в животных и растительных пищевых продуктах. Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот Фолиевую кислоту (фолат) называют также птероилглутаминовой кислотой. Птерины широко распространены в природе. Некоторые из них, например ксантоптерин, являются пигментами глаз и крыльев насекомых (бабочек). Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат) (см. схему Г). Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH. Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат (см. схему Д). Гиповитаминоз B9ПричинаПищевая недостаточность, кислые продукты, тепловая обработка пищи, прием лекарств (барбитураты, сульфаниламиды и антибиотики, некоторые цитостатики – аминоптерин, метотрексат), алкоголизм и беременность. Клиническая картинаДефицит фолиевой кислоты в организме тормозит синтез тимидилтрифосфата, что приводит к снижению синтеза ДНК в быстроделящихся клетках – костного мозга, эпителиальных тканей. В первую очередь затрагиваются органы кроветворения: так как клетки не теряют способности расти, но в них происходит нарушение синтеза ДНК с остановкой деления, то это приводит к образованию мегалобластов (крупных незрелых клеток) и мегалобластической анемии. По той же причине наблюдается лейкопения. Аналогично развивается поражение слизистых желудка и кишечного тракта (гастриты, энтериты), глоссит. Наследственные нарушения обмена глицина. В настоящее время известно несколько заболеваний, связанных с нарушениями обмена глицина. В их основе лежит недостаточность какого-либо фермента или дефект системы транспорта этой аминокислоты. Некоторые из этих нарушений представлены ниже. Гиперглицинемияхарактеризуется повышенной концентрацией глицина в крови вследствие дефекта глицинрасщепляющей ферментной системы. Наиболее тяжёлое проявление гипер-глицинемии - резкое повреждение мозга, судороги, гипотония, нарушение дыхания. Глицинурияхарактеризуется повышенным выделением глицина с мочой (до 1 г/сут) при нормальном содержании его в крови. Один из симптомов этого заболевания - образование ок-салатных камней в почках, причём содержание оксалата в моче находится в пределах нормы. Избыток оксалата имеет эндогенное происхождение. Скорее всего, он получается из глицина, при дезаминировании которого образуется глиоксилат - предшественник оксалата. Метаболический дефект, очевидно, состоит в нарушении метаболизма глиоксилата - невозможности его превращения снова в глицин из-за дефекта глицинаминотрансферазы. Причиной глицинурии является, очевидно, нарушение реабсорбции глицина в почках. Наследуется как доминантный признак, сцепленный, вероятно, с Х-хромосомой. Первичная гипероксала гурияхарактеризуется постоянно высоким выделением оксалата с мочой, независимо от поступления его с пищей. В дальнейшем прогрессирует двустороннее образование оксалатных камней в мочевыводящих путях, развиваются нефрокальциноз и инфекция мочевыводящих путей. Больные погибают в детском возрасте от почечной недостаточности или гипертонии. Обмен серосодержащих аминокислот. Особенности обмена метионина. Серосодержащие аминокислоты – аминокислоты, содержащие атомы серы. Список: метионин; цистеин; цистин. Они окисляются в тканях с образованием ионов серной кислоты. Самые разнообразные пути метаболического превращения у метионина. Характеристика серосодержащих аминокислот в таблице.
ФункцииСеросодержащие аминокислоты играют важную роль в биохимических процессах, вступают в реакции окисления, алкилирования, трансаминирования, ацилирования, переаминирования, декарбоксилирования. Их биологическая роль: передача энергии; синтез ферментов, белков, гормонов, витаминов, нуклеиновых кислот, коллагена, кератина; антиоксидантное действие, торможение процессов старения стимуляция иммунного ответа; улучшение состояния волос, ногтей; обезвреживание токсических веществ; липотропное действие; регенерация клеток, формирование новых тканей. Они защищают клетки печени и головного мозга от действия токсинов. Признаки дефицитаПри недостатке серосодержащих аминокислот появляются такие симптомы: воспалительные процессы, в том числе и в суставах; ухудшение когнитивных способностей медленное заживление ран; Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции. Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метальная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты. Реакция активация метионина Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А). Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT). 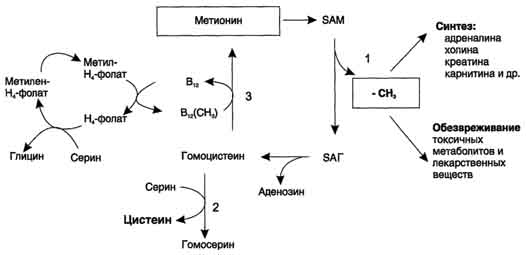 Метаболизм метионина. 1 - реакции трансметилирования; 2 - синтез цистеина; 3 - регенерация метионина. Применяют метионин для лечения и профилактики заболеваний и токсических поражений печени (цирроз, хронический гепатит), сопровождающихся жировой инфильтрацией, но без выраженной печеночной недостаточности. Используется препарат при сочетаниях заболеваний печени и поджелудочной железы (хронический панкреатит, сахарный диабет), применяется при отравлениях бензолом, хлороформом, мышьяком и другими ядами, поражающими печень, а также при алкоголизме. Показано применение метионина при атеросклерозе, дистрофиях, истощениях в связи с перенесенными тяжелыми инфекциями. Примеры реакций трансметилирования (привести не менее трех примеров). Регенерация метионина. Трансметилирование – это транспорт метильной группы от источника метильных групп к субстрату метилирования с помощью доноров или переносчиков метильных групп. Источниками метильных групп служат серин, холин, бетаин. Переносчиками или донорами метильных групп для субстратов служат активная форма фолиевой кислоты – тетрагидрофолиевая кислота (ТГФК) и активная форма метионина – S-аденозилметионин Примеры реакций трансметилирования Синтез фосфатидилхолина из фосфатидилэтиноламина Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов 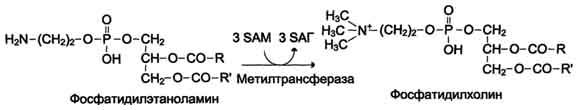 Синтез креатина.Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почкахобразуется гуанидинацетат при действии глицинамидинотрансферазы 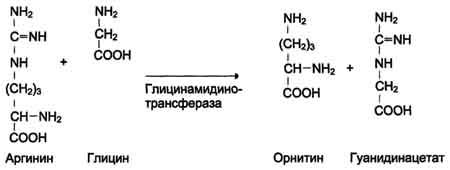 Затем гуанидинацетат транспортируется в печень,где происходит реакция его метилирования 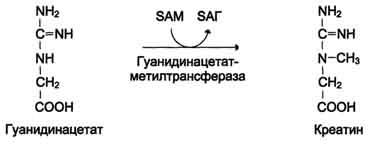 Креатин с кровотоком переносится в мышцы и клетки мозга,где из него образуется высокоэнергетическое соединение - креатинфосфат. Определение содержания креатина и креати-нина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии и др. Реакции трансметилирования используются также для: синтеза адреналина из норадреналина; синтеза анзерина из карнозина; метилирования азотистых оснований в нук-леотидах и др.; инактивации метаболитов (гормонов, медиаторов и др.) и обезвреживания чужеродных соединений, включая и лекарственные препараты. Регенерация метионинаПосле отдачи метильной группы в реакции трансметилирования S-аденозилметионин (SAM) превращается вS-аденозилгомоцистеин (SAG). Под действием специфической гидролазы это вещество распадается на гомоцистеин и аденозин: Гомоцистеин может вновь превращаться в метионин в реакции трансметилирования с 5-метил-Н4-фолатом: 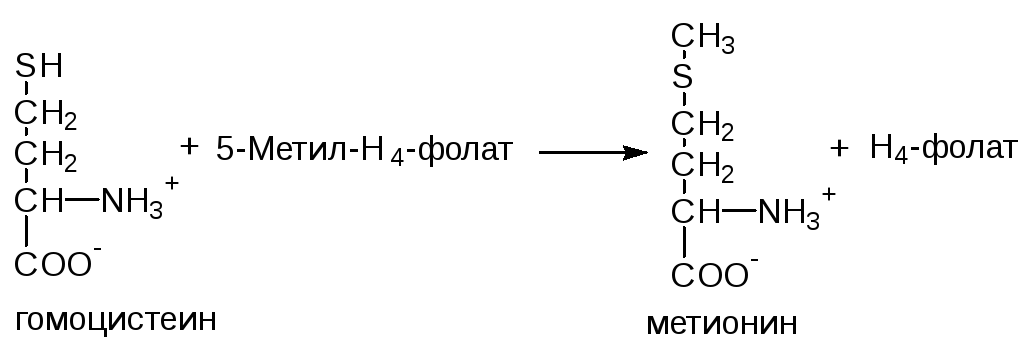 Промежуточным переносчиком метильной группы в этой реакции служит метилкобаламин – производное витамина В12. Данная реакция представляет собой “путь спасения” метионина. обмен цистеина. это заменимая аминокислота, она синтезируется из серина, гидроксильная группа которого замещается sн-группой, которую поставляет гомоцистеин. цистеин в составе белков-ферментов своей -sн группой участвует в образовании каталитического центра (тиоловые протеазы), а также участвует в образовании дисульфидных связей, которые принимают участие в формировании третичной и четвертичной структуры белков. также цистеин необходим для синтеза трипептида глютатиона, который состоит из цистеина и глютаминовой кислоты. цистеин подвергается и распаду, при этом он окисляется и декарбоксилируется, в результате образуется таурин, который участвует в образовании парных желчных кислот (таурохолевая и др.) в печени. серная кислота, которая образуется из таурина, участвует в обезвреживании токсических веществ в печени так обезвреживаются продукты гниения белков в кишечнике - индол, скатол, фенол и крезол. в этих процессах серная кислота участвует в своей активной форме в виде 3’-фосфоаденозин-5’-фосфосульфата (фафc), которая образуется с участием атф. цистеин является чрезвычайно важной аминокислотой в связи с тем, что это единственный источник органической серы для клеток организма. в результате реакций метаболизма эта сера переходит в состав других серусодержащих веществ – фосфоаденозинфосфосерная кислота (фафс), коэнзим а, глутатион, сульфированные гетерополисахариды (хондроитинсульфат, кератансульфат, дерматансульфат) или выводится почками в виде сульфатов. 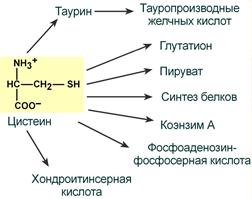  метаболизм фенилаланина и тирозина. два пути использования фенилаланина в тканях. метаболизм фенилаланина и тирозина фенилаланин – незаменимая аминокислота, так как в клетках животных не синтезируется ее бензольное кольцо основное количество фенилаланина расходуется по 2 путям: -включается в белки; -превращается в тирозин. превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. основной путь метаболизма фенилаланина начинается с его гидроксилирования в результате чего образуется тирозин. эта реакция катализируется специфической монооксиге-назой - фенилаланингидроксилазой, коферментом которой служит тетрагидробиоптерин (н4бп). активность фермента зависит также от наличия fe2+. реакция необратима. н4бп в результате реакции окисляется в дигидробиоптерин (н2бп). регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием nadph + h+. . обмен тирозина значительно сложнее. кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений как катехоламины, тироксин, меланин и др. Катаболизм тирозина в печени: Ферменты : 1 реакция – тирозинаминотрансфераза 2 – n-гидроксифенилпируватдиоксигеназа 3 -диоксигеназа гомогентизиновой кислоты 4-фумарилацетоацетатгидролаза в печени происходит катаболизм тирозина до конечных продуктов фумарата и ацетоацетата. фумарат может окислятся до со2 и н2о или использоваться для глюконеогенеза. превращение тирозина в меланоцитах. он является предшественником меланинов. синтез меланинов – сложный многоступенчатый процесс, первую реакцию – превращение тирозина в дофа – катализирует тирозиназа, использующая в качестве кофактора ионы меди. в щитовидной железе из тирозина синтезируются гормоны тироксин и трийодтиронин. в мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов. промежуточным продуктом их синтеза является дофа. однако в отличие от меланоцитов, гидроксилирование тирозина осуществляется под действием тирозингидроксилазы, которая является fe2+-зависимым ферментом, и его активность регулирует скорость синтеза катехоламинов. Особенности обмена тирозина в разных тканях. Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О. Катаболизм тирозина в печени. В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумарата и ацетоацетата. Превращение тирозина в меланоцитах. В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов. Среди них преобладают 2 типа: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) - нерастворимые высокомолекулярные гетерополимеры 5,6-дигидроксииндола и некоторых его предшественников. Феомеланины - жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах. Находятся они, в основном, в составе волос. Меланины присутствуют в сетчатке глаз. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов. Первую реакцию - превращение тирозина в ДОФА - катализирует тирозиназа, использующая в качестве кофактора ионы Сu+. Превращение тирозина в щитовидной железе. В щитовидной железе синтезируются и выделяются гормоны йодтиронины: тироксин (тет-райодтиронин) и трийодтиронин. Эти гормоны представляют собой йодированные остатки тирозина, которые попадают в клетки щитовидной железы через базальную мембрану. Превращения тирозина в надпочечниках и нервной ткани (синтез катехоламинов) .В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов (дофамина, норадреналина и адреналина). При образовании катехоламинов, которое происходит в нервной ткани и надпочечниках, и меланина в меланоцитах промежуточным продуктом служит диоксифенилаланин (ДОФА) . Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами: Тирозиназа в меланоцитах является Сu+-зависимым ферментом (см. выше). Тирозингидроксилаза (1) в надпочечниках и ка-техоламинергических нейронах не нуждается в ионах меди. Это - Fе2+-зависимый фермент, аналогично фенилаланингидроксилазе в качестве кофермента использующий Н4БП. Физиологическая роль тирозингидроксилазы чрезвычайно велика, так как этот фермент является регуляторным и определяет скорость синтеза катехоламинов.\ Активность тирозингидроксилазы значительно изменяется в результате: 1. Аллостерической регуляции (ингибитор - норадреналин); 2.Фосфорилирования/дефосфорилирования: в результате фосфорилирования с участием протеинкиназы А снижаются Кm для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы. 10 Заболевания, связанные с нарушением обмена фенилаланина и тирозина Известно несколько наследственных заболеваний, связанных с дефектом ферментов обмена фенилаланина и тирозина в разных тканях. Фенилкетонурия В печени здоровых людей небольшая часть фенилаланина (∼10%) превращается в фенил-лактат и фенилацетилглутамин (рис. 9-30). +Этот путь катаболизма фенилаланина становится главным при нарушении основного пути - превращения в тирозин, катализируемого фенил-аланингидроксилазой. Такое нарушение сопровождается гиперфенилаланинемией и повышением в крови и моче содержания метаболитов Тирозинемии Некоторые нарушения катаболизма тирозина в печени приводят к тирозинемии и тирози-нурии. Различают 3 типа тирозинемии. Тирозинемия типа 1 (тирозиноз). Причиной заболевания является, вероятно, дефект фермента фумарилацетоацетатгидролазы, катализирующего расщепление фумарилацетоа-цетата на фумарат и ацетоацетат (рис. 9-28). Накапливающиеся метаболиты снижают активность некоторых ферментов и транспортных систем аминокислот. Патофизиология этого нарушения достаточно сложна. Острая форма тирозиноза характерна для новорождённых. Клинические проявления - диарея, рвота, задержка в развитии. Без лечения дети погибают в возрасте 6-8 мес из-за развивающейся недостаточности печени.Хроническая форма характеризуется сходными, но менее выраженными симптомами. Гибель наступает в возрасте 10 лет. Содержание тирозина в крови у больных в несколько раз превышает норму. Для лечения используют диету с пониженным содержанием тирозина и фенилаланина. Тирозинемия типа II (синдром Рихнера-Ханхорта). Причина - дефект фермента тирозина-минотрансферазы. Концентрация тирозина в крови больных повышена. Для заболевания характерны поражения глаз и кожи, умеренная умственная отсталость, нарушение координации движений. Тирозинемия новорождённых (кратковременная). Заболевание возникает в результате снижения активности фермента п-гидроксифенилпируватдиоксигеназы, превращающего п-гидроксифенилпируват в гомогентизиновую кислоту (рис. 9-28). В результате в крови больных повышается концентрация п-гидроксифенилацетата, тирозина и фенил-аланина. При лечении назначают бедную белком диету и витамин С. Алкаптонурия ("чёрная моча") Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты (рис. 9-28). Дл этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. Это метаболическое нарушение было описано ещё в XVI веке, а само заболевание охарактеризовано в 1859 г. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота - 2-5 случаев на 1 млн новорождённых. Заболевание наследуется по аутосомнорецессивному типу. Диагностических методов выявления гетерозиготных носителей дефектного гена к настоящему времени не найдено. Альбинизм Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов. Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000. Нарушение синтеза катехоламинов (рис. 9-28) может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества. Болезнь Паркинсона Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы: заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др. подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.). +Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина. Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении. Обмен гистидина Обмен гистидина включает синтез гистамина в соединительной ткани, а также путь катаболизма, который происходит в печени и, частично, в коже человека. В печении коже дезаминирование гистидина катализирует фермент гистидаза.Образующийся уроканат только в печени способен превращаться через ряд стадий в глутамат. Наследственный дефект гистидазы вызываетнакопление гистидина в организме и развитие гистидинемии,которая проявляется задержкой в умственном и физическом развитии детей. Ферменты гистидаза и уроканиназа(рис. 9.24) являются гепатоспецифическими,поэтому их определение используется в клинике для диагностики поражений печени 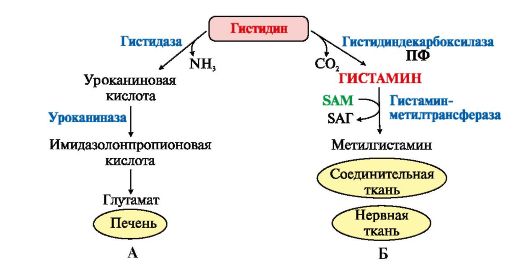 Основные функции гистамина 1.Защитная: как медиатор воспаления защищает организм от воздействия агрессивных факторов внешней среды. 2. Является пищеварительным гормоном: стимулирует выделение слюны и желудочного сока +3.Является нейромедиатором, ответственным за регуляцию сна и бодрствования: активирует нервные клетки, противодействует сну. Роль аргинина и орнитина в синтезе биологически активных молекул Аргинин является положительно заряженной и условно незаменимой аминокислотой. Понятие условно-незаменимая используется по той причине, что у детей и подростков, у пожилых людей синтез аргинина не покрывает потребности организма. Аргинин в тканях входит в состав белков и, в частности, в большом количестве присутствует в гистонах, регулирующих активность ДНК. Метаболизм аргинина по аргиназному пути ведет к синтезу регуляторных полиаминов спермина и спермидина (см ниже). Превращение по NO-синтазному пути используется для образования оксида азота (NO), выполняющего функцию передатчика сигналов. Аргинин участвует в орнитиновом цикле синтеза мочевины и при синтезе креатина, выполяющего функцию запасного макроэрга. 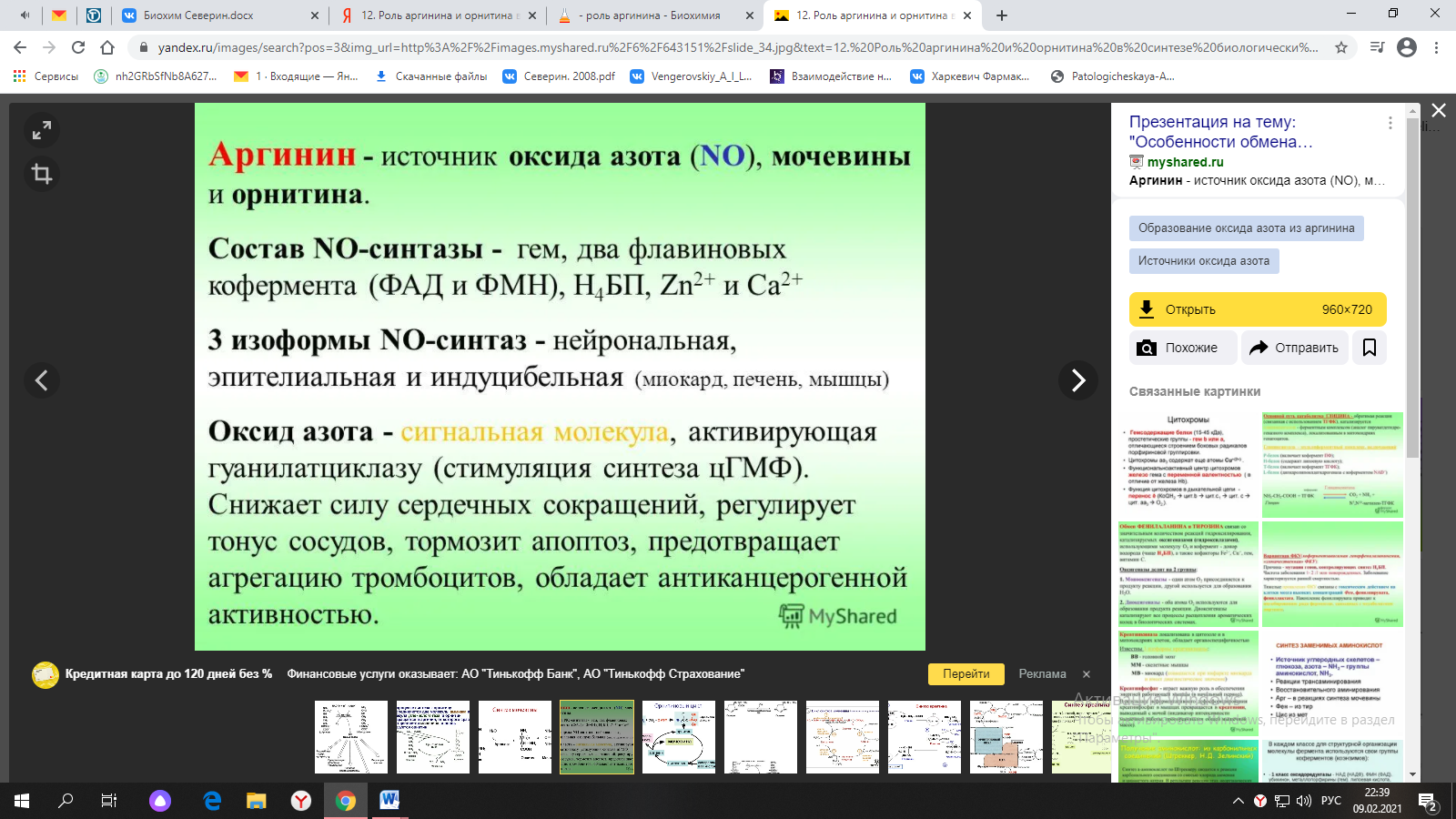 Аргинин под действием аргиназы превращается в аминокислоту орнитин, которая не входит в состав белков организма. Из орнитина синтезируются полиамины спермидин и спермин Орнитин (диаминовалериановая кислота) – заменимая аминокислота, не входящая в состав белков, играет важную роль в биосинтезе мочевины. Орнитин – важный промежуточный продукт в синтезе аргинина. Орнитин в организме: оказывает гепатопротективное, дезинтоксикационное, гипоазотемическое действие; стимулирует реакцию образования мочевины из аммиака в орнитиновом цикле мочевинообразования; улучшает белковый обмен при заболеваниях, требующих парентерального питания; способствует выработке инсулина и соматотропного гормона (гормона роста); активизирует расщепление жирных кислот; участвует в ряде обменных процессов, повышает иммунитет путем активизации синтеза глютамина; укрепляет связки и сухожилия. |
