Биохимия. Итоговый контроль Обмен и функции углеводов
 Скачать 2.56 Mb. Скачать 2.56 Mb.
|
|
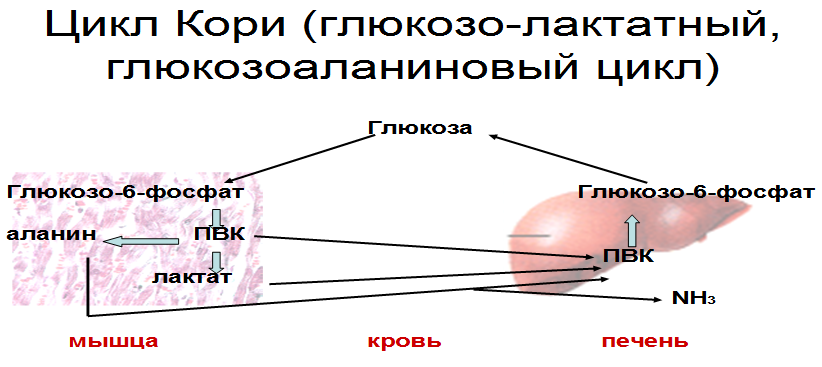
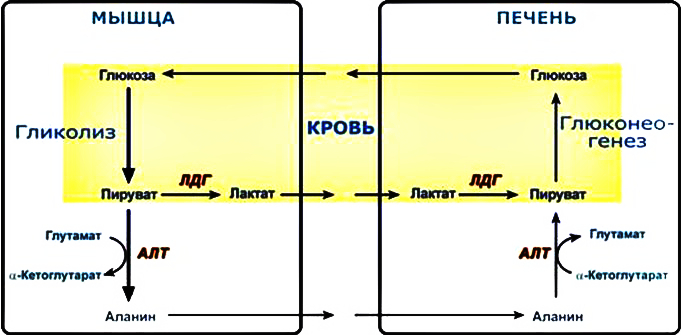
Выделяют 2 этапа: 1) Подготовительный – глюкоза фосфорилируется и расщепляется на 2 молекулы фосфотриоз. Используются 2 молекулы АТФ. 2) Этап, сопряженный с синтезом АТФ. Фосфотриозы превращаются в ПВК, которая далее окисляется до СО2 и Н2О ( ЦТК). Таким образом, выход АТФ – 38 молекул. Основное физиолог. значение – исп. энергии, которая освобождается в этом процессе для синтеза АТФ. Метаболиты гликолиза исп. для синтеза новых соединений (фр-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата – структурного компонента нуклеозидов; 3-фосфоглицерат включается в синтез аминокислот: серин, глицин, цистеин). Являются субстратами для НАД-зависимых дегидрогеназ дых. цепи (пируват, изоцитрат, α-кетоглутарат, малат). В печени и жировой ткани ацетил-КоА используется как субстрат при биосинтезе жирных кислот, холестерина. 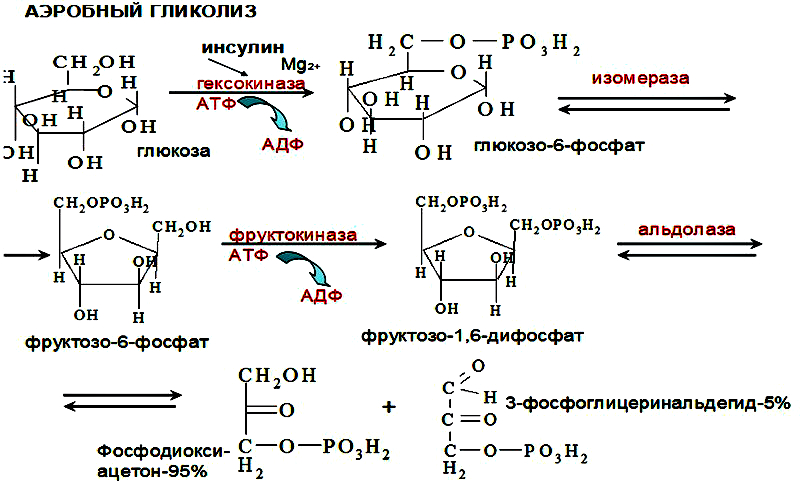  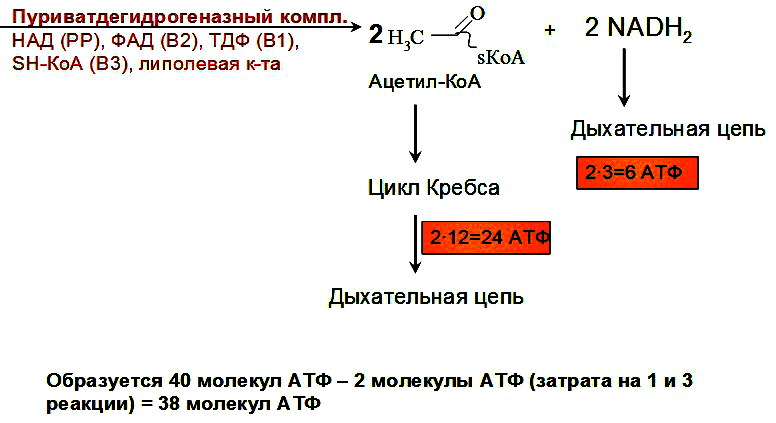 10. Анаэробное окисление углеводов (гликолиз), последовательность реакций, энергетический эффект, биологическая роль. Анаэробный гликолиз – процесс расщепления глюкозы с образованием конечного продукта лактата. Он протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счет субстратного фосфорилирования (2 АТФ). Протекает в мышцах, в первые минуты мышечной работы (клетки скелетной мускулатуры за счет процесса способны выполнять интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта), в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжения их кислородом, в том числе в опухолевых клетках. Этот процесс служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кров. сосудов. Бескислородное окисление глюкозы усиливается при гипоксииклеток (анемии, нарушения кровообращения). Энергетический баланс анаэробного окисления глюкозы: образование 2 АТФ (4 в результате субстратного фосфорилирование – 2 молекулы АТФ). Основное физиолог. значение: использование энергии, которая освобождается в этом процессе для синтеза АТФ. Метаболиты гликолиза используются для синтеза новых соединений (фр-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата – структурного компонента нуклеозидов; 3-фосфоглицерат включается в синтез аминокислот: серин, глицин, цистеин). Реакции: (см. вопрос 9, включая реакцию образования ПВК, см. вопрос 11). 11. Сходство и различие аэробного и анаэробного окисления глюкозы. Эффект Пастера. Сходство анаэробного и аэробного гликолиза заключается в том, что до стадии образования ПВК эти процессы протекают одинаково при участии тех же ферментов. Р 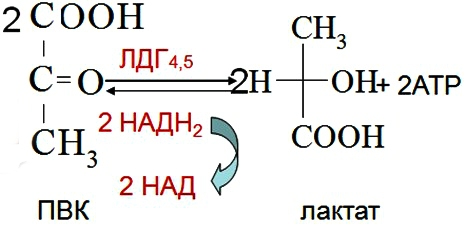 азличия: 1) Локализация в клетке: анаэробное – цитоплазма, аэробное – митохондрии. азличия: 1) Локализация в клетке: анаэробное – цитоплазма, аэробное – митохондрии.2) Скорость: анаэробное – очень быстро, аэробное – медленно. 3) Формы энергии: анаэробное – химическая, аэробное – химии., электрохим. 4) Конечные продукты: анаэробное – ПВК, молочная к-та, аэробное – СО2, Н2О. 5) Кол-во АТФ : анаэробное – 2 молекулы, аэробное – 38 молекул. 6) Условия протекания: анаэробное – отсутствие О2, аэробное – О2, дыхат. ферменты, мембраны. Эффект Пастера: это снижение потребления глюкозы и прекращение продукции лактата клеткой в присутствии О2, т.е. происходит переключение с аэробного гликолиза на анаэробное оксиление. Если ткани снабжены О2, то 2 НАDН2, образовавшийся в процессе центральной реакции оксидоредукции, окислится в дыхательной цепи, поэтому ПВК превращается не в лактат, а в ацетил-Ко-А, который вовлекается в ЦТК. Т. о., биох. механизм эффекта заключается в конкуренции за пируват между пируватдегидрогеназой, превращающей пируват в ацетил-S-КоА, и лактатдегидрогеназой, превращающей пируват в лактат. 12. Глюконеогенез, регуляция. Глюкозо-лактатный цикл (цикл Кори). Глюконеогенез - это процесс синтеза глюкозы из веществ неуглеводной природы (лактата, пирувата, глицерола, аминокислот). Процесс протекает в печени и менее интенсивно в корковом веществе почек, а также в слизистой кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. Первичные субстраты – лактат, аминокислоты, глицерол. Их включение в глюконеогенез зависит от физиологического состояния организма: 1) лактат – постоянно; 2) глицерол – высвобождается при гидролизе жиров в период голодания или при длительной физической нагрузке; 3) аминокислоты – образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе. Е 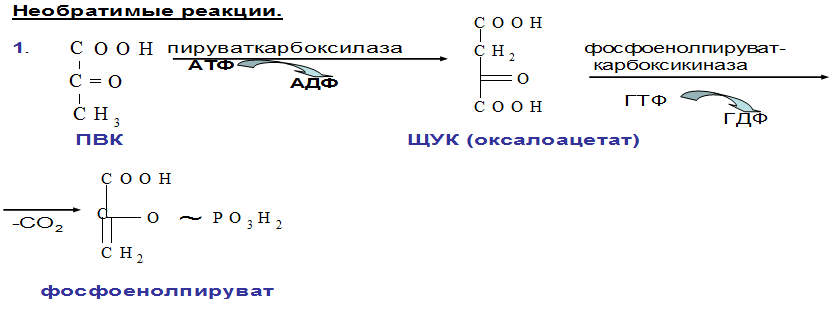 сли гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях. Процесс идет обратно анаэробному гликолизу за исключением 3-х необратимых реакций. В этих реакциях происходит высвобождение энергии для синтеза АТФ. Поэтому в обратном процессе возникают энергетические барьеры. которые клетка обходит с помощью реакций, катализируемых др. ферментами. сли гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях. Процесс идет обратно анаэробному гликолизу за исключением 3-х необратимых реакций. В этих реакциях происходит высвобождение энергии для синтеза АТФ. Поэтому в обратном процессе возникают энергетические барьеры. которые клетка обходит с помощью реакций, катализируемых др. ферментами.1) Пируваткиназная – образование фосфоенолпирувата из ПВК происходит в ходе 2-х реакций, первая из кот. протекает в митохондриях. ПВК транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалацетата. Фермент -пируваткарбоксилаза, коферментом которым является биотин. Реакция протекает с исп. АТФ. Затем оксалацетат (в цитозоле) превращается в фосфоенолпируват входе реакции, катализируемой фосфоенолпируваткарбоксилазой – ГТФ-зависимым ферментом ( -СО2, ГТФ → ГДФ). 2 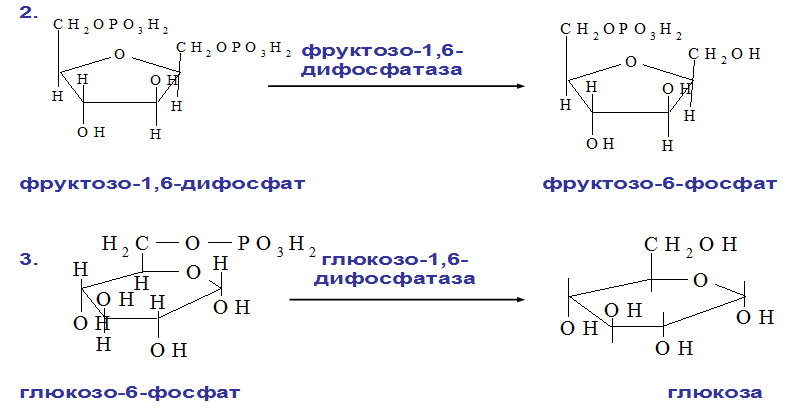 ) Фосфофруктокиназная: ФР-1,6-дифосфат →Фр-6-фосфат под действием фермента фруктозо-1,6-бифосфатаза. ) Фосфофруктокиназная: ФР-1,6-дифосфат →Фр-6-фосфат под действием фермента фруктозо-1,6-бифосфатаза.3) Гексокиназная: Гл-6-фосфат → Глюкоза под действием фермента Гл-6-фосфатазы. Значение: поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физ. нагрузок. Регуляция: инсулин – тормозит синтез ферментов; глюкокортикоиды – индуцируют синтез ферментов; СТГ – повышает активность ферментов глюконеогенеза. Глюкозо-лактатный цикл (цикл Кори, взаимосвязь гликолиза в мышцах и глюконеогенеза в печени) - это циклический процесс, объединяющий реакции глюконеогенеза и анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступаю-щий в основном из эритроцитов или мышечной ткани. Утилизировать лактат можно только одним способом – превратить ее в ПВК. Через 0,5‑1,5 часа в мышце лактата уже нет. Малая часть лактата выводится с мочой. Большая часть лактата крови захватывается гепатоцитами, окисляется в ПВК и вступает в глюконеогенез. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по др. органам.
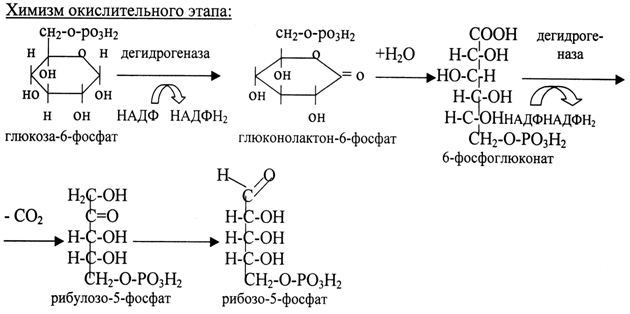
13. Пентозофосфатный путь распада углеводов, его значение для организма, химизм окислительной стадии. Нарушение пентозофосфатного пути распада углеводов. Пентозофосфатный путь явл. альтернативным путем окисления глюкозы. Это путь окисления глюкозы путем укорочения углеродной цепочки на один углеродный атом. Наиболее активно реакции пентозофосфатного пути идут в клетках печени, жировой ткани, эритроцитов, коры надпочечников, молочной железы при лактации, в меньшей степени в скелетных мышцах. Этот путь окисления глюкозы не связан с образованием энергии, а обеспечивает анаболизм клеток. В связи с этим у новорожденных и детей первых лет жизни его активность довольно высока.
Биологическая роль: 1) Образуются пентозы, необходимые для синтеза нуклеиновых кислот (ДНК, РНК), коферментов (НАД, НАДФ, ФМН, ФАД); 2) НАДФН2 – водороды которого необходимы для восстановительных синтезов (синтез высших жирных кислот, холестерола, гормонов коры надпочечников, половых гормонов, провитаминов группы Д, желчных кислот); 3) Для систем антиоксидантной защиты клетки от свободнорадикального окисления (эритроциты) (т.е. участвует в обезвреживании лекарственных веществ и ядов в печени). Нарушение пентозофосфатного пути: Следствием генетического дефекта глюкозо-6-фосфат-дегидрогеназы является снижение синтеза НАДФН2 в клетке. Особенно существенно это влияет на эритроциты, в которых окислительный этап цикла является единственным источником НАДФН2. Одной из функций НАДФН2 – нейтрализация активных форм О2, постоянно образующихся в клетке. В частности, Н2О2 восстанавливается до воды с помощью глутатион-зависимой пероксидазы. В результате глутатион окисляется. Восстановление глутатиона катализируетредуктазапри участии НАДФН2, поставляемого пентозофосфатным циклом. После употребления некоторых лекарственных препаратов (сульфаниламиды, парацетамол, аспирин, примахин), в клетках активируются процессы свободнорадикального окисления (внутриклет. окислит. стресс). Здоровая клетка (эритроцит) обезвреживает Н2О2. При недостаточности глюкозо-6-фосфат-дегидрогеназы активность антиоксидантных ферментов ослабевает и Н2О2 накапливается в эритроцитах. Это приводит к повреждению мембран и их гемолизу (до 20%). 14. Сахарный диабет, биохимическая характеристика патогенеза. Сахарный диабет - это заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина. Инсулин – единственный гормон, понижающий уровень глюкозы в крови. Механизм: -повышает проницаемость клеточных мембран для глюкозы в клетках жировой и мышечной ткани, под его влиянием белки-транспортеры ГЛЮТ-4 перемешаются из цитоплазмы в мембрану клетки, где соединяются с глюкозой и транспортируют её во внутрь клетки; -активирует гексокиназу, фруктокиназу, пируваткиназу (стимулирует гликолиз); -активирует гликогенсинтетазу (стимулирует синтез гликогена); -активирует дегидрогеназу пентозо-фосфатного пути; -по механизму хронической регуляции является индуктором синтеза гексокиназы и репрессором синтеза ферментов глюконеогенеза (блокирует глюконеогенез); -30% углеводов превращает в липиды; -стимулирует ЦТК, активируя фермент синтетазу, которая катализирует реакцию взаимодействия ацетил-КоА с ЩУК. Сахарный диабет (СД) классифицируют с учетом различия генетических факторов и клинического течения на две основные формы: диабет I типа – инсулинзависимый (ИЗСД), и диабет II типа – инсулиннезависимый (ИНСД). ИЗСД – заболевание, вызванное разрушением β-клеток островков Лангерханса поджелудочной железы, вследствие аутоиммунных реакций, вирусных инфекций (вирус оспы, краснухи, кори, аденовирус). При СД снижено соотношение инсулин/глюкагон. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация энергоносителей. Печень, мышцы и жировая ткань даже после приема пищи функционируют в режиме постабсорбтивного состояния. При СД возникает гипергликемия, глюкозурия. Почечный порог для глюкозы равен 9-10 ммоль/л. 1) Гипергликемия – повышение конц. глюкозы в крови. Она обусловлена снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения био. действия инсулина в тканях-мишенях. При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани мышц). В мышцах и печени глюкоза не депонируется в виде гликогена. В жировой ткани уменьшается скорость синтеза и депонирования жиров. Активируется глюконеогенез из аминокислот, глицерола и лактата. 2) Глюкозурия – выделение глюкозы с мочой. В норме проксимальные канальцы почек реабсорбируют всю глюкозу, если ее уровень не превышает 8,9 ммоль/л. Повышение конц. глюкозы в крови превышает концентрационный почечный порог, что становится причиной появления ее в моче. 3) Кетонемия – повышение концентрации в крови кетоновых тел. Жиры не депонируются, а ускоряется их катаболизм. Повышается концентрация неэтерифицированных жирных кислот, которые захватывает печень и окисляет их до ацетил–КоА. Ацетил-КоА превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях происходит декарбоксилирование ацетоацетата до ацетона, поэтому от больных исходит его запах. Увеличение концентрации кетоновых тел в крови (выше 20 мг/л) приводит к кетонурии. Накопление кетоновых тел снижает буферную емкость крои и вызывает ацидоз. 4) Дефицит инсулина приводит к снижению скорости синтеза белков и усилению их распада. Это вызывает повышение концентрации аминокислот в крови, которые дезаминируются в печени. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и моче – азотемия. Ранние проявления СД. Данной формой диабета страдают люди молодого возраста (до 40 лет). Полиурия – повышенное мочеотделение (3-4л в сутки и выше), т.к. глюкоза повышает осмотическое давление. Полидипсия – жажда, сухость во рту, вследствие полиурии. Полифагия – испытывают голод, часто едят, но теряют в массе тела, т.к. глюкоза не является источником энергии - «голод среди изобилия». ИНСД – возникает в результате относительного дефицита инсулина вследствие: - нарушения секреции инсулина - нарушения превращения проинсулина в инсулин - повышения катаболизма инсулина -дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала. Поражает людей старше 40 лет, характеризуется высокой частотой семейных форм. Поздние осложнения СД. Главная причина поздних осложнений сахарного диабета – гипергликемия, которая приводит к повреждению кровеносных сосудов и нарушению функций различных тканей и органов. Одним из основных механизмов повреждения тканей при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Макроангиопатии проявляются в поражении крупных и средних сосудов сердца, мозга, нижних конечностей (диабетическая стопа). Микроангиопатия является результатом повреждения капилляров и мелких сосудов и проявляется в форме нефро-, нейро- и ретинопатии. В возникновении микроангиопатий определенную роль играет гликозилирование белков, что приводит к возникновению нефропатии (нарушение функции почек) и ретинопатии (вплоть до потери зрения). Коллаген составляет основу базальных мембран капилляров. Повышенное содержание гликозилированного коллагена ведет к уменьшению его эластичности, растворимости, к преждевременному старению, повышению проницаемости сосудистой стенки (ангиопатии). В почках такие изменения приводят к запустению клубочков и хронической почечной недостаточности. Гликозилированные липопротеины, накапливаясь в сосудистой стенке, приводят к развитию гиперхолестеринемии и липидной инфильтрации. Они служат основой атером, происходит нарушение сосудистого тонуса, что приводит к атеросклерозу. 15. Взаимопревращения моносахаридов. Галактоземия, фруктозурия. Причины, проявления. Взаимопревращение сахаров - это превращение моносахаридов (фруктозы, галактозы и др.), поступающих с пищей в глюкозу для ее дальнейшего использования в реакциях метаболизма. У детей некоторое время после рождения, даже при гипогликемии, в крови отмечается относительный избыток других моносахаридов, например, фруктозы и галактозы, что обычно связано с функциональной незрелостью печени. 1) Метаболизм галактозы.
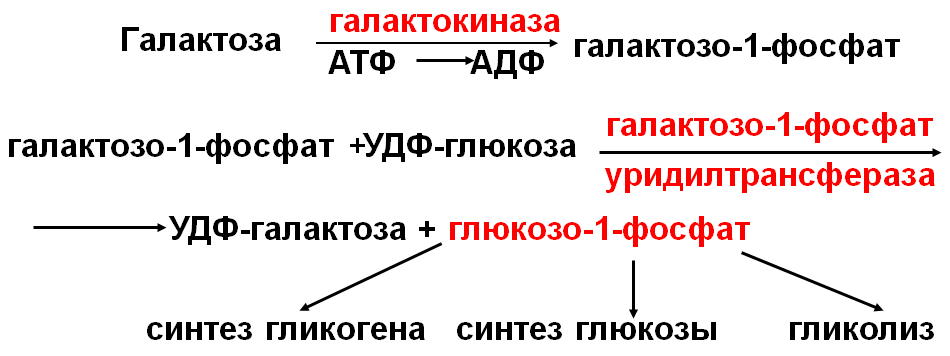
Нарушения обмена галактозы могут быть вызваны генетическим дефектом одного из ферментов: - галактокиназы, частота дефекта 1:500000; - галактозо-1-фосфат-уридилтрансферазы, частота дефекта 1:40000; Заболевание, возникающее при этих нарушениях, получило название галактоземия. Дети отказываются от приема пищи. Уровень галактозы в крови возрастает до 11,1-16,6 ммоль/л (норма 0,3-0,5 ммоль/л), в крови появляется галактозо-1-фосфат. В моче - галактозурия, протеинурия, гипераминоацидурия При дефекте галактокиназы избыток галактозы превращается в спирт галактитол. Он накапливается в хрусталике, повышает осмотическое давление. Изменяется водно-солевой состав, нарушается конформация белков хрусталика, что приводит к катаракте в молодом возрасте. Катаракта возможна даже у плода матери с галактоземией, употреблявшей молоко во время беременности. При дефекте галактозо-1-фосфат-уридилтранс-феразы АТФ постоянно расходуется на фосфорилирование галактозы и дефицит энергии угнетает активность многих ферментов, "токсически" действуя на нейроны, гепатоциты, нефроциты. Как результат возможны умственная отсталость, цирроз печени, катаракта (галактитол). Основы лечения. Исключение из рациона молока и др. источников галактозы позволяет предотвратить развитие патолог. симптомов. Однако сохранность интеллекта может быть достигнута только при ранней, не позднее первых 2 месяцев жизни, диагностике и вовремя начатом лечении. 2) Метаболизм фруктозы.
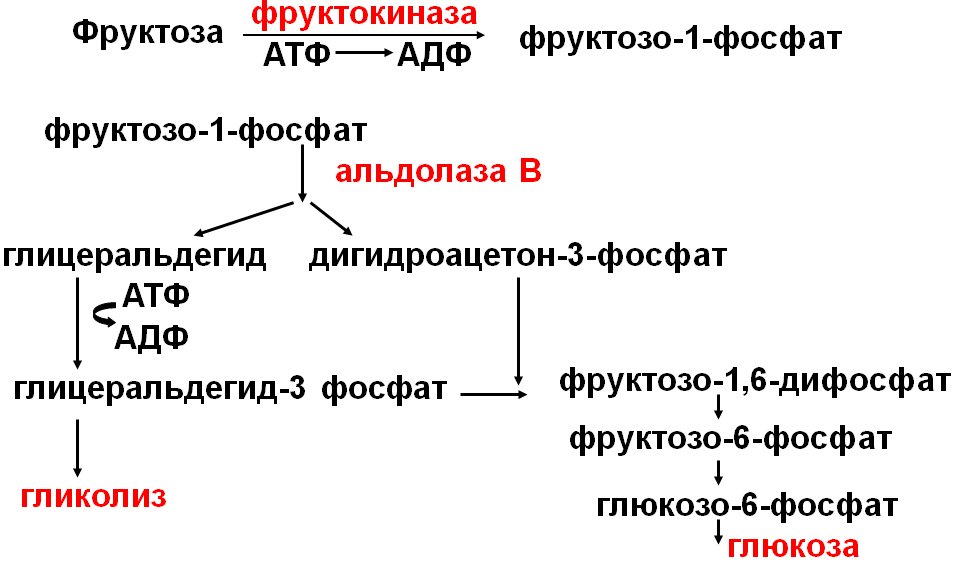
Нарушения метаболизма фруктозы. Генетический дефект фруктокиназы приводит к доброкачественной эссенциальной фруктозурии, протекающей без всяких симптомов. «Почечный порог» для фруктозы очень низок, поэтому фруктозурия обнаруживается уже при концентрации фруктозы в крови 0,73ммоль/л. Лечение включает диету с ограничением сладостей, фруктов, овощей. |