Изменение объема митохондрий печени мышей после воздействия наносекундных импульснопериодических микроволнового и рентгеновского излучений
 Скачать 93.81 Kb. Скачать 93.81 Kb.
|
|
ИЗМЕНЕНИЕ ОБЪЕМА МИТОХОНДРИЙ ПЕЧЕНИ МЫШЕЙ ПОСЛЕ ВОЗДЕЙСТВИЯ НАНОСЕКУНДНЫХ ИМПУЛЬСНО-ПЕРИОДИЧЕСКИХ МИКРОВОЛНОВОГО И РЕНТГЕНОВСКОГО ИЗЛУЧЕНИЙ Исследовано влияние импульсно-периодических микроволнового и рентгеновского излучений на митохондрии печени мышей. В качестве индикаторов влияния использовалась оптическая плотность суспензии митохондрий, отображающая объемные характеристики этих органелл. Выявлено, что после облучения суспензии объем митохондрий может изменяться: эффект зависит от частоты повторения импульсов, от интенсивности или дозы воздействия, природы воздействующего фактора, а также от отсутствия или наличия ионов кальция в среде инкубации митохондрий. После воздействия наблюдалось как сокращение объема митохондрий (в большинстве случаев), так и их набухание, что может быть обусловлено модулирующим влиянием импульсно-периодических микроволнового и рентгеновского излучений на чувствительность неспецифической проницаемости митохондрий к ионам кальция. КиберЛенинка: https://cyberleninka.ru/article/n/izmenenie-obema-mitohondriy-pecheni-myshey-posle-vozdeystviya-nanosekundnyh-impulsno-periodicheskih-mikrovolnovogo-i-rentgenovskogo ВЛИЯНИЕ ВЫСОКОЧАСТОТНОГО ИЗЛУЧЕНИЯ С ИМПУЛЬСАМИ НАНОСЕКУНДНОЙ ДЛИТЕЛЬНОСТИ НА ИЗОЛИРОВАННЫЕ МИТОХОНДРИИ ПЕЧЕНИ Эффект влияния на митохондрии проявлялся по-разному в разных их метаболических состояниях по Чансу. А именно, после воздействия наносекундных ВЧ импульсов скорость потребления кислорода в метаболическом состоянии 4 не изменялась, тогда как в состоянии 3 (состояние активного дыхания с фосфорилированием АДФ) она существенно снижалась (рис.1). Отсюда следовало, что при снижении показателя КДК существенный вклад вносился именно величиной V3. При этом после обучения суспензии 1000 наносекундных ВЧ импульсов наблюдалось снижение КДК митохондрий в зависимости от напряженности электрического поля. При увеличении напряженности до величины 0.15 кВ/см и более КДК монотонно уменьшался (рис.2). Это свидетельствовало об ингибирующем действии излучения на митохондрии. Полученная зависимость эффекта ингибирования дыхания могла быть обусловлена либо напряжённостью электрического поля, либо суммарной поглощенной энергией. Для определения роли энергетической компоненты были проведены уточняющие эксперименты, в которых эффект измерялся при фиксированной величине суммарной поглощенной энергии, но при разном количестве импульсов и напряженности поля (при условии, что количество импульсов х напряженность электрического поля = const). Оказалось, что воздействие цуга наносекундных ВЧ импульсов с одинаковой суммарной энергией обеспечивает формирование одинакового по величине биологического эффекта. А именно, наблюдалось снижение КДК на 30 % после воздействия ВЧ импульсами c суммарной энергией 2.5 мДж за сеанс (рис. 3А) и на 61 % после воздействия ВЧ импульсами c большей суммарной 10 мДж за сеанс (рис.3Б). Таким образом, увеличение суммарной поглощенной энергии сопровождалось усилением эффекта. https://research-journal.org/biology/vliyanie-vysokochastotnogo-izlucheniya-s-impulsami-nanosekundnoj-dlitelnosti-na-izolirovannye-mitoxondrii-pecheni/ ВЛИЯНИЕ ГАММА-ОБЛУЧЕНИЯ НА АКТИВНОСТЬ ДЕЗОКСИРИБОНУКЛЕАЗЫ II ИЗОЛИРОВАННЫХ МИТОХОНДРИЙ Воздействие изолированных митохондрий печени на высокие дозы гамма-лучей из источника Co60 приводит к повышению уровня активности DNase II. Лечение митохондрий звуковой вибрацией вызывает дальнейшее повышение активности до уровня, не зависящего от предварительной дозы облучения. Такая повышенная митохондриальная активность Днказы II по-видимому, из-за "структурных повреждений" из субклеточных частиц, вызванных ионизирующим излучением. Другие методы нарушения митохондриальной структуры также вызвать повышенную активность Днказы второй. Постулируется причинно-следственная связь между структурным изменением и повышенной ферментативной активностью. http://jcb.rupress.org/content/3/2/239 Влияние рентгеновского излучения на митохондриальную дезоксирибонуклеазу II Ссылка на кривую B Text-fig. 1 показывает, что митохондриальная ДНКаза II активность возрастает по мере увеличения дозы облучения до 6 × 10 5 рентген. ферментативная активность не увеличивается еще больше, когда митохондриальная препа- рационы подвергаются более высоким дозам. Лечение митохондрий звуком вибрация вызывает повышение активности ДНКазы II до уровня, показанного кривой A из Text-fig. 1. Из кривой А видно, что уровень, на который звуковое лечение, что ферментативная активность не зависит от дозы облучения к митохондриям до акустического лечения. После ультразвукового лечения активность контрольных образцов такая же, как и у образцов, получающих высокие дозы облучения. Поскольку уровень ферментативной активности достигнут после звуковая вибрация одинакова, независимо от дозы облучения https://www.sciencedirect.com/sdfe/pdf/download/eid/1-s2.0-0014482756902063/first-page-pdf Влияние рентгеновских лучей на Окислительное Фосфорилирование митохондрий по отношению к ядерному повреждению Крысы подвергались действию различных дозировок рентгеновских лучей и влияния на оксидативное фосфорилирование изолированных митохондрий селезенки и тимуса. Этот процесс оказался очень радиочувствительным. Окислительное фосфорилирование было подавлено в тимусе после доз как небольших как 50 Р И в хандре( перевод) позже 100 р. Изменение периода после облучения показало, что наблюдается значительная депрессия (перевод) фосфорилирования митохондрий селезенки крыс изолированных начинается через 2 часа после облучения всего тела в дозе 700 р. Используемые ткани подвергались гистологическому исследованию с целью получения информации о возможной связи между митохондриальным и ядерным ущербом. Из экспериментов с малыми дозами суммарного облучения организма сделан вывод ,что радиочувствительность ядра и митохондрий тканей изученные не отличаются слишком сильно. http://europepmc.org/scanned?pageindex=1&articles=PMC2082538 Роль митохондрий генерируемых активных форм кислорода на x-Рэй-индуцированного апоптоза в человеческих клеток гепатоцеллюлярной карциномы линии, HLE (излучение спектральной линии водорода) ХЛЕ, человеческой гепатоцеллюлярной карциномы клеточной линии было временно трансфицированных с нормальным MnSOD человека и MnSOD без митохондриальной наведения сигнала (МТС). Митохондриальные активные формы кислорода (ROS), перекисное окисление липидов и апоптоз были исследованы как функция времени после рентгеновского облучения 18.8 Gy. Наши результаты показали, что уровень митохондриальной АФК повысился и достиг максимального уровня через 2 часа после рентгеновского облучения. Аутентичные MnSOD, но не MnSOD не хватает МТС, защищенный от митохондриальных АФК, перекисного окисления липидов и апоптоза. Кроме того, уровни митохондриальных ROS последовательно были найдены, что всегда коррелируют с уровнями подлинного MnSOD в митохондрии. Эти результаты показывают, что только когда MnSOD находится в митохондрии, он эффективен в защите от клеточных травм рентгеновским облучением и что митохондрии являются критическими участками рентгеновских индуцированных клеточных окислительных травм. https://www.tandfonline.com/doi/abs/10.3109/10715762.2012.698012?journalCode=ifra20 Эффекты атомной радиации на митохондриях https://ru.scribd.com/document/231161590/Effects-of-Ionizing-Radiation-on-Mitochondria Рентгеновское микроаналитическое исследование феррицианида реакция для электронной цитохимической демонстрации активность сукцинатдегидрогеназы в изолированных митохондриях Цитохимический метод для демонстрации сукцинатдегидрогеназы активность восстановлением феррицианида и одновременная связь с Cu 2+ была исследованы комбинированными методами просвечивающей электронной микроскопии и рентгеновских лучей микроанализ. Локализация конечного продукта реакции сукцинатдегидрогеназы активность в изолированных митохондриях мыши, а также изменения показали, что состав конечного продукта реакции происходит как на разных участках внутри митохондрии, а также после различных реакций. https://rd.springer.com/content/pdf/10.1007%2FBF01011801.pdf Митохондриальная дисфункция, вероятная причина стойкого окислительного стресса после воздействия ионизирующего излучения В нескольких недавних исследованиях было высказано предположение о том, что виды реакционноспособного кислорода (РОС), образующиеся из митохондрий, вносят вклад в геномную нестабильность после облучения клеток ионизирующим излучением, но механизм этого процесса еще не полностью понят. Мы рассмотрели гипотезу о том, что облучение вызывает митохондриальную дисфункцию, вызывая стойкий окислительный стресс, что способствует геномной нестабильности. После облучения клеток до 5 Гр гамма-облучения мы обнаружили, что облучение вызвало следующие изменения в четкой картине временных курсов. Во-первых, устойчивое увеличение внутриклеточных уровней ROS произошло в течение нескольких минут, но внутриклеточный ROS исчез в течение 30 мин. Затем митохондриальная дисфункция была обнаружена через 12 ч после облучения, о чем свидетельствует снижение активности NADH-дегидрогеназы (комплекс I), наиболее важного фермента в регулировании высвобождения ROS из митохондриальной транспортной цепи электронов (ETC). Наконец, значительное увеличение уровней ROS (в митохондриях и окисление митохондриальной ДНК наблюдалось в клетках через 24 часа или позже после облучения. Хотя необходимы дальнейшие эксперименты, результаты этого исследования подтверждают гипотезу о том, что митохондриальная дисфункция вызывает стойкий окислительный стресс, который может способствовать повышению радиационной геномной нестабильности. https://www.tandfonline.com/doi/abs/10.3109/10715762.2011.645207?journalCode=ifra20 Сравнение радиационно-индуцированного повреждения митохондрий между стволовыми клетками нейронов и дифференцированными клетками. Митохондрии играют ключевую роль в поддержании клеточного гомеостаза во время стрессовых реакций, а митохондриальная дисфункция способствует канцерогенезу, старению и неврологическому заболеванию. Здесь мы исследовали индуцированное ионизирующим излучением (IR) повреждение митохондрий в стволовых клетках нейронных предшественников (НСК) человека, их дифференцированных аналогах и человеческих нормальных фибробластах. Долгосрочное фракционированное излучение (FR) с малыми дозами рентгеновских лучей в течение 31 дня усиливало митохондриальную активность, что проявилось в увеличении активности митохондриального мембранного потенциала (ΔΨm) и митохондриального комплекса IV (цитохромоксиоксидаза) для заполнения энергетических потребностей в хронической ДНК ответ на повреждение в дифференцированных клетках. Последующее восстановление антиоксидантного глутатиона посредством непрерывной активации митохондриального окислительного фосфорилирования вызывало окислительный стресс и геномную нестабильность в дифференцированных клетках, подверженных долгосрочным FR. Напротив, долгосрочные FR не влияли на митохондриальную активность в NSC. Этот тип клеток показал эффективный ремонт ДНК, отсутствие митохондриального повреждения и устойчивость к долгосрочным FR. После высоких доз острой одиночной радиации (SR) (> 5 Гр) остановка клеточного цикла в фазе G2 наблюдалась в НСК и фибробластах человека. При этом условии увеличение массы митохондрий, митохондриальной ДНК и внутриклеточных реактивных уровней кислорода (ROS) наблюдалось в отсутствие усиленной митохондриальной активности. Следовательно, клеточное старение индуцировалось высокими дозами SR в дифференцированных клетках. В заключение мы продемонстрировали, что реакция митохондриального излучения различается в зависимости от степени повреждения ДНК, продолжительности облучения и дифференциации клеток. https://www.ncbi.nlm.nih.gov/pubmed/28118061 Функциональное состояние митохондриальной дыхательной цепи тонкопленочных энтероцитов крыс при общем внешнем воздействии рентгеновского излучения с низкой дозой облучения Влияние низкоскоростного ионизирующего излучения (0,055 Гр / мин) в дозах 0,1; 0,5 и 1,0 Гр на функциональное состояние митохондриальной дыхательной цепи крысиных тонкопленочных энтероцитов. Дисфункция ферментов транспортной цепи электронов и изменения содержания цитохромов b, c, a в митохондриальной внутренней мембране выявлены через 1, 12 и 24 часа после облучения. Выявленные расстройства указывают на раннюю чувствительность мембраны к радиационному эффекту. Ингибирование активности H + -АТФазы в исследуемом диапазоне доз указывает на снижение энергетической емкости митохондрий. https://www.ncbi.nlm.nih.gov/pubmed/25486741 Обогащенная токотриенолом композиция защищает от радиационно-индуцированных изменений в митохондриях сердца без изменения поздней кардиальной функции или структуры. Ранее мы показали, что локальное облучение сердца в модели крысы вызвало длительные изменения в митохондриальном дыхании и повышенную восприимчивость к открытию переходного порога митохондриальной проницаемости (mPTP). Поскольку известно, что токотриенолы защищают от вызванной окислительным стрессом митохондриальной дисфункции, в этом исследовании мы изучили влияние токотриенолов на радиационно-индуцированные изменения в митохондриях и структурные и функциональные проявления RIHD. Самцы крыс Sprague-Dawley получили ориентированное на изображение рентгеновское облучение сердца к общей дозе 21 Гр. За 24 часа до облучения крысы получали обогащенный токотриенолом препарат или носитель пероральным желудочным зондом. Митохондриальная функция и параметры митохондриальной мембраны изучались через 2 недели и 28 недель после облучения. Кроме того, сердечную функцию и гистологию исследовали через 28 недель. Одна пероральная доза обогащенной токотриенолом композиции сохраняла соотношение Bax / Bcl2 и предотвращала открытие mPTP и радиационно-индуцированные изменения в суточно-митохондриальном дыхании https://www.ncbi.nlm.nih.gov/pubmed/25710576 Эффект повторяющийся импульсный рентгеновский (Длительность импульса 4 НС, ускоряющее напряжение 300 кв; 2.5 ка тока электронного пучка) на антиоксидантных ферментов в печени мышей митохондрии были исследованы. Митохондриальной суспензии подвергается один 4000 импульсного рентгеновского излучения с частотой повторения в диапазоне от 10 до 22 ППС (импульсного доза составляла 0,3-1,8 х 10(-6) гр/пульс, суммарные поглощенные дозы после однократного облучения составила 7,2 х 10(-3) гы). Показано, что кратковременное воздействие рентгеновского излучения изменения антиоксидантной активности ферментов в печени мышей митохондрии.Наибольший эффект наблюдался в изменениях активности металлсодержащих ферментов: супероксиддисмутазы и глутатионпероксидазы. Эффект зависит от частоты повторения импульсов и дозы облучения. Окислительное фосфорилирование в митохондриях мал-кишечных энтероцитов при хроническом и однократным воздействием низкой мощности ионизирующего излучения. Один и хронического воздействия ионизирующего излучения низкой мощности приводит к увеличению интенсивности дыхания и нарушению окислительного фосфорилирования в результате разделения процессов сопряжения окисления и фосфорилирования. В условиях хронического облучения изменения сопровождались угнетением АТФ из АДФ и ФН, потому что нет изменения активности гидролаз АТФ из митохондрий заметили.Выявленные функциональные нарушения митохондрий энтероцитов под действием ионизирующего излучения могут быть связаны со структурными и функциональными изменениями в дыхательной цепи, активность обоих ферментов электрон-транспортной цепи и Н+ -Атфазы. Воздействия ионизирующего излучения низкой мощности может привести к нарушению функции митохондриальной биоэнергетики - один из самых ранних проявлений клеточной дисфункции. https://www.ncbi.nlm.nih.gov/pubmed/25536585 Функциональное состояние дыхательной цепи митохондрий энтероцитов тонкого кишечника крыс при низкой мощности дозы рентгеновского общего внешнего облучения Влияние низкой ставки ионизирующего излучения (0.055 гр/мин) в дозах 0,1; была исследована 0,5 и 1,0 гр на функциональное состояние дыхательной цепи митохондрий крысы энтероцитов тонкой кишки. Дисфункции электрон-транспортной цепи ферментов и изменения содержания цитохромов В, С, А В митохондриальной внутренней мембраны были выявлены в 1, 12 и 24 часа после облучения. Выявленные нарушения свидетельствуют о ранней чувствительность мембраны на действие радиации.Ингибирование Н+ -Атфазы в исследованном диапазоне доз указывает на снижение митохондриального энергетического потенциала. https://www.ncbi.nlm.nih.gov/pubmed/25486741 Влияние электромагнитного излучения на митохондрии Электромагнитное излучение вызывает структурное повреждение митохондрий. Воздействие радиации вызывает набухание и кавитацию в митохондриях, а также сломанные, дезорганизованные и редкие митохондриальные кристы или складки (1, 3). Урон увеличивается с длительным временем выдержки, даже если доза излучения низкая, поэтому долгосрочное воздействие с низкой дозой приводит к значительному ущербу. Через три часа микроволнового излучения увеличивалось видимое набухание митохондрий, и через двадцать четыре часа наблюдалась дегенерация митохондрий (1). Ущерб, вызванный излучением, является кумулятивным. Радиация также повреждает митохондриальную мембрану, которая вызывает уменьшение потенциала митохондриальной мембраны (1), которая отвечает за движущую силу протона и производство энергии в митохондриях, что в конечном итоге приводит к апоптозу (1,4) или к гибели клеток, поскольку апоптоз регулируется митохондриями. Гомеостаз кальция нарушен электромагнитным излучением. Митохондрии ответственны за регулирование гомеостаза кальция внутри клетки. Обычно внеклеточный кальций больше, чем внутриклеточный кальций, и большинство внутриклеточного кальция хранится в митохондриях и эндоплазматическом ретикулуме. Микроволновое излучение вызывает значительное увеличение цитоплазматического кальция, что вызывает избыточную активацию митохондриальной проницаемости (1), неспецифической поры в мембране митохондрий, что приводит к повышенной проницаемости мембраны, нарушая метаболические градиенты между митохондриями и цитозолем. Это приводит к расцеплению окислительного фосфорилирования (1), что означает, что окислительное фосфорилирование больше не возбуждается к дыхательной цепи для синтеза АТФ, поэтому производство энергии прекращается. Оставшаяся АТФ, полученная незатронутыми митохондриями, также истощается, и происходит гибель клеток. Повышение внутриклеточного кальция также приводит к набуханию митохондрий и, если оно велико, приводит к разрыву митохондрий. https://translate.google.com/translate?sl=en&tl=ru&js=y&prev=_t&hl=ru&ie=UTF-8&u=http%3A%2F%2Featgenius.com%2Feffects-of-electromagnetic-radiation-on-mitochondria%2F&edit-text=&act=url . Hao, Y., Zhao, L. & Peng, R. Xu, S., Zhou, Z., Zhang, L., Yu, Z., Zhang, W., Wang, Y., Wang, X., Li, M., Chen, Y., Chen, C ., He, M., Zhang, G. & Zhong, Влияние ионизирующего излучения на митохондрии Современная концепция радиобиологии предполагает, что повреждение ДНК в ядре клетки является основной причиной пагубных эффектов радиации. Здесь мы обсуждаем экспериментальные наблюдения влияния ионизирующего излучения на митохондрии на (1) функциональном уровне ДНК и (2) обсуждаются роли митохондрий в (3) окислительном стрессе и (4) позднем лучевом воздействии. Имеющиеся экспериментальные данные свидетельствуют о том, что повышение эффективности опухоли при лучевой терапии может быть достижимо при митохондриях. Аналогично, более конкретная защита митохондрий и их кодирование ДНК должны уменьшить повреждение здоровых клеток, подвергающихся ионизирующему излучению. 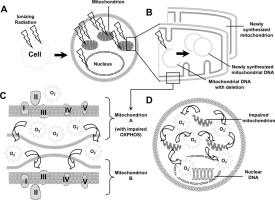 https://z5h64q92x9.net/proxy_u/en-ru.ru/https/www.sciencedirect.com/science/article/pii/S0891584913003687#! авторы https://www.sciencedirect.com/science/article/pii/S0891584913003687 сайт Ионизирующее излучение вызывает стойкие изменения митохондриальной функции сердца мышей C57BL / 6 через 40 недель после локального воздействия на сердце. Дыхательная способность облученных митохондрий c57bl / 6 сердца была значительно снижена в течение 40 недель. Параллельно, карбонилирование протеина было увеличено, предлагая увеличенное оксидативное усилие. Значительные изменения были обнаружены в уровнях белков митохондрий-ассоциированного цитоскелета, дыхательной цепи, ионного транспорта и липидного обмена. Излучение индуцировало подобные, но менее выраженные эффекты в митохондриальном протеоме мышей ApoE ( -/ -). В Апое(-/-), не было замечено значительное изменение в митохондриальном дыхании или карбонилировании протеина.Доза 0,2 гр не оказывала существенного влияния на митохондрии сердца. ВЫВОД Это исследование показывает, что ионизирующее излучение вызывает нестационарные изменения в митохондриях сердца, что приводит к окислительному стрессу, который в конечном счете может привести к нарушению работы сердечной мышцы. https://www.ncbi.nlm.nih.gov/pubmed/23522698 Тяжелое повреждение митохондрий, связанное с чувствительностью к низкой дозе излучения в ATM- и NBS1-дефицитных клетках https://www.tandfonline.com/doi/full/10.1080/15384101.2016.1156276 Влияние рентгеновских лучей на окислительное фосфорилирование митохондрий в связи с ядерным повреждениемДолгосрочное фракционированное излучение (FR) с малыми дозами рентгеновских лучей в течение 31 дня усиливало митохондриальную активность, что проявилось в увеличении активности митохондриального мембранного потенциала (ΔΨm) и митохондриального комплекса IV (цитохромоксиоксидаза) для заполнения энергетических потребностей в хронической ДНК ответ на повреждение в дифференцированных клетках. Последующее восстановление антиоксидантного глутатиона посредством непрерывной активации митохондриального окислительного фосфорилирования вызывало окислительный стресс и геномную нестабильность в дифференцированных клетках, подверженных долгосрочным FR. Напротив, долгосрочные FR не влияли на митохондриальную активность в NSC. Этот тип клеток показал эффективный ремонт ДНК, отсутствие митохондриального повреждения и устойчивость к долгосрочным FR. После высоких доз острой одиночной радиации (SR) (> 5 Гр) остановка клеточного цикла в фазе G2 наблюдалась в НСК и фибробластах человека. При этом условии увеличение массы митохондрий, митохондриальной ДНК и внутриклеточных реактивных уровней кислорода (ROS) наблюдалось в отсутствие усиленной митохондриальной активности. Следовательно, клеточное старение индуцировалось высокими дозами SR в дифференцированных клетках. В заключение мы продемонстрировали, что реакция митохондриального излучения различается в зависимости от степени повреждения ДНК, продолжительности облучения и дифференциации клеток https://www.researchgate.net/publication/10308830_The_Effect_of_X-Rays_on_the_Oxidative_Phosphorylation_of_Mitochondria_in_Relation_to_Nuclear_Damage Ионизирующее излучение индуцирует митохондриальных реактивных форм кислорода производства сопровождается усилением активности функцию митохондриальной цепи электронного транспорта митохондрий и содержания под контроля контрольно-пропускного пункта клеточного цикла. https://www.ncbi.nlm.nih.gov/pubmed/22580337Воздействие X-облучения на повреждение митохондриальной ДНК и ее сдерживание образования сурьмы. Было зарегистрировано небольшое количество сообщений об излучении мтДНК, вызванных радиацией, и изменение структуры скелетного сдерживания, вызванное ионизирующим излучением, ранее не исследовалось. В этом исследовании оценивали повреждение мтДНК и смену супероидного образования после X-облучения. Для анализа использовали клеточную линию рака молочной железы человека, клетки MCF-7. Модифицированный подход к ПЦР в режиме реального времени, зависящий от сверхспирализации, использовался для оценки изменения и сокращения количества скелетных изменений митохондриальной ДНК;для количественного определения повреждения мтДНК применялся метод длительной ПЦР. Повреждение MtDNA и изменение образования, вызванное высокодозным облучением, были устойчивыми в течение 24 часов после облучения и не были значимыми после облучения с низкой дозой. Количество копий MtDNA было немного увеличено после облучения высокой дозой, и увеличение транзита наблюдалось после облучения с низкой дозой. Это первое исследование, посвященное оценке радиационно-индуцированного изменения митохондриальной ДНК-супероксигенации с использованием ПЦР в реальном времени. В сочетании с данными генерации ROS и динамикой массы митохондрий наши данные показывают, что мтДНК чувствительна к радиационным рискам, что указывает на то, что биогенез митохондрий играет важную роль в радиационно-индуцированном клеточном ответе. https://www.ncbi.nlm.nih.gov/pubmed/21835270 Лучи Стинг: острый клеточный эффект воздействия ионизирующего излучения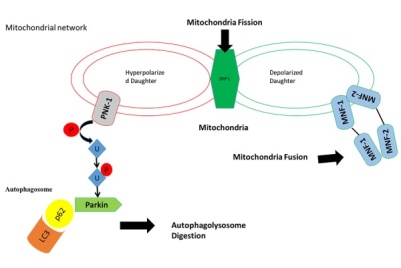 Сердца, подвергшиеся лучевой терапии, могут накапливать митохондриальный ущерб, который не может быть дополнительно восстановлен с помощью механизмов митогенеза и / или контроля качества. Молекулярные механизмы, вероятно, не настолько далеки от того, что наблюдается в других условиях, где снижение толерантности к стрессу связано с нарушением путей, участвующих в сети митохондрий-ER-ядер, что является фундаментальным для содействия клеточной адаптации к стрессу. Модели сердечной недостаточности после инфаркта миокарда, старения или диабета 112показали центральную роль митохондриальной дисфункции в прогрессировании заболевания, а связанные с ней открытия приводят к конкретным подходам, направленным на восстановление митохондриальной динамики и функций 107 . Таким образом, новой задачей на предстоящие годы станет идентификация той роли, которую играет эта органелла в сердечных изменениях, вызванных рентгеновским стрессом, и поэтому разработка новых подходов к укреплению и / или сохранению митохондриальных функций и сети при хронических радиационный стресс. Сердца, подвергшиеся лучевой терапии, могут накапливать митохондриальный ущерб, который не может быть дополнительно восстановлен с помощью механизмов митогенеза и / или контроля качества. Молекулярные механизмы, вероятно, не настолько далеки от того, что наблюдается в других условиях, где снижение толерантности к стрессу связано с нарушением путей, участвующих в сети митохондрий-ER-ядер, что является фундаментальным для содействия клеточной адаптации к стрессу. Модели сердечной недостаточности после инфаркта миокарда, старения или диабета 112показали центральную роль митохондриальной дисфункции в прогрессировании заболевания, а связанные с ней открытия приводят к конкретным подходам, направленным на восстановление митохондриальной динамики и функций 107 . Таким образом, новой задачей на предстоящие годы станет идентификация той роли, которую играет эта органелла в сердечных изменениях, вызванных рентгеновским стрессом, и поэтому разработка новых подходов к укреплению и / или сохранению митохондриальных функций и сети при хронических радиационный стресс.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4912338/ Результаты радиационной индукции при нарушениях митохондрий в сердце мышей через 4 недели после воздействия рентгеновских лучейНаши результаты показывают, что дозы, эквивалентные одной дозе в лучевой терапии, вызывают длительные изменения в окислительном метаболизме митохондрий и цитоскеле, ассоциированном с митохондриями. Это побуждает нас предложить, чтобы эти первые патологические изменения привели к увеличению риска сердечно-сосудистых заболеваний после облучения. Цель этого исследования состояла в том, чтобы определить, вызывает ли ионизирующее излучение неустранимое нарушение митохондрий сердца, что в конечном итоге может привести к сердечно-сосудистым заболеваниям. Для этой цели мышей C57BL / 6N подвергали локальному облучению в сердце, используя острую дозу 0,2 Гр или 2 Гр рентгеновских лучей; контрольные мыши были обманутыми. Эти дозы были выбраны, в то время как более высокий эквивалент дозы (2 Гр) часто используется в качестве разовой дозы в лучевой терапии. Эпидемиологические данные ясно показывают связь между этой дозой и повышенным риском сердечно-сосудистых заболеваний [1] - [4] . Однако неизвестно, влияют ли дозы ниже 0,5 Гр на риск сердечно-сосудистых заболеваний [16], [17] . Радиационно-индуцированные эффекты на митохондрии сердца были исследованы через четыре недели после облучения, чтобы наблюдать первые постоянные патологические изменения. Мы использовали два дополнительных количественных протеомных подхода, ICPL и 2D-DIGE;ICPL представляет собой количественную оценку протеомных белков на основе пептидов и 2D-DIGE. Используя LC-ESI / MS / MS идентификацию дерегулированных белков и анализ биоинформатики, мы смогли выяснить радиационно-индуцированную митохондриальную недостаточность in vivo . На основании данных протеомики мы провели функциональные исследования изолированных митохондрий из сердец мыши на комплексную активность, дыхание, генерацию ROS и глобальный окислительный статус протеома. Мы показываем, что внутриклеточные изменения, вызванные начальным радиационно-индуцированным окислительным стрессом, сохраняются в течение длительного периода времени с потенциальными накопленными эффектами. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3234240/ |
