|
|
β-окисление и синтез жирных кислот (3). Жирные кислоты
СРОП
β-ОКИСЛЕНИЕ И СИНТЕЗ ЖИРНЫХ КИСЛОТ
1 β-Окисление жирных кислот - источник энергии для синтеза АТФ
2. Кетоновые тела: синтез и катаболизм. Кетоацидоз
3. Биосинтез высших жирных кислот и его регуляция
Жирные кислоты, как и глюкоза, являются основными «топливными молекулами». Они содержат большое количество С-Н-связей, при окислении которых выделяется большое количество энергии.
Жирные кислоты, проникающие из крови в клетку, сначала подвергаются реакции активации под действием ацил-КоА синтетазы:
RCOOH+HSKoA+ATP→R-CO-SKoA+AMP+PPi
ß-Окисление жирных кислот – это специфический путь распада жирных кислот, заканчивающийся образованием ацетил-КоА.
Процесс ß-окисления жирных кислот происходит:
в матриксе митохондрии;
в аэробных условиях.
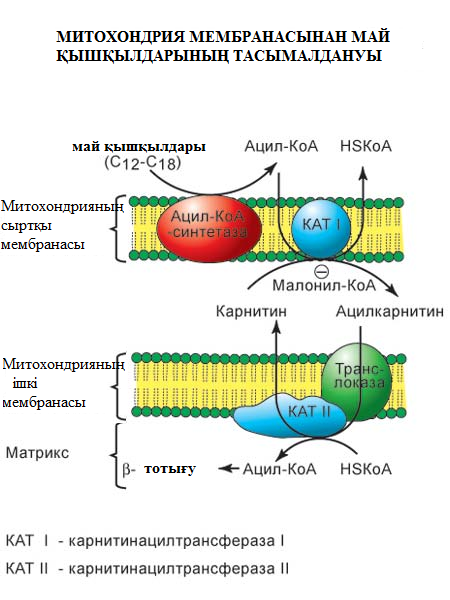
Внутренняя мембрана митохондрии непроницаема для ацил-КоА, существует система переноса жирных кислот через мембрану в комплексе с карнитином (рис. 1).
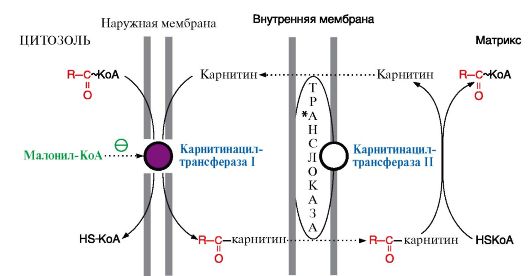
Рис.1. Перенос жирных кислот через мембраны митохондрии
Ацилкарнитин транспортируется с помощью карнитинацилкарнитинтранс-локазы на внутреннюю поверхность внутренней мембраны митохондрий, где фермент карнитинацилтрансфераза II катализирует перенос ацила на внутримитохондриальный КоА. Таким образом, ацил-КоА становится доступным для ферментов β-окисления.
В матриксе митохондрий начинается процесс β-окисления, представляющий собой четыре последовательные реакции:
дегидрирование;
гидратация;
дегидрирование;
отщепление ацетил-КоА.
Формула, по которой рассчитывается количество молекул АТФ:

2* - энергия двух макроэргических связей АТФ используется на активацию жирной кислоты.
Скорость процесса β-окисления зависит от ряда факторов:
• состояния голодания или сытости (т.е. соотношения инсулин - глюкагон);
• активности регуляторного фермента карнитинацилтрансферазы I;
• доступности субстрата - жирных кислот;
• потребности клетки в энергии;
• доступности кислорода.
Жирные кислоты – важный источник энергии для тканей:
скелетных мышц;
миокарда;
печени.
Жирные кислоты:
не проникают через гематоэнцефалический барьер;
являются гидрофобными молекулами.
Мозг не использует жирные кислоты как источник энергии. При длительном голодании печень перерабатывает 50% жирных кислот в другие источники энергии - кетоновые тела.
2. К кетоновым телам относят:
1) β-гидроксибутират;
2) ацетоацетат;
3) ацетон.
Только первые два являются источниками энергии и могут окисляться в тканях. В норме концентрация кетоновых тел в крови невелика и составляет 1-3 мг/дл.
Синтез кетоновых тел увеличивается при:
• голодании;
• длительной интенсивной физической нагрузке;
• употреблении пищи, богатой жирами, но с низким содержанием углеводов (диета Аткинса, «кремлевская» диета);
• сахарном диабете.
Синтез кетоновых тел происходит:
Исходным субстратом синтеза служит ацетил-КоА, образующийся в результате β-окисления жирных кислот (рис. 2)
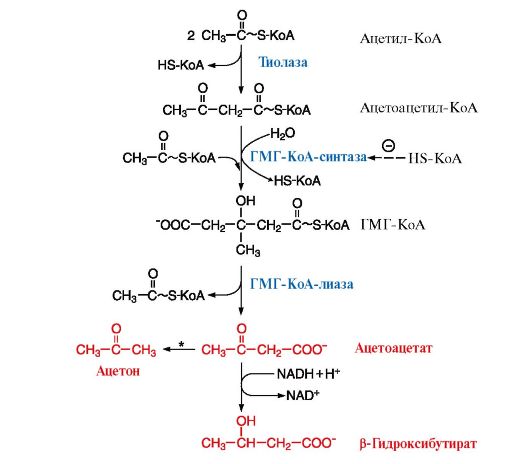
Рис. 2 Синтез кетоновых тел в митохондриях гепатоцитов
Регуляция синтеза кетоновых тел:
мобилизация ТАГ, жирные кислоты, ацилКоА, ГМГ-КоА-синтаза, HS-КоА, кетоновые тела .
Окисление кетоновых тел происходит во многих тканях кроме:
Ферменты окисления кетоновых тел:
β-гидроксибутират-дегидрогеназа;
сукцинил-КоА-ацетоацетат-трансфераза;
тиолаза;
Кетонемия - повышение концентрации кетоновых тел в крови.
Кетоацидоз- накопление кетоновых тел в организме.
Повышение кетоновых тел декарбоксилирование ацетоацетатаацетон.
Ацетон:
Кетонурия - выведение кетоновых тел с мочой.
Теоретический выход АТФ окисления кетоновых тел: 26 молекул АТФ.
3. Синтез жирных кислот происходит:
в абсорбтивный период;
при высокой концентрации глюкозы в крови;
в печени и жировой ткани;
в молочных железах в период лактации.
При синтезе жирных кислот активируются:
гликолиз;
пентозофосфатный путь катаболизма глюкозы.
В результате активации образуются субстраты для синтеза жирных кислот:
Синтезированные жирные кислоты включаются в состав других молекул:
Ацетил-КоА:
не проникает через мембрану митохондрий в цитоплазму;
конденсируется ферментом цитратсинтазой с оксалоацетатом:
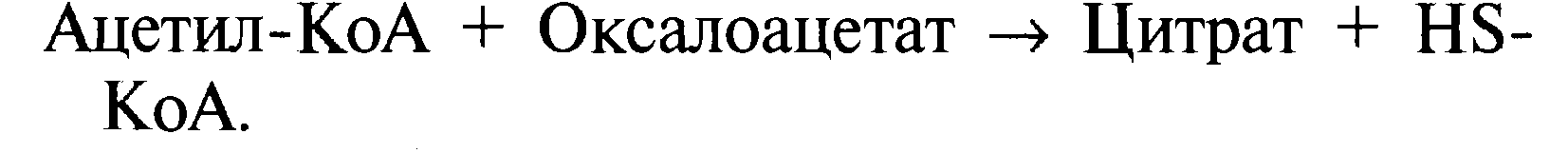
с помощью транслоказы переносится в цитоплазму;
расщепляется под действием цитратлиазы:
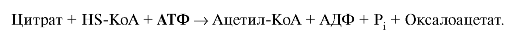
Реакция, катализируемая малик-ферментом, является одним из источников NADPH для синтеза жирных кислот:
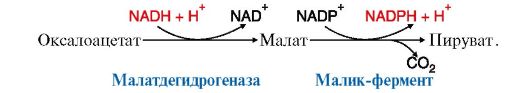
Другой источник NADPH - реакция, катализируемая ферментом пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназой.
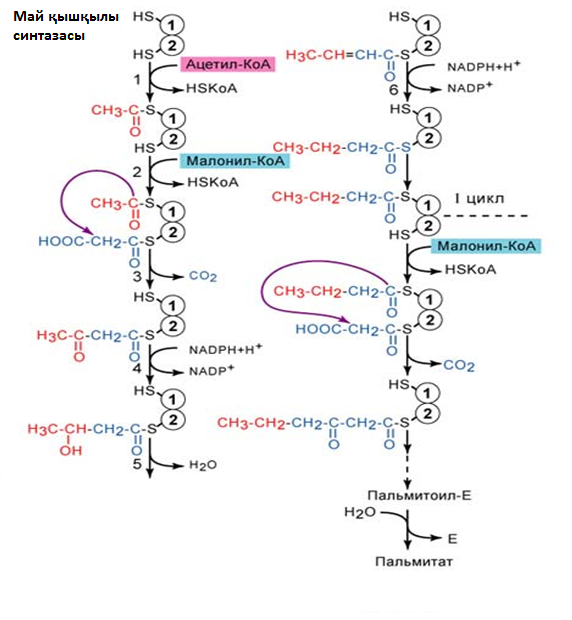
Первая реакция синтеза жирных кислот - это превращение ацетил-КоА в малонил-КоА:
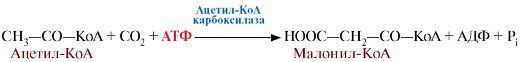
Ацетил-КоА-карбоксилаза – регуляторный фермент биосинтеза жирных кислот. Коферментом является биотин.
Активность ацетил-КоА-карбоксилазы регулируется путем:
ассоциации-диссоциации протомеров: цитрат стимулирует ассоциацию - активность фермента↑, ацил-КоА ускоряет диссоциацию – активность фермента↓;
фосфорилирования-дефосфорилирования: инсулин стимулирует дефосфорилирование – активность фермента↑, глюкагон, адреналин – фосфорилирование – активность фермента↓;
индукция синтеза новых молекул фермента под влиянием инсулина.
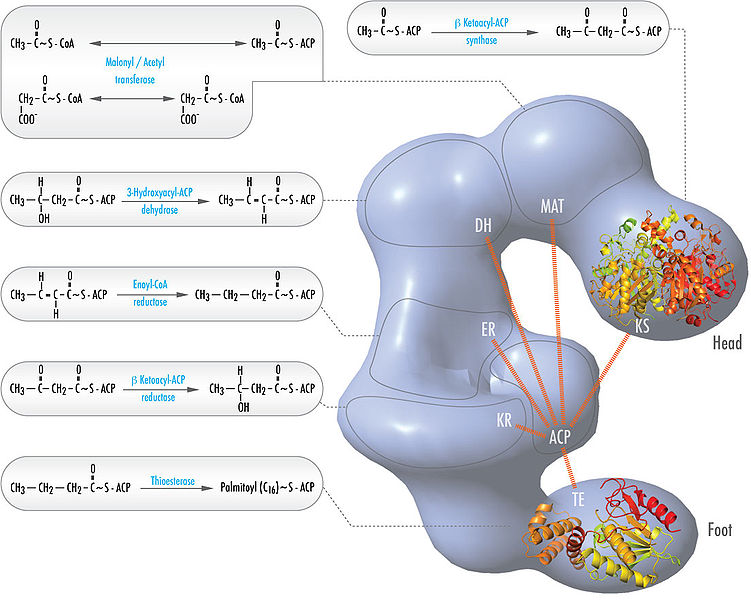
Последующие реакции синтеза жирных кислот катализируются ферментным комплексом - синтазой жирных кислот или пальмитатсинтазой.
Мультиферментный комплекс - состоит из 6 ферментов, связанных ацилпереносящим белком.
Ацилпереносящий белок:
имеет 2 свободные HS-группы;
вовлекается в процесс синтеза жирных кислот на всех его этапах.
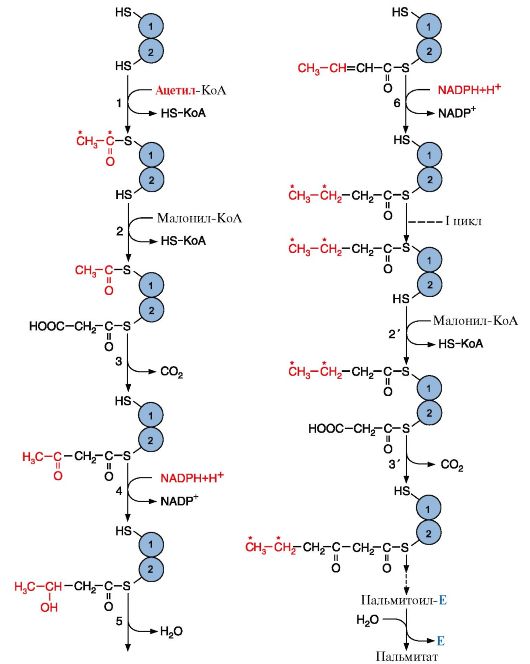
Рис.3. Синтез пальмитиновой кислоты
Жирные кислоты с числом углеродных атомов больше, чем 16 синтезируются в эндоплазматическом ретикулуме, анологично тому, как это происходит на пальмитилсинтазе. Однако, каждую стадию процесса катализируют отдельные ферменты. Удлинение цепи происходит с помощью малонил-КоА, а в реакциях восстановления используется NADPH.
Образование ненасыщенных жирных кислот, например олеиновой (десатурация) –происходит на мембране эндоплазматического ретикулума. Двойные связи возникают за счет работы оксигеназы жирных кислот, которая требует участия О2 и NADPH.
 |
|
|
 Скачать 0.79 Mb.
Скачать 0.79 Mb.