Коррозия металла. К оррозия металла. Коррозия
 Скачать 2 Mb. Скачать 2 Mb.
|
|
К  оррозия металла. оррозия металла.Коррозия – это самопроизвольный процесс разрушения металлов и сплавов под влиянием окружающей среды ( от лат.corrosio – разъедание ) Ф  акторы вызывающие коррозию. акторы вызывающие коррозию.Кислород и влага атмосферы Углекислый и сернистый газы, содержащиеся в атмосфере М  орская вода орская водаГрунтовые воды Микроорганизмы. Сущность коррозии. Переход металла в раствор в виде ионов. Ме0 - ne → Men+ К   оррозия металла бывает сплошной и местной (точечной). оррозия металла бывает сплошной и местной (точечной). Виды коррозии     Электрохимическая Химическая  4 2 2  Zn0 + O2 2Zn+2O Zn0 + O2 2Zn+2OК 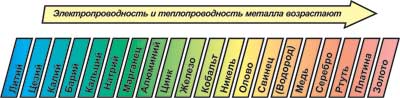 ак правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны ), а другие — роль катода (принимают электроны). ак правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны ), а другие — роль катода (принимают электроны).Р 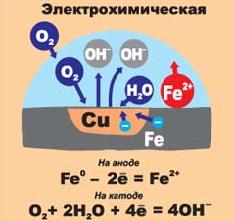 ассмотрим разрушение железного образца в присутствии примеси меди. На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит. Таким образом, железо (его основная часть) служит анодом. ассмотрим разрушение железного образца в присутствии примеси меди. На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит. Таким образом, железо (его основная часть) служит анодом. На аноде Fe0 – 2e- = Fe2+ - окисление Поток электронов перемещается к меди — металлу с меньшей активностью, на ней накапливается избыточное количество электронов. Таким образом, медные участки могут поделиться электронами, поэтому на них возможны процессы восстановления. Примесь меди выполняет роль катода. На катоде: O20+2H2O0 + 4e- = 4HO- - восстановление 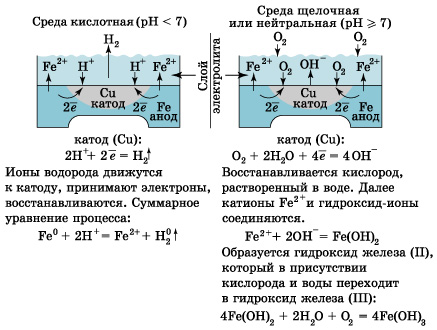 В зависимости от среды электролита на катоде могут идти разные процессы. Рассмотрим пример коррозии железа с примесями меди в кислой и щелочной (нейтральной) среде. На аноде (более активном металле) т.е. железе идет окисление атомов металла с образованием катионов (растворение). Fe0 -2e-→Fe+2 На катоде (менее активном проводнике) т.е меди в кислой среде идет восстановление ионов водорода 2H++2e-→H2↑ или молекул кислорода в щелочной (нейтральной) среде O20+2H2O0 + 4e- = 4HO- 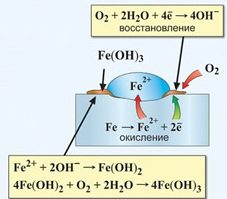 Катионы водорода и растворенный кислород, важнейшие окислители, вызывающие электрохимическую коррозию. Способы защиты от коррозии 1   . Нанесение защитных покрытий. . Нанесение защитных покрытий. 2 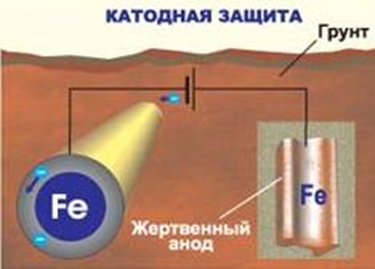 . Электрохимические методы защиты . Электрохимические методы защитыКатодная защита Металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность её анодного разрушения. П 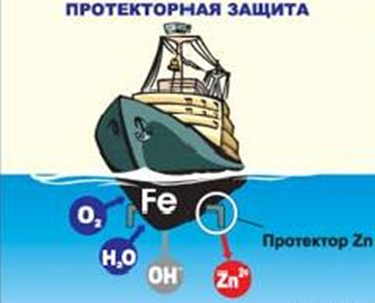 ротекторная защита ротекторная защитаК защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита. 3. Шлифование поверхностей изделия Поверхности шлифуют, чтобы на них не задерживалась влага. 4. Применение легированных сплавов Они содержат специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой. Известны легированные стали – «нержавейки», из которых изготавливают предметы домашнего обихода, детали машин, инструменты. 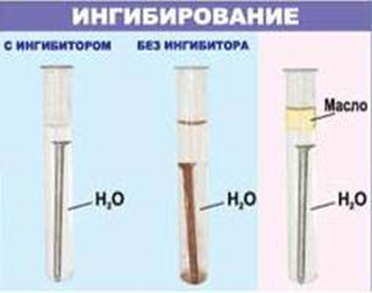 5. Специальная обработка электролита или другой среды Введение веществ ингибиторов, замедляющих коррозию. |
