статья для Вестника АН.ЧР 17.10.16. К вопросу о влиянии ионов на поверхностныесвойства суспензий бентонитов
 Скачать 117.69 Kb. Скачать 117.69 Kb.
|
|
УДК744.72 К вопросу о влиянии ионов на поверхностныесвойства суспензий бентонитов 1 Р.Х ДАДАШЕВ, 3Р.С. ДЖАМБУЛАТОВ 1Д.З. ЭЛИМХАНОВ 1Чеченский государственный университет, ул. Шерипова, 32, г. Грозный 2Академия наук Чеченской Республики пр-кт Эсамбаева, 13, Грозный 3Чеченский государственный педагогический университет ул. Киевская, 33, Грозный edzhabrail@mail.ru В работе представлены результаты измерения концентрационной зависимости поверхностного натяжения суспензии бентонита и ее дисперсионной среды, полученной после 15-20 дневной выдержки. Дается критический анализ работ, посвященных исследованию поверхностных свойств суспензий бентонитов. Рассмотрены различные подходы к объяснению природы минимума на изотермах поверхностного натяжения суспензий бентонитов. Ключевые слова: Поверхностное натяжение, адсорбция, ионы, поверхностный слой, поверхностно-инактивные вещества, электролиты. The paper presents the results of measurement of the concentration dependence of the surface tension of the suspension of bentonite and its dispersion medium obtained after 15-20 day exposure. A critical analysis of studies of the surface properties of bentonite suspensions. Various approaches to the explanation of the low surface tension isotherms of bentonite suspensions. Keywords: Surface tension, adsorption, surface layer, surface-inactive materials, electrolytes. В последнее время суспензии бентонитов привлекают к себе пристальное внимание исследователей своими уникальными физико-химическими и механическими свойствами. Однако степень влияния частиц, образующихся при формировании суспензии, на поверхностные свойства таких систем остается до конца невыясненным, хотя это имеет важнейшее значение для понимания процессов протекающих в поверхностном слое [1]. Существует несколько альтернативных взглядов на природу особенностей на изотермах поверхностного натяжения (σ) водных суспензий бентонитов и растворов электролитов [2-5]. На наш взгляд, заслуживает особого внимания объяснение природы экстремума данное авторами [2]. По мнению этих авторов, наличие экстремумов на изотермах σ в суспензиях бентонитов обусловлено влиянием ионов из ионообменного комплекса (в основном ионы К+ и Na+) переходящих из бентонита в дисперсионную среду при образовании суспензии. На основе анализа экспериментальных данных [6-8], нами было выявлено, что размеры частиц твердой фазы бентонита оказывают влияние на изотерму σ суспензии. Так, с целью выявления роли, которую играет размер частиц суспензии на значение поверхностного натяжения, в работе [6] нами были изучены суспензии бентонитов до и после ультразвукового и термического диспергирования (кипячение суспензии). Анализ полученных экспериментальных данных показывает, что наличие и выраженность экстремумов на изотермах σ прямо или косвенно связана с размерами частиц бентонита. Было выявлено, что уменьшение размеров частиц, приводит к уменьшению или полному исчезновению минимума на изотермах σ. В работах [7,8] для объяснения влияния размеров частиц на характер концентрационной зависимости поверхностного натяжения нами были сделаны следующие предположения о возможной причине минимумов на изотермах σ суспензий бентонитов: 1) влияние пространственной ориентации наноразмерных частиц бентонита в поверхностном слое; 2) влияние седиментации частиц бентонита; 3) некорректная постановка эксперимента по измерению поверхностного натяжения. Очевидно, что эти выводы требуют дальнейшего экспериментального и теоретического подтверждения. Этим вопросам посвящена данная работа. Рассмотрим более подробно точку зрения, согласно которой минимумы на изотермах σ обусловлены влиянием ионов электролитов, переходящих из твердой фазы в дисперсионную среду. Действительно, экспериментальные исследования показывают, что при взаимодействии природного бентонита с водой, происходит переход ионов, содержащихся на поверхности кристаллической структуры бентонита в дисперсионную среду, в результате чего повышается концентрация ионов электролитов в дисперсионной среде. Существует мнение, что в водных и неводных растворах электролитов (ионы калия и натрия) проявляют явно выраженные поверхностно-инактивные свойства во всем концентрационном интервале. Однако авторы [2,3] предполагают, что в области малых концентраций ионы натрия, калия, проявляют и поверхностно-активные свойства. Этими авторами получены также данные, указывающие на аномальное влияние температуры на величину поверхностного натяжения различных типов электролитов. Поэтому вопрос о характере поверхностной активности ионов в растворах электролитов, остается открытым и требует дальнейшего изучения. С другой стороны, анализируя предложенные в литературе подходы и модели, применяемые для описания поверхностных свойств растворов, можно сделать вывод о том, что к настоящему времени нет единого мнения для объяснения процессов, протекающихв поверхностном слое растворов неорганических электролитов. Существующие модели в основном разработаны для органических ПАВ. При термодинамическом описании процессов происходящих в поверхностном слое неорганических электролитов, необходимо также учитывать и возможность адсорбции отдельных ионов и влияние заряда поверхностного слоя на характеристики адсорбционного равновесия [9]. Принято выделять несколько типов взаимодействия электролитов с адсорбентом. Электролит может адсорбироваться как единое целое; этот процесс напоминает молекулярную адсорбцию из растворов. Ионы одного знака удерживаются поверхностью сильнее, чем ионы другого знака, образующие диффузный слой [9]. Известно также что заряд поверхности оказывает влияние поверхностное натяжение сильно разбавленных растворов электролитов, так называемый эффект Джонса-Рея. Авторами [10] было измерено поверхностное натяжение водных растворов NaCI и KCI. Полученные данные свидетельствуют о наличии заметного минимума на изотермах σ при малом времени образования поверхности. С увеличением возраста поверхности минимум на изотермах σ исчезает. Проявление эффекта Джонса-Рея, эти авторы, связывают с неравновесными процессами в поверхностном слое, которые обусловлены наличием свободных электрических зарядов на ее поверхности. По мнению авторов [10], закономерности адсорбции на границе раздела фаз растворов электролитов и наиболее вероятного механизма формирования поверхностных слоев, связаны с изменением поверхностной концентрации ионов, которое вызывает изменение электрической составляющей энергии Гиббса процесса адсорбции, и других термодинамических характеристик поверхности. Таким образом, локальную поверхностную активность растворов электролитов они связывают с влиянием процессов сольватации [9]. Так, в работе [3] приводятся экспериментальные данные по концентрационной зависимости поверхностного натяжения растворов электролитов. Из полученных данных следует, что изотермы поверхностного натяжения водных растворов электролитов имеют сложный полиэкстремальный характер с максимумом и минимумами в области низких концентраций растворенных веществ. По мнению этих авторов [2,3], причиной наблюдаемых экстремумов на изотермах σ, является конкурентная адсорбция ионов в зависимости от концентрации. По их мнению, энергия таких взаимодействий может превышать энергию водородных связей, возникающих при взаимодействии свободных молекул воды, что приводит к снижению поверхностной концентрации катионов. Вызывает интерес и температурная зависимость поверхностного натяжения, где с ростом температуры численные значения поверхностного натяжения водных растворов хлоридов натрия и калия возрастают во всем интервале концентраций растворенных веществ. По мнению авторов [3] наблюдаемая температурная аномалия обусловлена эндотермичностью адсорбции электролитов, приводящей к увеличению концентрации электролитов в поверхностном слое при повышении температуры. В связи с противоречивым характером данных по поверхностным свойствам растворов неорганических электролитов, нами было измерено поверхностное натяжение разбавленных водных растворов NaCI и KCI в концентрациях, соответствующих экстремумам на изотермах поверхностного натяжения суспензий бентонитов [3]. Для экспериментальных исследований использовались реактивы NaCI и KCI (ХЧ). 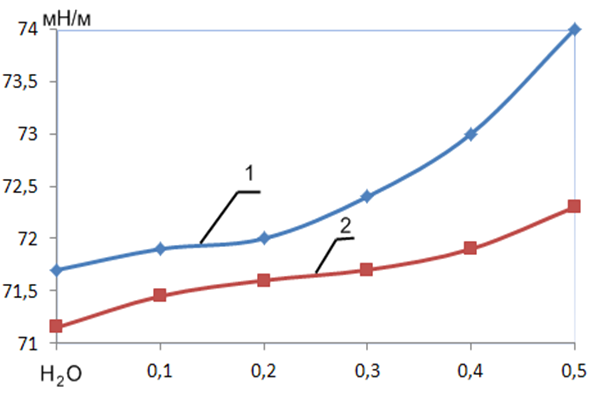 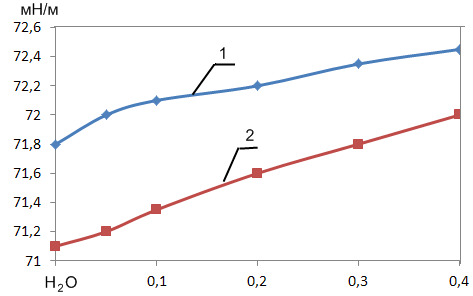 Рис 1. Концентрационная зависимость поверхностного натяжения водных растворов NaCI 1- 298К. 2- 303К. Рис 2. Концентрационная зависимость поверхностного натяжения водных растворов КCI1- 298К. 2- 303К Поверхностное натяжение измерялось с помощью тензиометра DSA-100 фирмы «KRUSS» методом висящей капли [11]. Термостатирование осуществилось с помощью термокамеры «KRUSS» (погрешность не более 0.1С0). Полученные результаты представлены на рис. 1 и 2. Как видно из этих рисунков изотермы σ представляют собой гладкие кривые, монотонно возрастающие с увеличением концентрации электролитов. Повышение температуры также закономерно понижает значения σ во всем диапазоне концентраций. Для выявления роли, которую могут играть ионы электролитов на поверхностные свойства суспензий бентонитов, нами была проведена серия экспериментов, представленная в работе [12]. В данной работе с целью определения концентрации ионов натрия, калия и железа, переходящих в дисперсионный слой в результате образования водной суспензии бентонита, был проведен химический анализ дисперсионной среды отделенной от твердой фазы после 15 – 20 дневной выдержки в ней природного бентонита. Из анализа полученных результатов следует, что концентрация ионов, перешедших в дисперсионный слой при образовании водной суспензий, линейно повышается с увеличением концентрации твердой фазы бентонита. В дальнейшем эти образцы были изучены с целью определения величины поверхностного натяжения. Для экспериментального исследования были приготовлены суспензии бентонита и их вытяжки, содержащие дисперсионную среду. Измерения проводились при Т=293 К. Как видно из рис. 3, кривые изотерм σ сильно различаюся. 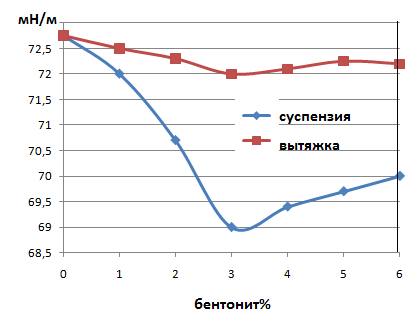 Рис 3. Зависимость поверхностного натяжения от концентрации твердой фазы водных суспензий природных бентонитов и ее дисперсионной среды Так, изотерма σ суспензии бентонита имеет сильный наклон кривой и в области концентрации 3% массовой доли бентонита, изотерма претерпевает минимум. При дальнейшем увеличении концентрации твердой фазы наблюдается небольшой рост кривой изотермы σ. Кривая изотермы σ полученной из дисперсионной среды, в которой содержалась твердая фаза природного бентонита с выдержкой 15-20 суток, паказала незначительный минимум в области 3%, находящаяся в пределах погрешности эксперимента (1%). Таким образом, полученные результаты по определению поверхностного натяжения дисперсионной среды полученных из суспензий бентонитов, а также данные о температурной и концентрационной зависимости водных растворов хлоридов натрия и калия, не выявили какие-либо особенности на изотермах 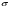 , которые бы согласовывались с характером кривой зависимости , которые бы согласовывались с характером кривой зависимости 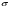 – от концентрации, наблюдаемой в бентонитовых суспензиях. Полученные результаты характеризуют растворы, содержащие ионы калия и натрия, как вещества с явно выраженными инактивными свойствами, что согласуется с общепринятыми теоретическими представлениями [13]. И наоборот, имеющийся экспериментальный материал свидетельствует о том, между величиной и выраженностью экстремумов на изотерме σ суспензий бентонитов и размерами частиц существует корреляция. Отсюда можно сделать вывод, что при увеличении удельной поверхности частиц суспензии происходит уменьшение или исчезновение минимума на графике зависимости σ в водных суспензиях бентонитов. – от концентрации, наблюдаемой в бентонитовых суспензиях. Полученные результаты характеризуют растворы, содержащие ионы калия и натрия, как вещества с явно выраженными инактивными свойствами, что согласуется с общепринятыми теоретическими представлениями [13]. И наоборот, имеющийся экспериментальный материал свидетельствует о том, между величиной и выраженностью экстремумов на изотерме σ суспензий бентонитов и размерами частиц существует корреляция. Отсюда можно сделать вывод, что при увеличении удельной поверхности частиц суспензии происходит уменьшение или исчезновение минимума на графике зависимости σ в водных суспензиях бентонитов. Литература
|
