качественные реакции неорганической химии. Качественные реакции неорганической химии. Качественные реакции на катионы
 Скачать 113 Kb. Скачать 113 Kb.
|
|
Качественные реакции неорганической химии. 1. Качественные реакции на катионы. 1.1.1 Качественные реакции на катионы щелочных металлов (Li+, Na+, K+, Rb+, Cs+). На катионы щелочных металлов возможно провести только с сухими солями, т.к. практически все соли щелочных металлов растворимы (исключением являются Li3PO4, LiF, Li2SiO3, KClO4, RbClO4, CsClO4). Обнаружить их можно, внеся небольшое количество соли в пламя горелки. Тот или иной катион окрашивает пламя в соответствующий цвет: Li+ - темно-розовый. Na+ - желтый. K+ - фиолетовый. Rb+ - красный. Cs+ - голубой. Как уже отмечалось ранее, катион лития Li+ можно выявить и другим путем. При сливании раствора соли лития с фосфатами, фторидами или силикатами образуются соответствующие осадки: 3Li+ + PO43- -----> Li3PO4↓ Li+ + F- ----> LiF↓ 2Li+ + SiO32- ------> Li2SiO3↓ Осадить ионы K+, Rb+, Cs+ можно перхлорат-анионом ClO4-. Me+ + ClO4- -----> MeClO4↓ (Me = K, Rb, Cs) Но я бы не советовал ее использовать при написании самостоятельных, контрольных и т.п. работ, более эффективен метод, изложенный выше. 1.1.2 Качественные реакции на катионы щелочно-земельных металлов (Ca2+, Sr2+, Ba2+. Ra2+ рассматривать не будем.). Катионы щелочно-земельных металлов, в отличии от катионов щелочных, можно выявить двумя способами: в растворе и по окраске пламени. Кстати, к щелочно-земельным относятся кальций, стронций, барий и радий. Бериллий и магний нельзя отнести к этой группе, как это любят делать на просторах Интернета. Окраска пламени: Ca2+ - кирпично-красный. Sr2+ - карминово-красный. Ba2+ - желтовато-зеленый. Реакции в растворах. Катионы рассматриваемых металлов имеют общую особенность: их карбонаты и сульфаты нерастворимы. Катионы кальция обычно выявляют карбонат-анионом: Ca2+ + CO32- ------> CaCO3↓ Который легко растворяется в азотной кислоте с выделением углекислого газа: 2H+ + CO32- -------> H2O + CO2↑ Катионы бария и стронция предпочитают выявлять сульфат-анионом с образованием сульфатов, нерастворимых в конц. азотной кислоте: Sr2+ + SO42- ------> SrSO4↓ Ba2+ + SO42- ------> BaSO4↓ 1.1.3. Качественные реакции на катионы свинца Pb2+, серебра Ag+, ртути (I) Hg2+, ртути (II) Hg2+. Рассмотрим их на примере свинца и серебра. Эта группу катионов объединяет одна общая особенность: они образуют нерастворимые хлориды. Но катионы свинца и серебра можно выявить и другими галогенидами. Качественная реакция на катион свинца - образование хлорида свинца (осадок белого цвета), либо образование иодида свинца (осадок ярко желтого цвета): Pb2+ + 2I- -------> PbI2↓ Качественная реакция на катион серебра - образование белого творожистого осадка хлорида серебра, желтовато-белого осадка бромида серебра, образование желтого осадка иодида серебра: Ag+ + Cl- ------> AgCl↓ Ag+ + Br- ------> AgBr↓ Ag+ + I- ------> AgI↓ Как видно из выше изложенных реакций, галогениды серебра (кроме фторида) нерастворимы, а бромид и иодид даже имеют окраску. Но отличительная черта их не в этом. Данные соединения разлагаются на свету на серебро и соответствующий галоген, что также помогает их идентифицировать. Также при добавлении к данным осадкам тиосульфата натрия они растворяются: AgHal + 2Na2S2O3 -------> Na3[Ag(S2O3)2] + NaHal, (Hal = Cl, Br, I). То же самое произойдет при добавлении аммиака: AgHal + 2NH3 -----> [Ag(NH3)2]Hal Существует также еще одна качественная реакция на катион серебра - образование оксида серебра черного цвета при добавлении щелочи: 2Ag+ + 2OH- -----> Ag2O↓ + H2O Это связано с тем, что гидроксид серебра при нормальных условиях не существует и сразу же распадается на оксид и воду. 1.1.4. Качественная реакция на катионы алюминия Al3+, хрома (III) Cr3+, цинка Zn2+, олова (II) Sn2+. Данные катионы объединены образованием нерастворимых оснований, легко переводимых в комплексные соединения. Групповой реагент - щелочь. Al3+ + 3OH- -------> Al(OH)3 + 3OH- -------->[Al(OH)6]3- Cr3+ + 3OH- ------> Cr(OH)3 + 3OH- ------->[Cr(OH)6]3- Zn2+ + 2OH- ------> Zn(OH)2 + 2OH- ------>[Zn(OH)4]2- Sn2+ + 2OH- -------> Sn(OH)2 + 2OH- ------->[Sn(OH)4]2- Раствор, содержащий [Cr(OH)6]3-, при добавлении бромной воды в щелочной среде становится желтым из-за образования хромат-аниона CrO42-: 2[Cr(OH)6]3- + 3Br2 + 4OH- -----> 2CrO42- + 6Br- + 8H2O 1.1.5. Качественная реакция на катионы железа Fe2+, Fe3+. Данные катионы также образуют нерастворимые основания. Иону Fe2+ отвечает нерастворимый осадок белого (на воздухе зеленого) цвета - гидроксида железа (II) Fe(OH)2, катиону Fe3+ отвечает метагидроксид железа (III) FeO(OH) бурого цвета. Но для избежания недорозумений советую писать гидроксид Fe(OH)3. Качественная реакция на Fe2+: Fe2+ + 2OH- -----> Fe(OH)2↓ Fe(OH)2 будучи соединением двухвалентного железа на воздухе неустойчиво и постепенно переходит в метагидроксид железа (III). 4Fe(OH)2 + O2 -----> 4FeO(OH)↓ + 2H2O Качественная реакция на Fe3+: Fe3+ + 3OH- -----> FeO(OH)↓ + H2O Еще одной качественной реакцией на Fe3+ является взаимодействие с роданид-анионом, образуя роданид железа темно-красного цвета (III) (эффект "крови"): Fe3+ + 3SCN- ------> Fe(SCN)3 Полученный роданид легко разрушается фторидами: Fe(SCN)3 + 6NaF -----> Na3[FeF6] + 3NaSCN Очень чувствительная реакция на Fe3+, помогает обнаружить даже очень незначительные следы данного катиона. 1.1.6. Качественная реакция на катион марганца (II) Mn2+. Данная реакция основана на жестком окислении марганца в кислой среде с изменением степени окисления с +2 до +7. При этом раствор окрашивается в темно-фиолетовый цвет из-за появления перманганат-аниона. Рассмотрим на примере нитрата марганца (II): 2Mn(NO3)2 + 5PbO2 + 6HNO3 ------> 2HMnO4 + 5Pb(NO3)2 + 2H2O 1.1.7. Качественная реакция на катионы меди Cu2+, кобальта Co2+ и никеля Ni2+.Особенность этих катионов в том, что их соли растворяются в аммиаке с образованием комплексных солей - аммиакатов: Cu2+ + 4NH3 -------> [Cu(NH3)4]2+ Аммиакаты окрашивают растворы в яркие цвета, к примеру аммиакат меди окрашивает раствор в ярко-синий цвет. 1.1.8. Качественные реакции на катион аммония NH4+. Взаимодействие солей аммония с щелочами при небольшой температуре: NH4+ + OH- ---t---> NH3↑ + H2O Влажная лакмусовая бумажка, поднесенная к току аммиака, окрасится в синий цвет. На этом я закончу описание выявления катионов. Теперь рассмотрим качественные реакции на некоторые анионы. 2. Качественные реакции на анионы. 2.1.1. Качественные реакции на сульфид-анион S2-. Из сульфидов растворимы сульфиды только щелочных металлов. Нерастворимые сульфиды имеют специфическую окраску, по которым можно определить тот или иной сульфид. Осаждаются сульфиды марганца Mn2+, Pb2+, Zn2+, Ag+, Cd2+, Sn2+ и некоторых других. Окраска: MnS - телесный (розовый). ZnS - белый. PbS - черный. AgS - черный. CdS - лимонно-желтый. SnS - шоколадный. Сульфиды переводятся в раствор сильными кислотами (HNO3). Также сульфид-анион можно выявить, приливая раствор сульфида к бромной воде: S2- + Br2 ------> S↓ + 2Br- Образующаяся сера выпадает в осадок. 2.1.2. Качественная реакция на сульфат-анион SO42-.Сульфат-анион обычно осаждают катионом свинца, либо бария: Pb2+ + SO42- ------> PbSO4↓ Осадок сульфата свинца белого цвета. 2.1.3.Качественная реакция на силикат-анион SiO32-. Силикат-анион легко осаждается из раствора в виде стекловидной массы при добавлении сильных кислот. SiO32- + 2H+ -----> H2SiO3↓ (SiO2 * nH2O) 2.1.4. Качественные реакции на хлорид-анион Cl-, бромид-анион Br-, иодид-анион I- смотрите в пункте "качественные реакции на катион серебра Ag+". 2.1.5. Качественная реакция на сульфит-анион SO32-. При добавлении к раствору сильных кислот образуется диоксид серы SO2 с резким запахом (запах подожженной спички): SO32- + 2H+ -----> SO2↑ + H2O 2.1.6. Качественная реакция на карбонат-анион CO32-.При добавлении к раствору карбоната сильных кислот образуется углекислый газ CO2, гасящий горящую лучинку: CO32- + 2H+ -----> CO2↑ + H2O 2.1.7. Качественная реакция на тиосульфат-анион S2O32-. При добавлении конц. серной или соляной кислоты к раствору тиосульфата образуется диоксид серы SO2 и выпадает в осадок сера S: S2O32- + 2H+ -----> S↓ + SO2↑ + H2O 2.1.8. Качественная реакция на хромат-анион CrO42-. При добавлении к раствору хромата раствор солей бария выпадает желтый осадок хромата бария BaCrO4, разлагающегося в сильнокислой среде: Ba2+ + CrO42- ----> BaCrO4↓ Растворы хроматов окрашены в желтый цвет. При подкислении раствора цвет изменится на оранжевый, отвечающий дихромат-аниону Cr2O72-: 2CrO42- + 2H+ -----> Cr2O72- + H2O 2.1.9. Качественная реакция на дихромат-анион Cr2O72-.При добавлении к раствору дихромата раствор соли серебра образуется осадок оранжевого цвета Ag2Cr2O7: 2Ag+ + Cr2O72- -----> Ag2Cr2O7↓ Растворы дихроматов окрашены в оранжевый цвет. При подщелачивании раствора окраска изменяется на желтую, отвечающая хромат-аниону CrO42-: Cr2O72- + 2OH- -----> 2CrO42- + H2O Кроме того, дихроматы - сильные окислители в кислой среде. При внесении в раствор дихромата какой-либо восстановитель окраска раствора изменится с оранжевого на зеленый, отвечающей катиону хрома (III) Сr3+(На примере иодидов): 6I- + Cr2O72- + 14H+ ------> 3I2 + 2Cr3+ + 7H2O Эффектной качественной реакцией на шестивалентный хром - темно-синее окрашивание раствора при добавлении конц. перекиси водорода в эфире. Образуется пероксид хрома состава CrO5. 2.2.0. Качественная реакция на перманганат-анион MnO4-. Перманганат-анион "выдает" темно-фиолетовая окраска раствора. Кроме того, перманганаты - сильнейшие окислители, в кислой среде восстанавливаются до Mn2+ (фиолетовая окраска исчезает), в нейтральной до Mn+4 (окраска исчезает, выпадает бурый осадок диоксида марганца MnO2) и в щелочной до MnO42- (окраска раствора изменяется на темно-зеленый). 2.2.1. Качественная реакция на манганат-анион MnO42-. При подкислении раствора манганата темно-зеленая окраска изменяется на темно-фиолетовую, отвечающую перманганат-аниону MnO4-: 3K2MnO4 + 4HCl(разб.) -----> MnO2↓ + 2KMnO4 + 4KCl + 2H2O 2.2.2.Качественная реакция на фосфат-анион PO43-. При добавлении к раствору фосфата раствор соли серебра выпадает желтый осадок фосфата серебра (I) Ag3PO4: 3Ag+ + PO43- -----> Ag3PO4↓ Аналогична реакция и к дигидрофосфат-аниону H2PO4-. 2.2.3. Качественная реакция на феррат-анион FeO42-.Осаждение из раствора феррата бария красного цвета: Ba2+ + FeO42- ----> BaFeO4↓ 2.2.4. Качественная реакция на нитрат-анион NO3-. Подкисленный раствор нитратов обладает окислительными свойствами подобно азотной кислоте. К примеру, смесь растворов нитрата калия и серной кислоты реагирует с медью: 3Cu + 2KNO3 + 4H2SO4 -----> 3CuSO4 + K2SO4 + 2NO↑ + 4H2O Оксид азота (II) NO буреет на воздухе. Вот основные качественные реакции на анионы. Далее мы рассмотрим качественные реакции на простые и сложные вещества. 3.Качественные реакции на простые и сложные вещества. Некоторые сложные вещества, как и ионы, обнаруживаются качественными реакциями. Ниже я опишу качественные реакции некоторых веществ. 3.1.0.Качественная реакция на водород H2. "Лающий" хлопок при поднесении горящей лучинки к источнику водорода. 3.1.1. Качественная реакция на кислород O2. Яркое загорание тлеющей лучинки в атмосфере кислорода. 3.1.2. Качественная реакция на озон O3. Взаимодействие озона с раствором иодидов с выпадением кристаллического I2иода в осадок: 2KI + O3 + H2O -----> 2KOH + I2↓ + O2↑ В отличии от озона кислород в данную реакцию не вступает. 3.1.3. Качественная реакция на хлор Cl2. Взаимодействие недостатка хлора с растворами иодидов: 2KI + Cl2 ----> 2KCl + I2↓ В результате реакции в осадок выпадает иод I2. При избытке хлора реакций пойдет дальше - иод растворится с образованием иодноватой кислоты HIO3: I2 + 5Cl2 + 6H2O ------> 2HIO3 + 10HCl 3.1.4. Качественные реакции на аммиак NH3. Взаимодействие аммиака с газообразным хлороводородом с образованием белых кристалликов хлорида аммония ("дым" без огня): NH3 + HCl ----> NH4Cl Примечание: следующие реакции не дают в школьном курсе. Однако, это самые надежные качественные реакции на аммиак. Почернение бумажки, смоченной в растворе соли ртути (I) Hg2+. Подробно рассмотрим реакцию: Hg2Cl2 + 2NH3 -----> Hg(NH2)Cl↓ + Hg↓ + NH4Cl Бумажка чернеет из-за выделения мелкодисперсной ртути. Взаимодействие аммиака с щелочным раствором тетраиодомеркурата (II) калия (реактив Несслера): 2K2[HgI4] + NH3 + 3KOH ------> [O(Hg)2NH2]I↓ + 7KI + 2H2O Комплекс [O(Hg)2NH2]I коричневого цвета (цвет ржавчины) выпадает в осадок. Две последние реакции являются самыми надежными на аммиак. 3.1.5. Качественная реакция на фосген COCl2. Испускание белого "дыма" от бумажки, смоченного в растворе аммиака: COCl2 + 4NH3 -----> (NH2)2CO + 2NH4Cl 3.1.6. Качественная реакция на угарный газ CO. Помутнение раствора при пропускании угарного газа в раствор хлорида палладия (II): PdCl2 + CO + H2O -----> CO2↑ + 2HCl + Pd↓ 3.1.7. Качественная реакция на углекислый газ CO2.Тушение тлеющей лучинки в атмосфере углекислого газа. При пропускании через раствор известкового молока Ca(OH)2 образуется осадок, растворяющийся при дальнейшем пропускании газа: Ca(OH)2 + CO2 --------> CaCO3↓ + H2O CaCO3 + CO2 + H2O -------> Ca(HCO3)2 3.1.8. Качественная реакция на оксид азота (II) NO.Оксид азота (II) очень чувствителен к кислороду воздуха, потому на воздухе буреет, окисляясь до оксида азота (IV): 2NO + O2 ----> 2NO2 Качественные реакции органической химии. 18.01.2012 19:16 | Обновлено 22.05.2012 12:14 | Автор: Avetik | В этой статье я опишу некоторые качественные реакции органических соединений. Их огромное количество, ведь органических соединений гораздо больше: свыше 27 000 000 органических на 500 000 неорганических. Разница очевидна. В органической химии качественные реакции определяют преимущественно вещества, а если быть точнее, то представителей класса веществ (алканы, алкены и т.д.). 1. Качественная реакция на алканы. Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают - горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску. 2. Качественная реакция на алкены. Чтобы убедиться в наличии алкена, нужно пропустить его в раствор перманганата калия (реакция Вагнера). В ходе реакции раствор обесцветится, выпадает бурый диоксид марганца MnO2 (реакция на примере этилена): 3C2H4 + 2KMnO4 + 4H2O ------> 3CH2OH-CH2OH + 2KOH + 2MnO2↓ Так же, алкены обесцвечивают бромную воду: C2H4 + Br2 -----> C2H4Br2 Бромная вода обесцвечивается, образуется дибромпроизводное. 3. Качественная реакция на алкины. Алкины можно выявить и по реакции Вагнера или с помощью бромной воды: 3C2H2 + 8KMnO4 -----> 3KOOC-COOK + 8MnO2↓ + 2KOH + 2H2O C2H2 + 2Br2 ----> C2H2Br4 Алкины с "наружной" тройной связью реагируют с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I))(реактив Толленса): C2H2 + 2[Ag(NH3)2]OH -------> Ag2C2↓ + 4NH3↑ + 2H2O Получившийся ацетиленид серебра (I) выпадает в осадок. Данная качественная реакция действует только на алкины с "наружной" тройной связью. Алкины, у которых тройная связь в середине (R-C-=C-R) в эту реакцию не вступают. Такая способность алкинов замещать протон на атом металла, подобно кислотам, обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. В следствии этого, атом углерода сильнее обогощается электронной плотностью и протон становится подвижным. 4. Качественная реакция на альдегиды. Одна из самых интересных качественных реакций в органической химии - на альдегиды, предназначена исключительно для выявления соединений, содержащих альдегидную группу. К альдегиду приливают аммиачный раствор оксида серебра, реакция идет при нагревании: CH3-CHO + 2[Ag(NH3)2]OH ---t--> CH3-COOH + 2Ag↓ + 4NH3↑ + H2O Если опыт проведен грамотно, то выделяющееся серебро покрывает колбу ровным слоем, создавая эффект зеркала. Именно поэтому реакция называется реакцией серебряного зеркала. Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота - единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы: 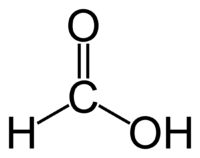 В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду: HCOOH + 2[Ag(NH3)2]OH ---t--> CO2↑ + 2H2O + 4NH3↑ + 2Ag↓ Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH)2. Для этого свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь: CuSO4 + 2NaOH -----> Na2SO4 + Cu(OH)2↓ CH3-CHO + 2Cu(OH)2 ---t---> CH3-COOH + Cu2O↓ + 2H2O Выпадает оксид меди (I) Cu2O - осадок красного цвета. Еще один метод определения альдегидов - реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера: CH3-CHO + K2[HgI4] + 3KOH ------> CH3-COOK + Hg↓ + 4KI + 2H2O При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет. 5. Качественные реакции на спирты. Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных реакции различны. Качественные реакции на одноатомные спирты: Простейшая качественная реакция на спирты - окисление спирта оксидом меди. Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым: CH3-CH2-OH + CuO --t--> CH3-CHO + Cu + H2O Спирты идентифицируются пробой Лукаса - конц. раствор соляной кислоты и хлорида цинка. При пропускании вторичного или третичного спирта в такой раствор образуется маслянистый осадок соответствующего алкилхлорида: CH3-CHOH-CH3 + HCl --ZnCl2--> CH3-CHCl-CH3 + H2O Первичные спирты в реакцию не вступают. Еще одним известным методом является иодоформная проба: CH3-CH2-OH + 4I2 + 6NaOH ------> CHI3↓ + 5NaI + HCOONa + 5H2O Качественные реакции на многоатомные спирты. Наиболее известная качественная реакция на многоатомные спирты - взаимодействие их с гидроксидом меди (II). Гидроксид растворяется, образуется хелатный комплекс темно-синего цвета. Обратите внимание на то, что в отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания. 2CH2OH-CH2OH + Cu(OH)2 ------> CH2OH--- −OH2C ______Cu_____ CH2O− ---HOH2C 6. Качественные реакции на карбоновые кислоты. На карбоновые кислоты обычно подчеркивают образование цветных осадков с тяжелыми металлами. Но наиболее осуществимая качественная реакция на метановую кислоту HCOOH. При добавлении концентрированной серной кислоты H2SO4 к раствору муравьиной кислоты образуется угарный газ и вода: HCOOH --H2SO4---> CO↑ + H2O Угарный газ можно поджечь. Горит синем пламенем: 2CO + O2 --t--> 2CO2 Из многоосновных кислот рассмотрим качественную реакцию на щавелевую. При добавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадок оксалата меди (II): Cu2+ + C2O42- -----> CuC2O4↓ Щавелевая кислота также, как и муравьиная, разлагается концентрированной серной кислотой: H2C2O4 ----H2SO4---> CO↑ + CO2↑ + H2O 7. Качественные реакции на амины. На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин от вторичного путем взаимодействия с азотистой кислотой HNO2. Для начала нужно ее приготовить, а затем добавить амин: NaNO2 + HCl -----> NaCl + HNO2 Первичные дают азот N2: CH3-NH2 + HNO2 ------> CH3-OH + N2↑ + H2O Вторичные - алкилнитрозоамины - вещества с резким запахом (на примере диметилнитрозоамина): CH3-NH-CH3 + HNO2 -----> CH3-N(NO)-CH3 + H2O Анилин образует осадок при добавлении бромной воды: C6H5NH2 + 3Br2 ------> C6H2NH2(Br)3↓ + 3HBr Анилин C6H5NH2 можно обнаружить по сиреневой окраске при добавлении хлорной извести. 8. Качественные реакции на фенол. Фенол лучше всегообнаруживает хлорид железа (III) - образуется фиолетовое окрашивание раствора. Этот лучший метод обнаружения фенола, т.к. реакция очень чувствительна. Также фенол наряду с анилином дает осадок желтоватого цвета при пропускании в водный раствор брома - 2,4,6 - трибромфенол: C6H5OH + 3Br2 ------> C6H2OH(Br)3↓ + 3HBr Фенолы дают фенол-альдегидные смолы при реакции фенола с альдегидом в кислой среде. При этом образуется мягкие пористые массы фенол-альдегидных смол (реакция поликонденсации). 9. Качественная реакция на алкилхлориды. Вещества, содержащие хлор, могут окрашивать пламя в зеленый цвет. Для этого нужно обмакнуть медную проволоку в алкилхлориде и поднести к пламени (проба Бельштейна). 10. Качественная реакция на углеводы. Большинство углеводов имеют альдегидные и гидроксильные группы, поэтому для них характерны все реакции альдегидов и многоатомных спиртов. Существует способ, который помогает различить глюкозу от фруктозы. Этот способ носит название проба Селиванова. Для того, чтобы различить эти углеводы, к ним приливают смесь резорцина и соляной кислоты. Реагирует со смесью фруктоза, при этом раствор окрашивается в малиновый цвет. Крахмал в присутствии иода окрашивается в темно-синий цвет. При нагревании окраска исчезает, при охлаждении появляется вновь. 11. Качественная реакция на белки. Белки выявляются в основном на реакциях, основанные на окрасках. Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина): (OH)C6H4CH(NH2)COOH + HNO3 ----H2SO4-----> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O - выпал осадок желтого цвета. (OH)C6H3(NO2)CH(NH2)COOH + 2NaOH -------> (ONa)C6H3(NO2)CH(NH2)COONa + H2O - раствор становится оранжевым. Обнаружение серосодержащих аминокислот: Белок + (CH3COO)2Pb ---NaOH---> PbS↓ (осадок черного цвета). Биуретовая реакция для обнаружения пептидной связи (CO-NH): Белок + CuSO4 + NaOH -----> красно-фиолетовое окрашивание. Спецефический запах при горении: Белок ----обжиг----> запах паленой шерсти |
