Лекции по белкам биохимия 2005. Кафедра биохимии
 Скачать 1.2 Mb. Скачать 1.2 Mb.
|
|
Кислотность желудочного сока Кислотность желудочного сока связана с наличием в нем различных неорганических (HCl, кислые фосфаты) и органических (оксо-, окси-, амино-, нуклеиновые, жирные кислоты и т.д.) кислот. В связи с этим выделяют понятие общая кислотность желудочного сока. Основная причина кислотности желудочного сока связана с наличием в нем соляной кислоты. Соляная кислота в желудочном соке находится в свободном и в связанном (с белками и продуктами их переваривания) состоянии. Механизм образования соляной кислоты Согласно карбоангидразной теории, источником Н+ для HCl является Н2СО3, которая образуется в обкладочных клетках желудка из СО2 и Н2О под действием карбоангидразы: Н2О + СО2 → Н2СО3 Н2СО3 диссоциирует на бикарбонат, который выделяется в плазму крови в обмен на С1-, и Н+, который активно переносится Н+/К+-АТФ-азой в просвет желудка в обмен на К+. При этом в просвете желудка концентрация Н+ увеличивается в 106 раз, концентрация НС1 достигает 0,16 М, а значения рН снижается до 1,0-2,0. При максимальной активности обкладочные клетки могут продуцировать до 23 ммоль HCl в час. Синтез HCl - аэробный процесс, требующий большого количества АТФ, поэтому при гипоксии он снижается. Вода выходит из клеток в просвет желудка по осмотическому градиенту 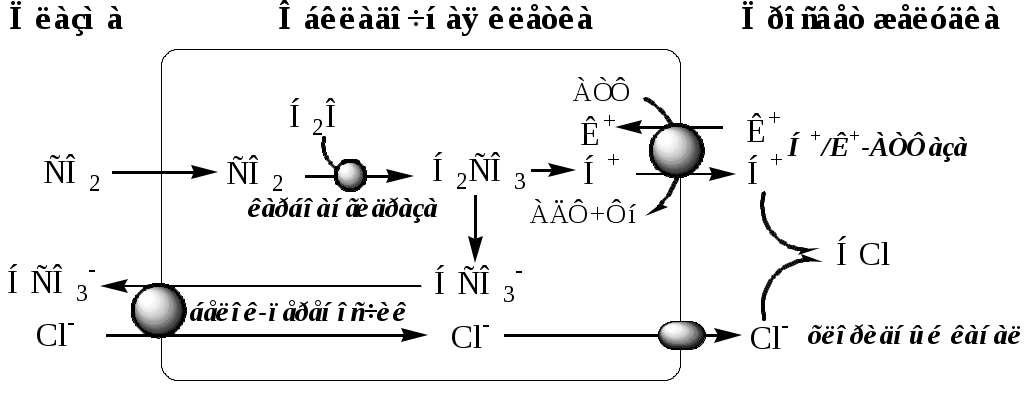 Функции НС1: Вызывает денатурацию и набухание белков пищи, что увеличивает доступность их пептидных связей для действия протеаз; Обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник; Регуляция активности протеолитических ферментов (активирует пепсиноген и создаёт оптимум рН для протеолитических ферментов); Стимулирует работу кишечника и поджелудочной железы. Ферменты желудка Пепсиноген неактивный фермент, синтезируется в главных клетках, состоит из одной полипептидной цепи с молекулярной массой 40 кД. В просвете желудка под действием НС1 от N-конца пепсиногена отщепляется пептид в 42 аминокислотных остатка, который содержит почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. При этом пепсиноген превращается в активный пепсин, он состоит преимущественно из отрицательно заряженных аминокислот, которые участвуют в формировании активного центра. Образовавшиеся под действием НС1 активные молекулы пепсина быстро активируют остальные молекулы пепсиногена аутокатализом. Пепсин – эндопептидаза, с молекулярной массой 32,7 кД и с оптимумом рН=1,0-2,5. Пепсин гидролизует внутренние пептидные связи в белке с образованием коротких пептидов: хорошо - между ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и хуже -между лейцином и дикарбоновыми аминокислотами. Гастриксин – эндопептидаза, с оптимумом рН=3,2-3,5. Образуется из пепсиногена, гидролизует внутренние пептидные связи в белке с образованием коротких пептидов. Реннин (химозин) – эндопептидаза, с оптимумом рН=4,5, вызывает створаживание молока в присутствии ионов кальция. Есть только у детей грудного возраста. Основной белок молока — казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НС1 и пепсина. Пепсин, реннин и гастриксин имеют сходство по первичной структуре, что указывает на их происхождение от общего гена-предшественника. Муцин – мукопротеид образующий слизь. Существует в 2 формах: нерастворимая фракция - покрывает поверхность слизистой оболочки и изолирует эпителий от пищеварительного процесса (механическая и химическая защита); растворимая фракция - образует коллоидную систему, в которой растворены компоненты желудочного сока. Обладает буферными свойствами, способна нейтрализовать кислотность или щелочность. Фактор Касла – гастромукопротеид, содержит пептид, отщепляющийся оп пепсиногена (секрет главных клеток) и мукоид (секрет добавочных клеток). Или образуется париетальными клетками?. Фактор Касла связывает «внешний фактор» – витамин В12, предотвращает его разрушение и способствует всасыванию. Лизоцим - белок, обеспечивающий бактерицидные свойства желудочного сока. Нарушения переваривания белков в желудке При заболеваниях желудка в желудочном соке часто происходит изменение содержание соляной кислоты, реже - снижение активности пищеварительных ферментов, что приводит к нарушению процессов переваривания белков. Для диагностики заболеваний желудка определяют кислотность желудочного сока, содержание в нем свободной и связанной HCl, пепсина, фактора Касла и наличие патологических компонентов: молочной кислоты и крови. Определение кислотности желудочного сока Кислотность желудочного сока выражается в титрационных единицах (Т.Е.), определяется количеством мл 0,1Н раствора NaOH, пошедшего на титрование 100 мл желудочного сока. Титрование проводят в присутствии двух индикаторов, что позволяет в одной пробе определить свободную HCl, связанную HCl и общую кислотность. В норме общая кислотность у взрослых составляет 40-60 Т.Е, кислотность свободной HCl - 20-40 Т.Е., связанной HCl - 20-30 Т.Е. В качестве нарушений выделяют: Повышенная кислотность желудочного сока. Она обычно сопровождается изжогой, диареей и может быть симптомом язвы желудка и двенадцатиперстной кишки, а также гиперацидного гастрита. Пониженная кислотность желудочного сока. Бывает при некоторых видах гастритов. Желудочная ахилия - полное отсутствие НС1 и пепсина в желудочном соке. Наблюдается при атрофических гастритах и часто сопровождается пернициозной анемией вследствие недостаточности выработки фактора Касла и нарушения всасывания витамина В12. Анацидность - рН желудочного сока >6,0. Свидетельствует о значительной потере слизистой оболочкой желудка обкладочных клеток, секретирующих соляную кислоту, что часто вызывает рак желудка. Наличие молочной кислоты. В норме в желудочном соке молочная кислота отсутствует. Она образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате размножения молочнокислых бактерий или при злокачественных опухолях желудка, в клетках которых глюкоза окисляется анаэробным путём. Наличие крови. Эритроциты появляются в желудочном соке при кровотечениях вследствие механических травм, язв и распада опухоли.
При диагностике заболеваний желудка, кроме биохимических анализов, обязательно проводят рентгенологические и эндоскопические исследования, а также биопсию. ПЕРЕВАРИВАНИЕ БЕЛКОВ В КИШЕЧНИКЕ Функции тонкой и толстой кишок: 1). завершение переваривания всех компонентов пищи; 2). всасывание образовавшихся соединений; 3). удаление непереваренных продуктов (формирование каловых масс и их эвакуация). 4). экскреторная. (выведение из организма мочевины, мочевой кислоты, креатинина, ядов, лекарственных препаратов, кальция, тяжелых металлов). 5) эндокринная (образование гормонов серотонин; холецистокинин, секретин; мотилин; соматостатин, вазоинтестинальный пептид (ВИП)); 6). защитная (образует защитный барьер от антигенных свойств пищи). 7). метаболическая (синтез витаминов групп В и К с помощью микрофлоры в толстом кишечнике). Размельченные и химически обработанные пищевые массы в смеси с желудочным соком образуют жидкий или полужидкий химус, который поступает в двенадцатиперстную кишку. Переваривание белков происходит в кишечнике под действием пищеварительных соков поджелудочной железы и тонкой кишки. Панкреатический сок Для пищеварения в поджелудочной железе синтезируется сложный по составу сок, который представляет собой бесцветную опалесцирующую жидкость с величиной рН=7,5-8,8. В сутки выделяется 1,5-2,5 литра сока. В состав поджелудочного сока входят вода и сухой остаток (0,12%), который представлен неорганическими и органическими веществами. В соке содержится 5-6г общего белка, катионы Na+ (134-142 мг/л), Ca2+, К+ (4,7-7,4 мг/л), Мg2+ и анионы Cl- (35-97 мг/л), SO32-, HPO42-, особенно много в нем бикарбонатов - 150 ммоль/л. Ферментная часть секрета образуется в ацинарных клетках, а жидкая (водно-электролитная) - муцин и бикарбонаты - в эпителии протоков. В панкреатическом соке содержится большое количество гидролитических ферментов: липаз, фосфолипаз, эстераз, нуклеаз, амилаз, мальтаз и в неактивной форме эндопептидаз (трипсиноген, химотрипсиноген, проколлагеназа, проэластаза) иэкзопептидаз (прокарбоксипептидазы А и В). Активация протеаз в просвете кишечника происходит путём их частичного протеолиза. Трипсиноген превращается в активный трипсин под действием энтеропептидазы эпителия кишечника, которая отщепляет с N-конца трипсиногена гексапептид Вал-(Асп)4-Лиз. Образовавшийся трипсин частичным протеолизом активирует оставшиеся проферменты панкреатических протеаз (проэластаза, проколлагеназа и прокарбоксипептидазы А и В, химотрипсиноген). В результате образуются активные ферменты — эластаза, коллагеназа, карбоксипептидазы А и В, и несколько активных химотрипсинов (π, δ, α). Химотрипсиноген состоит из одной полипептидной цепи, содержащей 245 АК и пяти дисульфидных мостиков. Под действием трипсина расщепляется пептидная связь между 15-й и 16-й аминокислотами, в результате чего образуется активный π-химотрипсин. Далее π-химотрипсин отщепляет дипептид сер(14)-арг(15), что приводит к образованию δ-химотрипсина. δ-химотрипсин отщепляет дипептида тре(147)-арг(148) что приводит к образованию стабильной формы активного фермента — α-химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками. Специфичность действия протеаз Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В — цинксодержащие ферменты, отщепляют аминокислоты с С-конца. Карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В — остатки аргинина и лизина. Поджелудочный сок обеспечивает в просвете кишки полостное переваривание. Ферменты поджелудочной железы гидролизуют полипептиды пищи до олигопептидов и аминокислот. Возрастные особенности панкреатического сока Протеолитическая активность пищеварительного сока поджелудочной железы находится на довольно высоком уровне уже с первых месяцев жизни, достигая максимума к 4-6 годам. Липолитическая активность увеличивается в течение первого года ребенка. Активность поджелудочной амилазы к концу первого года жизни возрастает в 4 раза, достигая максимальных значений к 9 годам. Кишечный сок Кишечный сок является продуктом деятельности всей слизистой оболочки кишечника и представляет собой неоднородную вязкую жидкость, с величиной рН=7,2-8,6 (с усилением секреции рН повышается). За сутки у человека в тонкой кишке выделяется до 2,5л сока, а в толстой кишке - 50-100мл сока. Кишечный сок продуцируется в основном бруннеровыми железами 12-перстной кишки и либеркюновыми железами 12-перстной, тощей и подвздошной кишок. Основной компонент кишечного сока - вода, в которой растворены органические (белки, аминокислоты, промежуточные продукты обмена, слизь) и неорганические (хлориды, бикарбонаты, фосфаты натрия, калия, кальция) компоненты. В кишечном соке содержится более 20 ферментов, гидролизующих углеводы (мальтаза, трегалаза, инвертаза, лактаза, а- и γ-амилазы), белки и их фрагменты (аминопептидазы, трипептидазы, дипептидазы, энтерокиназа), липиды (моноглицеридлипаза, карбоксиэстераза), нуклеазы, фосфатазы и другие гидролазы. Состав кишечного сока меняется в зависимости от пищи. Экзопептидазы (аминопептидазы, три- и дипептидазы) синтезируются кишечником сразу в активной форме, они гидролизуют оставшиеся олигопептиды до аминокислот. Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Лейцинаминопептидаза — Zn2+- или Мn2+-содержащий фермент, обладает широкой специфичностью по отношению к N-концевым аминокислотам. Аланинаминопептидаза. Трипептидазы расщепляют трипептиды на дипептиды и аминокислоты, а дипептиды гидролизуют на аминокислоты дипептидазы. Ферменты кишечного сока функционируют преимущественно в составе гликокаликса щеточной каемки кишечного эпителия, обеспечивая пристеночное и мембранное пищеварение. Защита клеток от действия протеаз Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что: эти ферменты образуются в клетках поджелудочной железы в неактивной форме и активируются только после секреции в просвет кишечника. в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс. В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. РЕГУЛЯЦИЯ ЖЕЛУДОЧНО-КИШЕЧНОЙ СЕКРЕЦИИ Натощак секретируется незначительное количество желудочного сока. Регуляция секреции желудочного сока осуществляется в 3 фазы: 1. Мозговая (сложнорефлекторная) фаза. Осуществляется через комплекс условных и безусловных рефлексов. Вид, запах и вкус пищи активируют нейроны вагуса в центре регуляции желудочной секреции. Окончания вагуса в желудке выделяют ацетилхолин, который через М-холинорецепторы стимулирует синтез желудочного сока (главными, обкладочными и добавочными клетками), а также стимулирует выработку в желудке гормонов гастрина и гистамина; 2. Желудочная (нейро-гуморальная) фаза. Возникает при нахождении пищи в желудке. За счет вагуса, метасимпатической нервной системы, гастрина, гистамина и питательных веществ (белки, пептиды, АК) стимулируется секреция желудочного сока. (Метасимпатическая нервная система (МНС) представляет собой комплекс микроганглиев, расположенных в стенках внутренних органов. МНС координирует и регулирует моторную, секреторную, абсорбционную, эндокринную, иммунную функции полых внутренних органов). 3. Кишечная фаза. При недостаточной обработки пищи из кишечника возникают сигналы, стимулирующие желудочную секрецию (за счет рефлексов местных и центральных, возникающих с рецепторов кишечника и реализующихся через вагус, МСН, гастрин, гистамин). При избытке HCl или чрезмерном разрушении пищевых продуктов, из кишечника возникают сигналы, тормозящие желудочную секрецию (через секретин, холецистокинин, ВИП, ГИП). Гастрин – гормон пептидной природы, производимый G-клетками желудка (гастрин-17 из 17 аминокислот, и гастрин-14 из 14 аминокислот), расположенными в основном в антральном отделе желудка. Секрецию гастрина стимулируют: Ацетилхолин вагуса; белки, продукты гидролиза; бомбензин; инсулин; адреналин (слабо); высокий уровень глюкокортикоидов; гиперкальциемия. Секрецию гастрина угнетают: высокий уровнень HCl в желудке; холецистокинин; секретин; глюкагон; серотонин; ГИП; ВИП; простагландин Е; эндогенные опиоиды — эндорфины и энкефалины; аденозин; кальцитонин; соматостатин (сильно); Эффекты гастрина: Гастрин связывается с гастриновыми рецепторами в желудке и активирует через аденилатциклазную систему синтез желудочного сока: он стимулирует секрецию НС1, пепсиногена, бикарбонатов и слизи в слизистой желудка. Гастрин увеличивает продукцию простагландина E в слизистой желудка, что приводит к местному расширению сосудов, усилению кровоснабжения и физиологическому отёку слизистой желудка и к миграции лейкоцитов в слизистую. Лейкоциты принимают участие в процессах пищеварения, секретируя различные ферменты и производя фагоцитоз. Гастрин тормозит опорожнение желудка, что обеспечивает достаточную для переваривания пищи длительность воздействия соляной кислоты и пепсина на пищевой комок. Рецепторы к гастрину имеются и в тонкой кишке и поджелудочной железе. Гастрин увеличивает секрецию секретина, холецистокинина, соматостатина и ряда других гормонально активных кишечных и панкреатических пептидов, а также секрецию кишечных и панкреатических ферментов. Тем самым гастрин создаёт условия для осуществления следующей, кишечной, фазы пищеварения. Гистамин биогенный амин, образующийся в энтерохромафиноподобных клетках (ECL) при декарбоксилировании аминокислоты гистидина. Секрецию гистамина стимулирует ацетилхолин вагуса, гастрин, ингибирует HCl. Гистамин, через Н2-рецепторы, усиливает секрецию HCl обкладочными клетками. Простогландины вырабатываются покровными эпителиоцитами. Секрецию простогландинов стимулирует HCl, ингибируют глюкокортикоиды. Простогландины стимулируют слизеобразование, секрецию бикарбонатов (нейтрализация рН), усиливают кровообращения в желудке. Серотонин – биогенный амин, образуется в энтерохромафинных эндокриноцитах (ЕС) из 5-окситриптофана. Секрецию серотонина стимулирует HCl. Серотонин стимулирует секреторную (главные и слизистые клетки) и двигательную активность (миоциты) клеток желудка. Соматостатин (пептид) образуется в D-клетках. Соматостатин ингибирует синтез ферментов, гормонов, соляной кислоты, увеличивает скорость всасывания воды и электролитов в тонкой кишке, снижает концентрацию вазоактивных пептидов в крови, уменьшает частоту актов дефекации и массу кала. Пища, поступающая в желудок, стимулирует повышенное образование желудочного сока в течение 4-6 часов. Количество, состав и свойства желудочного сока меняются в зависимости от характера пищи, а также при заболеваниях желудка, кишечника и печени. Наибольшее количество желудочного сока выделяется на белковую пищу, меньше – на углеводную, еще меньше на жирную. Регуляция поджелудочной секреции Регуляция секреции поджелудочного сока осуществляется в 3 фазы: 1. Мозговая (сложнорефлекторная) фаза. Осуществляется через комплекс условных и безусловных рефлексов. Вид, запах и вкус пищи активируют нейроны вагуса в центре регуляции панкреатической секреции. Окончания вагуса в поджелудочной железе выделяют ацетилхолин, который стимулирует синтез панкреатического сока. 2. Желудочная (нейро-гуморальная) фаза. Возникает при нахождении пищи в желудке. За счет вагуса, гастрина, серотонина стимулируется секреция поджелудочного сока. 3. Кишечная фаза. Кислый химус вызывает в кишечнике выделение S-клетками секретина (белковый гормон). Секретин поступают в кровь и стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего много НСО3-, что нейтрализует НС1 желудочного сока и ингибирует пепсин. В результате рН возрастает от 1,5-2,0 до 7,0. Поступление пептидов в тонкий кишечник вызывает секрецию холецистокинина (белкового гормона) в I-клетках, который стимулирует выделение панкреатического сока с большим содержанием ферментов. Регуляция кишечной секреции Регуляция деятельности желез тонкой кишки осуществляется местными нервно-рефлекторными механизмами, а также гуморальными влияниями и ингредиентами химуса. Механическое раздражение слизистой оболочки тонкой кишки вызывает выделение жидкого секрета с малым содержанием ферментов. Местное раздражение слизистой кишки продуктами переваривания белков, жиров, соляной кислотой, панкреатическим соком вызывает отделение кишечного сока, богатого ферментами. Усиливают кишечное сокоотделение ГИП, ВИП, мотилин. Гормоны энтерокринин и дуокринин, выделяемые слизистой оболочкой тонкой кишки, стимулируют соответственно секрецию либеркюновых и бруннеровых желез. Тормозное действие оказывает соматостатин. Мотилин (в Мо-клетках) - стимулирует активность гладко-мышечной клеток кишечника. 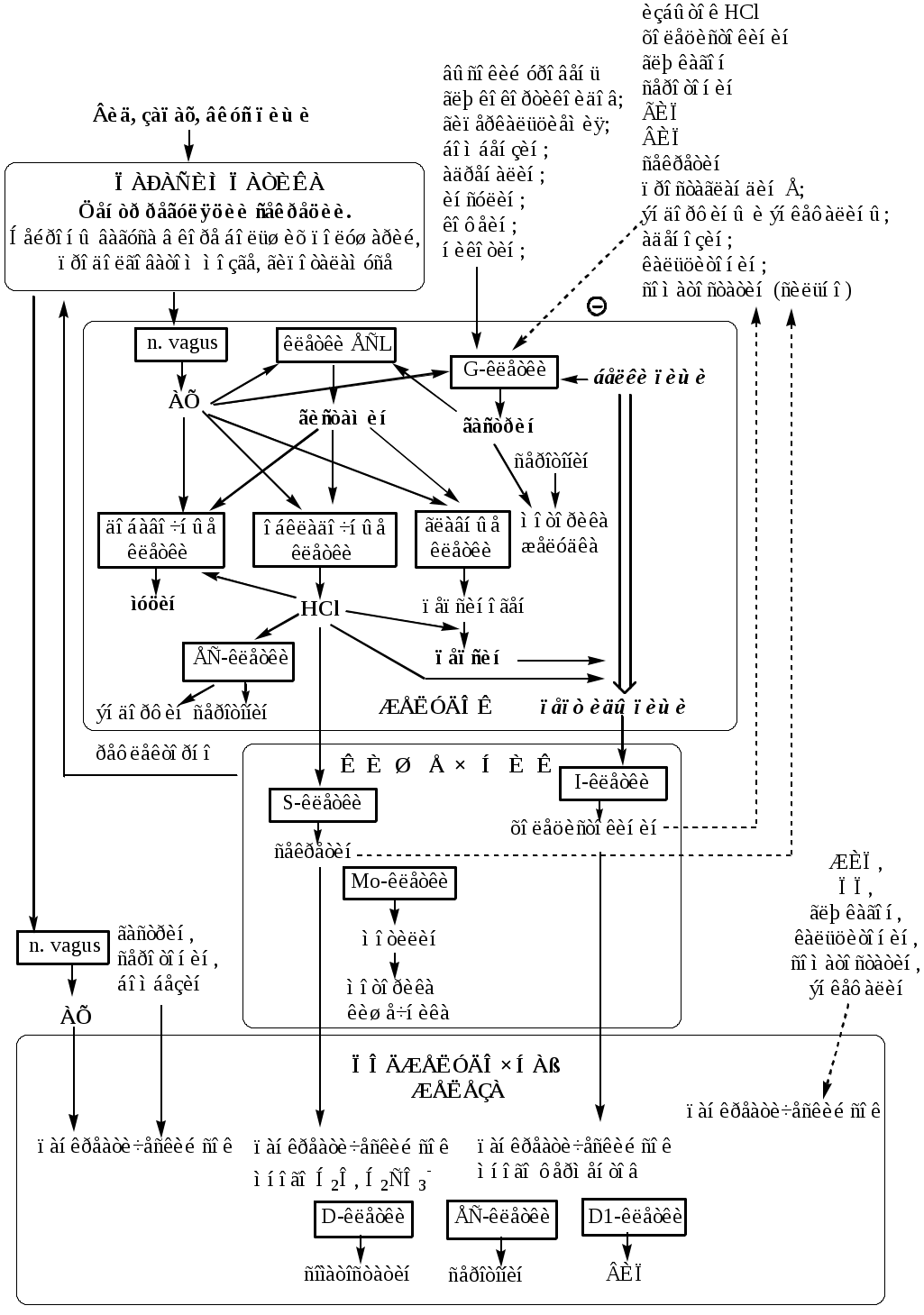 ВСАСЫВАНИЕ АМИНОКИСЛОТ В КИШЕЧНИКЕ Всасывание L-аминокислот (но не D) — активный процесс, в результате которого аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Известно пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот: нейтральных, короткой боковой цепью (аланин, серии, треонин); нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин); с катионными радикалами (лизин, аргинин); с анионными радикалами (глутаминовая и аспарагиновая кислоты); иминокислот (пролин, оксипролин). Существуют 2 основных механизма переноса аминокислот: симпорт с натрием и γ-глутамильный цикл. 1. Симпорт аминокислот с Na+. Симпортом с Nа+ переносятся аминокислоты из первой и пятой группы, а также метионин. 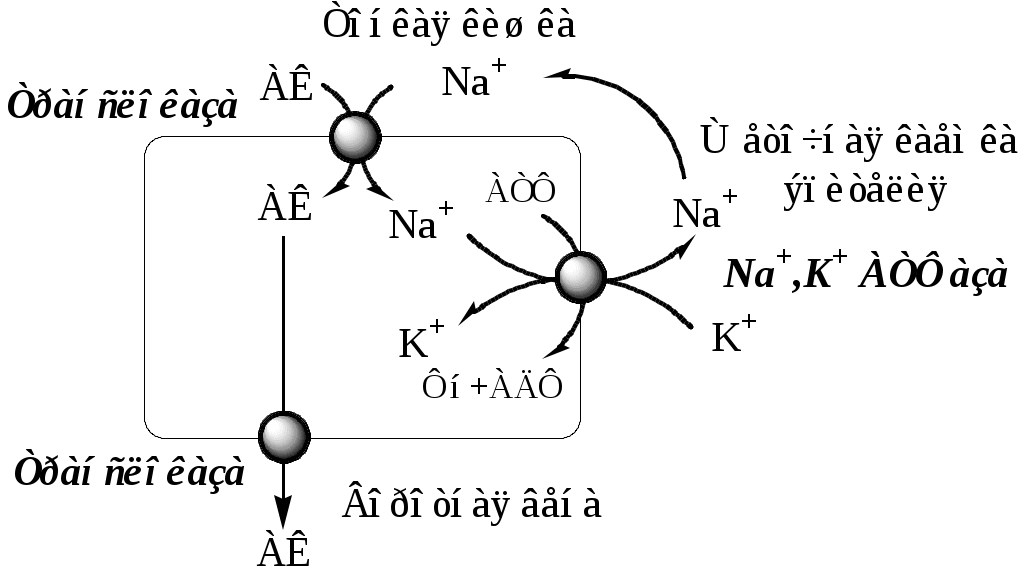 L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Na+, К+-АТФ-азы. 2. γ-Глутамильный цикл. γ-глутамильный цикл переносит некоторые нейтральные аминокислоты (фенилаланин, лейцин) и аминокислоты с катионными радикалами (лизин) в кишечнике, почках и, по-видимому, мозге. В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные — в цитозоле. Мембранно-связанный фермент γ-глутамилтрансфераза (гликопротеин) катализирует перенос γ-глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Амнокислота отщепляется от у-глутамильного остатка под действием фермента у-глутамилциклотрансферазы. Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты — цистеин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием у-глутамильного цикла затрачиваются 3 молекулы АТФ. 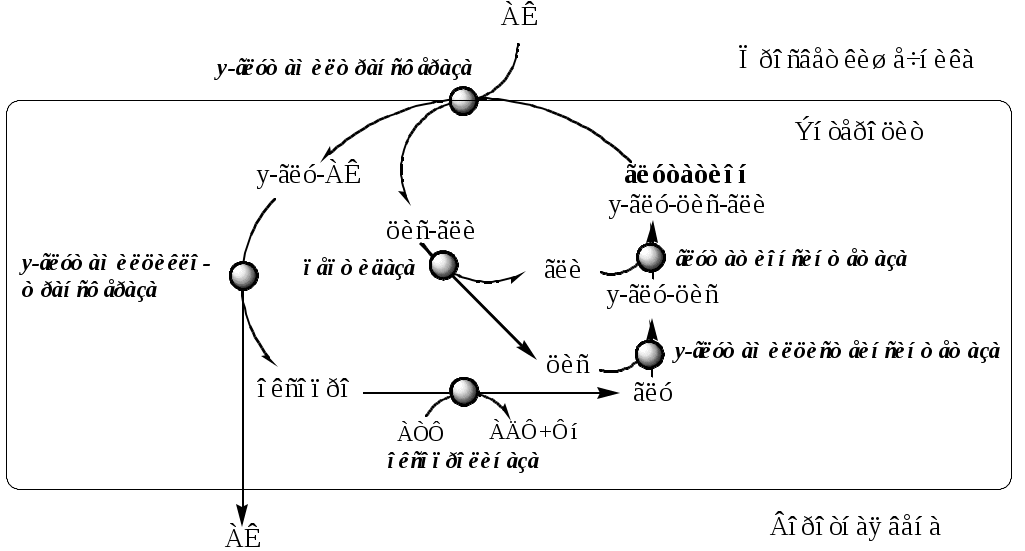 Поступление аминокислот в организм осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30—50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Аминокислоты при всасывании конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина. НАРУШЕНИЕ ПЕРЕВАРИВАНИЯ БЕЛКОВ И ТРАНСПОРТА АМИНОКИСЛОТ Непереносимость белков пищи (например, молока и яиц) у взрослых людей. В норме у взрослых людей из кишечника кровь попадают только лишенные антигенных свойств аминокислоты. Однако, у некоторых людей происходит всасывание в ЖКТ недопериваренных пептидов, антигенные свойства которых вызывают иммунные реакций. У новорожденных проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь поступают белки (антитела) молозива, необходимые для создания пассивного иммунитета. Процесс облегчается наличием в молозиве белка — ингибитора трипсина и низкой активностью протеолитических ферментов новорождённых. При заболевании целиакии(нетропической спру) происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену — белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Цистинурия, болезнь Хартнапа и некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы. При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт аминокислот в ткани и их метаболизм в клетках. 4. «Гниение» белков в кишечнике. Роль УДФ-глюкуроновой кислоты и ФАФС в процессах обезвреживания и выведения продуктов «гниения» (фенол, индол, скатол, индоксил и др.). ГОУВПО УГМА Федерального агентства по здравоохранению и социальному развитию кафедра биохимии Утверждаю Зав. каф. проф., д.м.н. Мещанинов В.Н. _____‘’_____________2006 г ЛЕКЦИЯ № 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
