Лекции по белкам биохимия 2005. Кафедра биохимии
 Скачать 1.2 Mb. Скачать 1.2 Mb.
|
| ||||||||||||||||||||||||||||||||||||||||||
| Аминокислоты (АК) – органические соединения, содержащие –СООН и -NH2 в α-положении. Почти все АК имеют хиральный атом и обладают оптической изомерией. У человека присутствуют L-аминокислоты. | 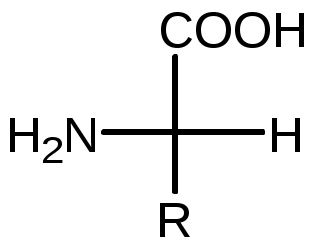 |
Всего известно около 300 видов АК, у человека в организме - 70, а в составе белков - 20.
Физико-химические свойства аминокислот
АК белые кристаллические вещества, хорошо растворимые в воде. Имеют высокую температуру плавления, в твердом состоянии находятся в виде внутренней соли. Многие сладкие на вкус (гли).
АК амфотерные вещества – проявляют свойства кислот и оснований. К наиболее важным общим реакциям АК относятся реакции декарбоксилирования, переаминирования, дезаминирования, образование пептидных связей и оснований Шиффа (при гликозилировании белков). Специфические реакции АК связаны с наличием функциональных групп в радикале (окислительно-восстановительные реакции цис).
Существует несколько классификаций аминокислот.
Классификация АК по природе радикала: 1). алифатические (гли, ала, вал, лей, иле и.т.д.); 2). ароматические (фен, тир, три, гис); 3). гетероциклические (про, оксипро).
Классификация АК по количеству карбоксильных и аминогрупп: 1). нейтральные; 2). кислые (глу, асп); 3) основные (арг, лиз).
Классификация АК по функциональным группам в радикале: 1). содержащие –ОН (сер, тре); 2). содержащие –SH (цис, мет); 3). содержащие –СОNH2 (глн, асн);
Классификация АК по способности к синтезу:
АК, которые синтезируются в организме, называют заменимыми (глицин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, серии, пролин, аланин).
АК, которые не синтезируются в организме, но для него необходимы, называются незаменимыми (фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин).
Аргинин и гистидин - частично заменимыеАК, у взрослых они образуются в достаточных количествах, а у детей - нет. Поэтому, необходимо дополнительное поступление этих АК с пищей.
Тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые АК (фенилаланин и метионин).
Функции аминокислот
Используются для синтеза белков, углеводов, липидов, нуклеиновых кислот, биогенных аминов (гормонов, нейромедиаторов), других аминокислот
Служат источником азота при синтезе всех азотсодержащих небелковых соединений (нуклеотиды, гем, креатин, холин и др);
Выполняют регуляторную функцию (гли, глу - нейромедиаторы);
служат источником энергии для синтеза АТФ.
ПУТИ ОБРАЗОВАНИЯ ПУЛА АМИНОКИСЛОТ В КРОВИ
И ЕГО ИСПОЛЬЗОВАНИЕ В ОРГАНИЗМЕ
Большая часть аминокислот организма человека, примерно 15кг, входит в состав белков. Фонд свободных АК организма составляет примерно 35г.
Источниками АК в организме являются белки пищи, белки тканей и синтез АК из углеводов. В сутки у человека распадается на АК около 400г белков, примерно такое же количество синтезируется. Специальной формы депонирования АК, подобно глюкозе (в виде гликогена) или жирных кислот (в виде ТГ), не существует. Поэтому резервом АК служат все белки тканей, но преимущественно белки мышц (т.к. их много).

ОБЩИЕ РЕАКЦИИ ОБМЕНА АМИНОКИСЛОТ
АК, появившиеся в организме, включаются в общие и специфические реакции обмена.
К общим реакциям обмена АК относят реакции трансаминирования, дезаминирования и декарбоксилирования, биосинтеза белков и рацемизации (L переходы D).
ТРАНСАМИНИРОВАНИЕ (ПЕРЕАМИНИРОВАНИЕ) АМИНОКИСЛОТ
Трансаминирование — реакция переноса α-аминогруппы с АК на α-кетокислоту, в результате чего образуются новая α-кетокислота и новая АК. Процесс трансаминирования легко обратим, при нем общее количество АК в клетке не меняется.
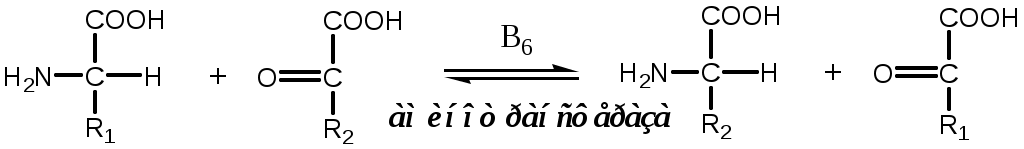
| Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина). |  |
У человека найдено более 10 аминотрансфераз, которые локализуются в цитоплазме и митохондриях клеток. В реакции трансаминирования вступают почти все АК, за исключением лизина, треонина и пролина.
Механизм переаминирования

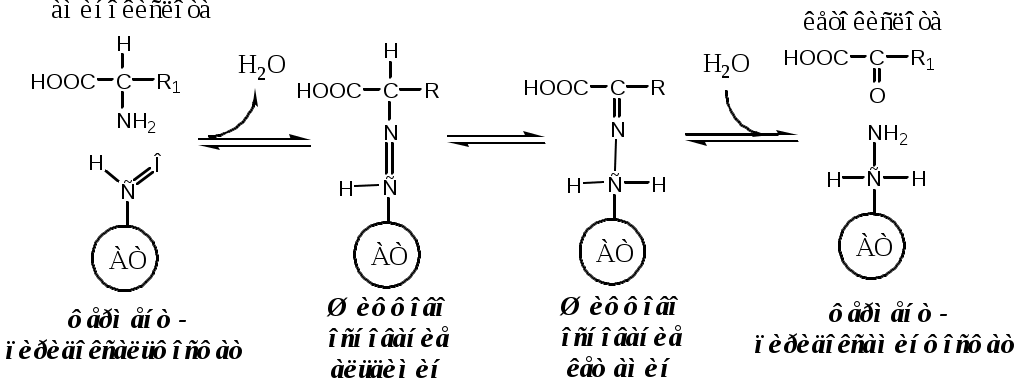
Вначале, АК передает свою аминогруппу на пиродоксальфосфат. АК при этом превращается в кетокислоту, а пиродоксальфосфат - в пиридоксаминфосфат.
Затем, реакции идут в обратную сторону: но уже другая кетокислота, принимает аминогруппу от пиридоксаминфосфата и превращается в новую АК, а пиридоксаминфосфат в пиродоксальфосфат.
Органоспецифичные аминотрансферазы АЛТ и АСТ
Чаще всего в трансаминировании участвуют АК и кетокислоты, которых много в организме — глу, ала, асп, α-КГ, ПВК и ЩУК. Основным донором аминогруппы служит глу, а кетогруппы - α-КГ.
Наиболее распространёнными аминотрансферазами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT).
АЛТ катализирует реакцию трансаминирования между ала и α-КГ: ала+α-КГ↔ПВК+глу АЛТ локализуется в цитозоле клеток многих органов, больше всего ее в клетках печени и миокарде.
ACT катализирует реакцию трансаминирования между асп и α-КГ: асп+α-КГ↔ЩУК+глу
ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее ее количество обнаружено в миокарде и печени.
АСТ и АЛТ являются органоспецифичными ферментами, их определяют в крови для диагностики заболеваний печени, сердца и, в меньшей степени, скелетных мышц. Соотношение активностей АСТ/АЛТ называют «коэффициент де Ритиса». В норме он равен 1,33±0,42.
При инфаркте миокарда активность ACT в крови увеличивается в 8—10 раз, а АЛТ — в 1,5—2,0 раза, коэффициент де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в - 8—10 раз по сравнению с нормой, a ACT — в 2—4 раза. Коэффициент де Ритиса снижается до 0,6.
Биологическое значение трансаминирования
Реакции трансаминирования обеспечивают синтез и распад амино- и кетокислот, перераспределение аминного азота в тканях организма.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
Дезаминирование АК — реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака.
Дезаминирование бывает прямым и непрямым.
Прямое дезаминирование АК
Прямое дезаминирование - это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис.
Существует 5 видов прямого дезаминирования АК:
окислительное;
неокислительное;
внутримолекулярное;
восстановительное;
гидролитическое.
Окислительное дезаминирование - самый активный вид прямого дезаминирования АК.
1. Глутаматдегидрогеназа (глу-ДГ) - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом).
Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминирование α-кетоглутарата).
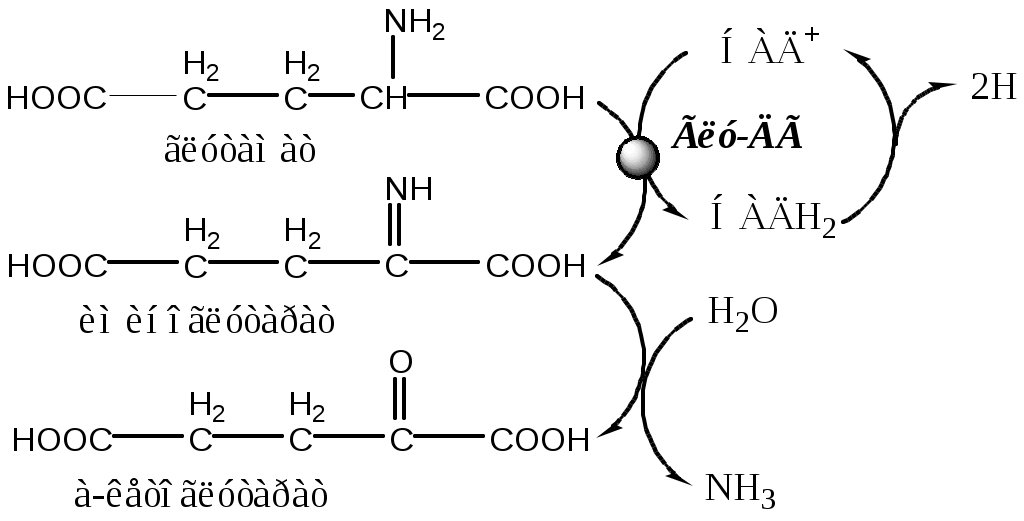
Глу + НАД+ + Н2О ↔ α-КГ + НАДН2 + NH3
2. Оксидаза L-аминокислот
В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:
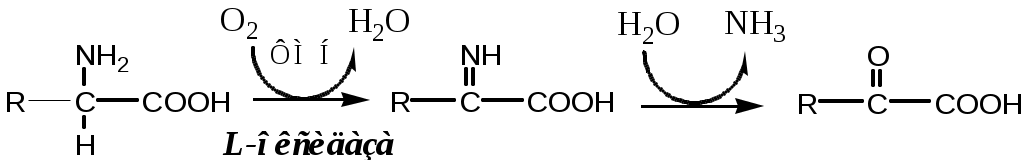
Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен.
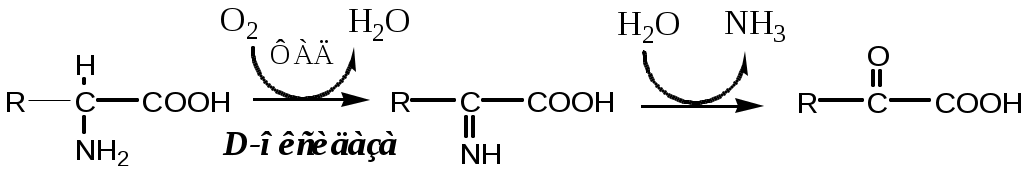
3. Оксидаза D-аминокислот
Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
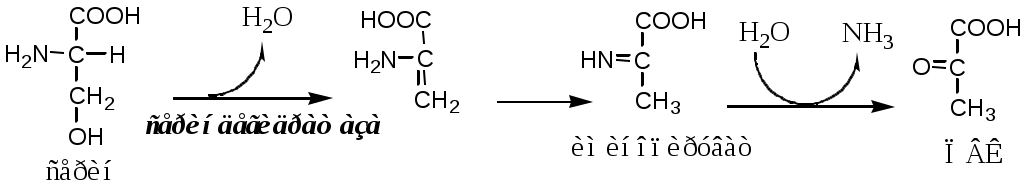
Неокислительное дезаминирование
В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина.
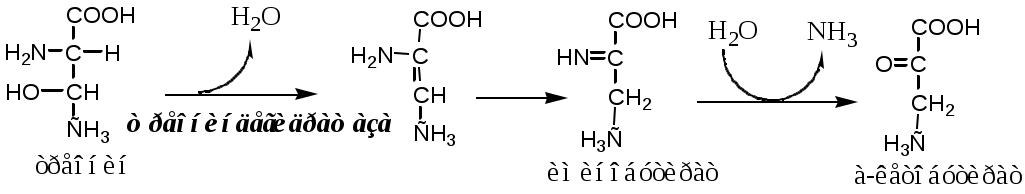
Внутримолекулярное дезаминирование
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.
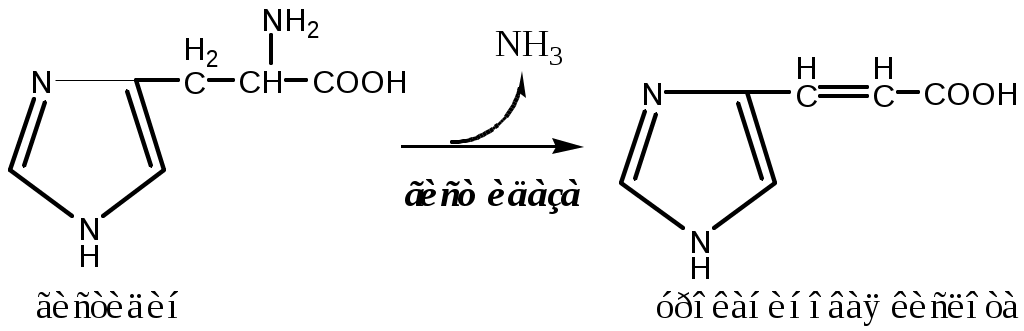
Непрямое дезаминирование (трансдезаминирование) АК
Непрямое дезаминирование - это дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно характерно для большинства АК, так как они не способны к прямому дезаминированию (нет ферментов).
На первой стадии происходит одна и несколько реакций переаминирования с участием аминотрансфераз, в результате аминогруппа АК переходит на кетосоединение (α-КГ, ИМФ).
На второй стадии происходит реакция дезаминирования аминосоединения (глу, АМФ), в результате чего образуется аммиак.
Последовательность реакций непрямого дезаминирования зависит от набора ферментов в тканях.
Непрямое дезаминирование в печени
Непрямое дезаминирование АК происходит при участии 2 ферментов: аминотрансферазы и глу-ДГ. Аминогруппы АК в результате трансаминирования переносятся на α-КГ с образованием глутамата, который затем подвергается прямому окислительному дезаминированию.
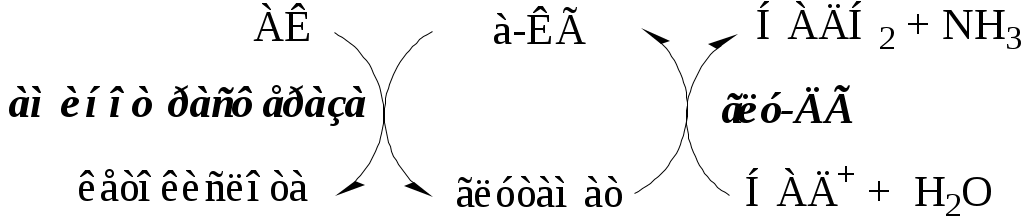
Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм АК, так и возможность образования практически любой АК из соответствующей α-кетокислоты.
При энергодефиците АДФ активирует Глу-ДГ, что усиливает катаболизм АК и образование а-кетоглутарата, поступающего в ЦТК как энергетический субстрат.
Таким образом, Глу-ДГ играет ключевую роль в регуляции обмена АК и энергии.
Непрямое дезаминирование в мышцах (и нервной ткани)
В мышечной ткани активность глу-ДГ низка, поэтому при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ.

Можно выделить 4 стадии этого процесса:
трансаминирование с а-кетоглутаратом, образование глутамата (аминотрансфераза);
трансаминирование глутамата с ЩУК, образование аспартата (АСТ);
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата (аденилосукцинасинтаза и аденилосукцинатлиаза);
гидролитическое дезаминирование АМФ (АМФ-дезаминаза).
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
Пути обмена безазотистого остатка аминокислот
За сутки у человека распадаются примерно 100г АК. Катаболизм всех АК сводится к образованию шести веществ, вступающих в общий путь катаболизма: ПВК, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат и ЩУК. Эти вещества окисляются в ЦТК для образования АТФ или используются для синтеза глюкозы и кетоновых тел.
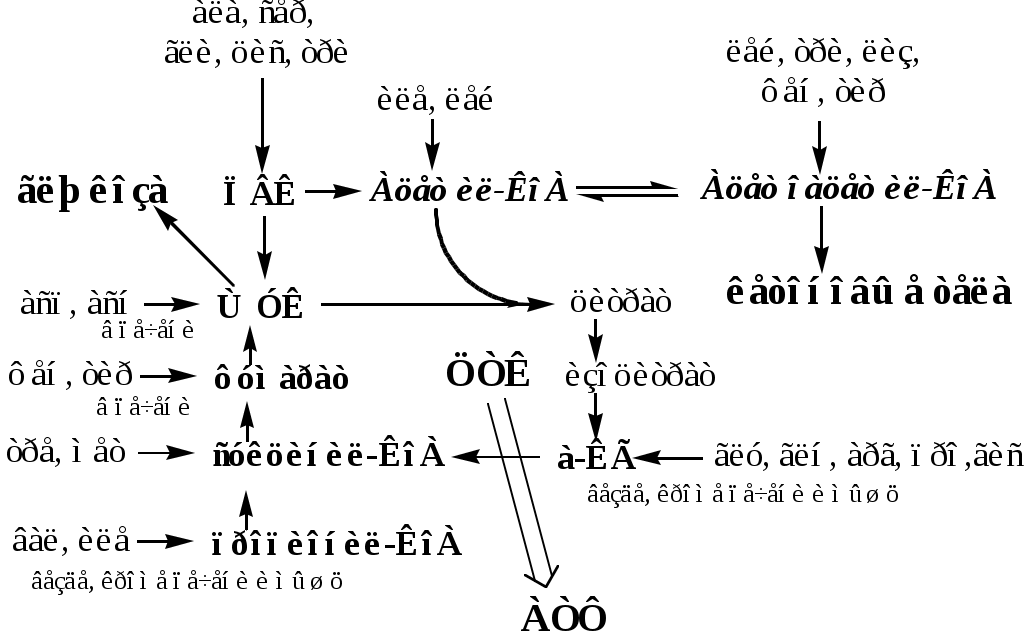
Гликогенные аминокислоты - АК, которые превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). Они через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре).
Кетогенные аминокислоты – АК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел.
Смешанные (глико-кетогенными) аминокислоты – АК, при катаболизме которых образуются метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Эти АК используются для синтеза глюкозы и кетоновых тел.
ОБМЕН АММИАКА
Аммиак в организме образуется:
при дезаминировании АК во всех тканях (много);
при дезаминировании биогенных аминов и нуклеотидов во всех тканях (мало);
при дезаминировании АМФ в интенсивно работающей мышце;
при гниении белков в кишечнике.
Концентрация аммиака
Концентрация аммиака в сыворотке крови в норме 11—35 мкмоль/л. В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония — NH4+, количество неионизированного NH3 невелико ( 1%).
Токсичность аммиака
Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и, прежде всего на ЦНС.
Механизм токсического действия аммиака:
Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глу-ДГ, в сторону образования глу:
α-Кетоглутарат + НАДH2 + NH3 → глу + НАД+.
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение реакции трансаминирования АК и снижение синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
снижения скорости ЦТК и развитие энергодефицита.
Недостаточность α-кетоглутарата ускоряет реакции синтеза ЩУК из ПВК, сопровождающейся интенсивным потреблением СО2 (особенно характерны для клеток головного мозга).
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону, вызывает алкалоз. Алкалоз увеличивает сродство гемоглобина к кислороду, что препятствует отдачи им кислорода. В результате развивается гипоксия тканей, энергодефицит, от которого главным образом страдает головной мозг.
Высокие концентрации аммиака, при участии глутаминсинтетазы, стимулируют синтез глутамина из глутамата в нервной ткани:
Глу + NH3 + АТФ → Глн + АДФ + Н3РО4. Накопление глн в клетках нейроглии приводит к повышению в них осмотического давления, набуханию астроцитов и в больших концентрациях вызвает отёк мозга. Снижение концентрации глу нарушает обмен АК и нейромедиаторов, в частности синтез γ-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток NH4+ в крови нарушает трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Низкие концентрации аммиака стимулируют дыхательный центр, а высокие – угнетают.
Связывание (обезвреживание) аммиака
В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза.
Обмен глутамата
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию.
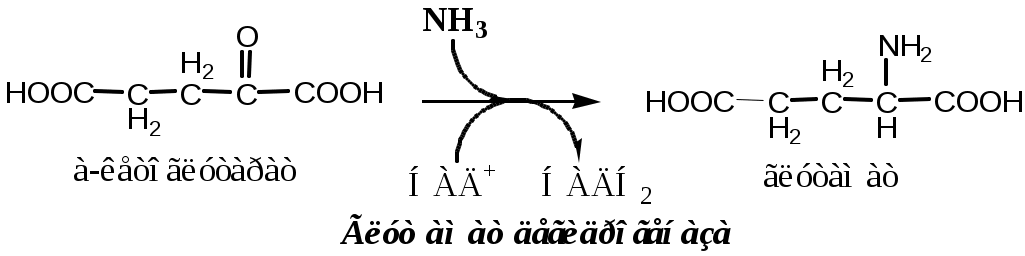
Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Обмен глутамина
Основной реакцией связывания аммиака, протекающей во всех тканях организма (основные поставщики мышцы, мозг и печень), является синтез глутамина под действием глутаминсинтетазы:
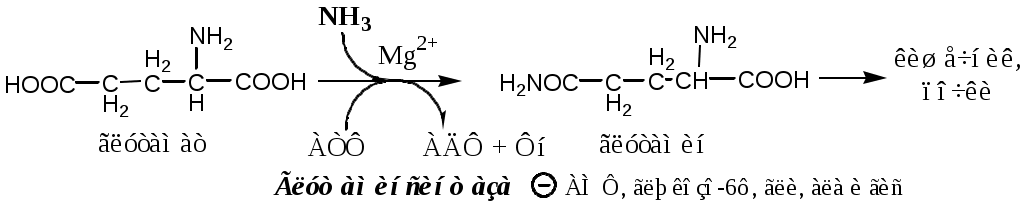
Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы Mg2+, является одним из основных регуляторных ферментов обмена АК. Она аллостерически ингибируется АМФ, глюкозо-6ф, гли, ала и гис.
Глутамин, путём облегчённой диффузии, легко проходит клеточные мембраны (для глутамата возможен только активный транспорт), поступает из тканей в кровь и транспортируется в кишечник и почки.
В почках происходит гидролиз глутамина под действием глутаминазы с образованием аммиака:
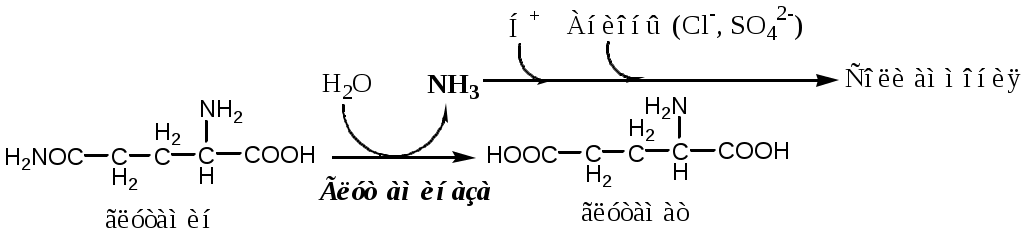
Аммиак с протонами и анионами образует соли аммония (0,5 г/сут), которые выделяются с мочой. Этот процесс используется для регуляции КОС и сохранения в организме важнейших катионов Na+ и К+. Глутаминаза почек значительно индуцируется при ацидозе, ингибируется при алкалозе.
В клетках кишечника также под действием глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
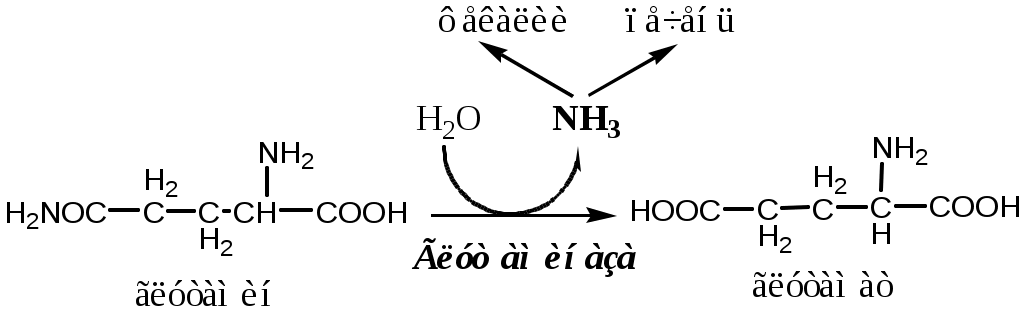
Образовавшийся аммиак поступает через воротную вену в печень или удаляется из организма с фекалиями.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин — основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений.
Обмен аспарагина
Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой аспарагинсинтетазы.
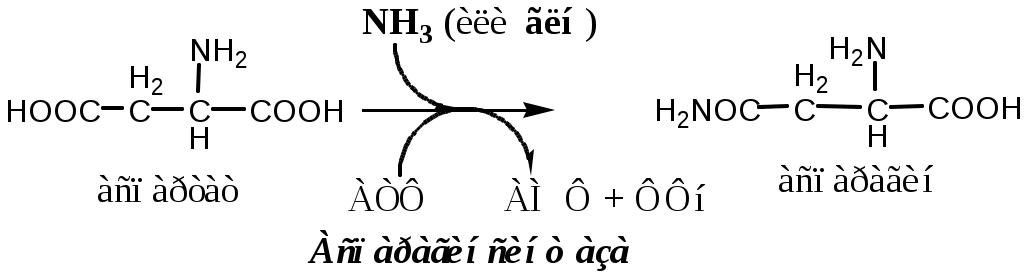
Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных.
Обмен аланина
Из мышц и кишечника избыток аминого азота выводится преимущественно в виде аланина.
В кишечнике:
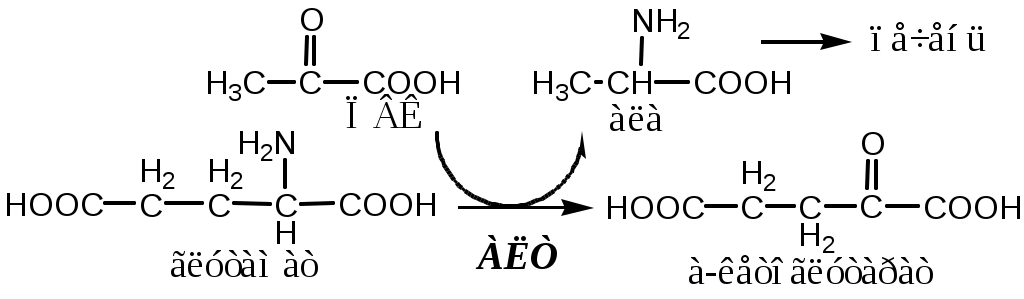
Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из кишечника в кровь воротной вены и поглощается печенью.
В мышцах:
Образование аланина в мышцах, его перенос в печень связан с обратным переносом в мышцы синтезированной в печени глюкозы. Этот процесс называется глюкозо-аланиновый цикл:
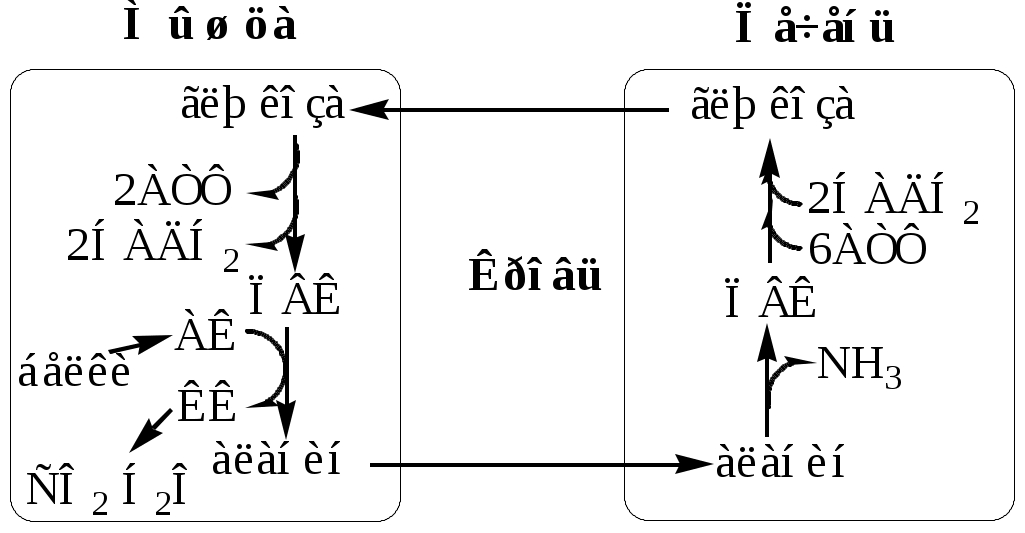
Он необходим, так как активность глу-ДГ в мышцах невелика и непрямое дезаминирование АК малоэффективно.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада АК. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак идет на синтез мочевины, а ПВК включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до ПВК.
ОРНИТИНОВЫЙ ЦИКЛ
Большая часть свободного аммиака, а также аминного азота в составе АК (в основном глутамин, аланин) поступают в печень, где из них синтезируется нетоксичное и хорошо растворимое в воде соединение — мочевина. Мочевина является основной формой выведения азота из организма человека.
Синтез мочевины происходит в цикле, который замыкается орнитином. Цикл открыли в 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт.
Мочевина (карбамид) — полный амид угольной кислоты — содержит 2 атома азота, один из аммиака, другой – из асп.
Реакции орнитинового цикла
Предварительно в митохондриях под действием карбамоилфосфатсинтетазы I с затратой 2 АТФ аммиак связывается с СО2 с образованием карбамоилфосфата:
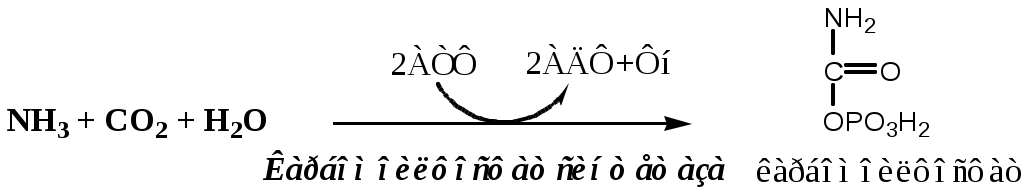
(Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов).
1. В митохондриях орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется — цитруллин:
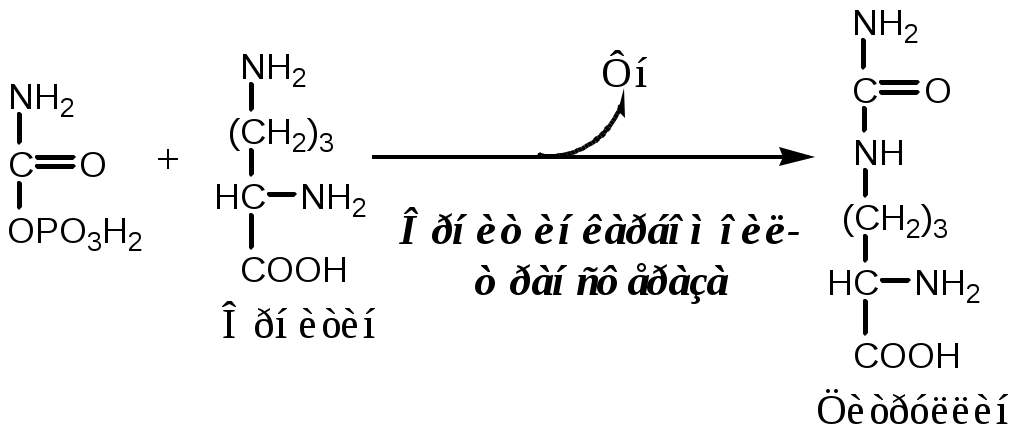
2. В цитозоле аргининосукцинатсинтетаза с затратой 1 АТФ (двух макроэргических связей) связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарная кислота). Фермент нуждается в Mg2+. Аспартат — источник второго атома азота мочевины.
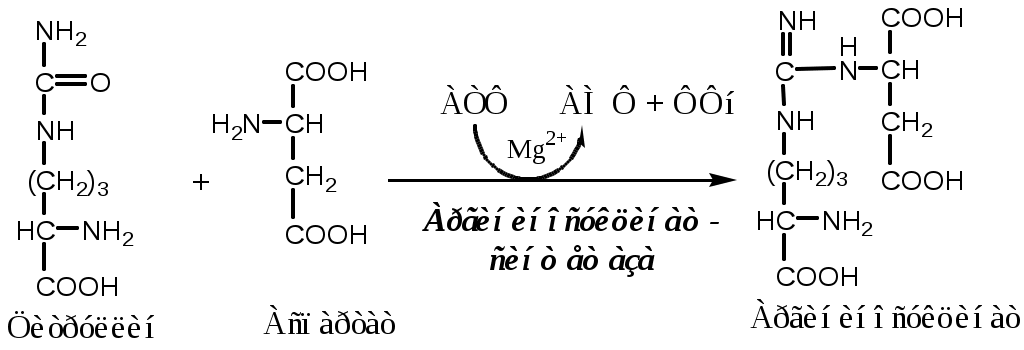
3. В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).
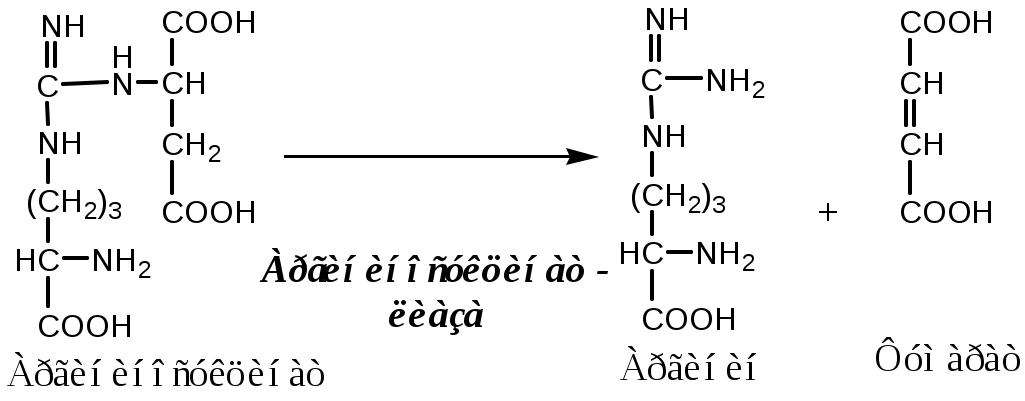
4. В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+, ингибиторы - высокие концентрации орнитина и лизина.
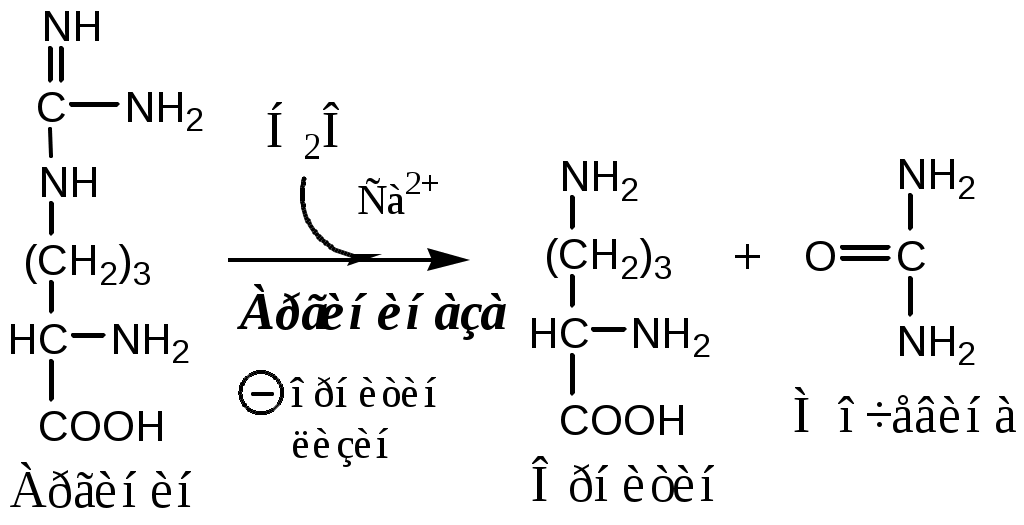
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Регенерация аспартата из фумарата
Фумарат, образующийся в орнитиновом цикле, в цитозоле превращается в ЩУК, который переаминируется с аланином или глутаматом с образованием аспартата. Аланин поступает главным образом из мышц и клеток кишечника:
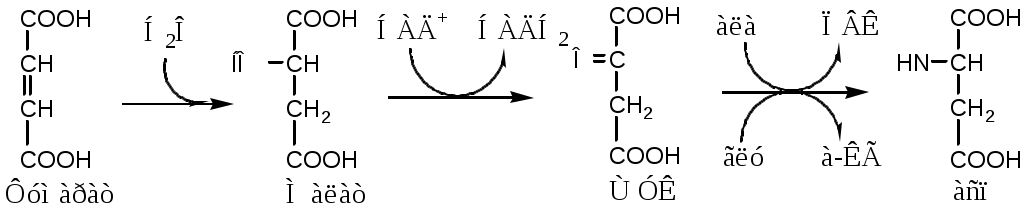
Малат может направиться в митохондрии и включиться в ЦТК.
Пируват, образующийся в этих реакциях из аланина, используется для глюконеогенеза.
Общее уравнение синтеза мочевины:
CO2 + NH3 + асп + 3 АТФ + 2 Н2О → мочевина + фумарат + 2АДФ + АМФ + 2Фн + ФФн
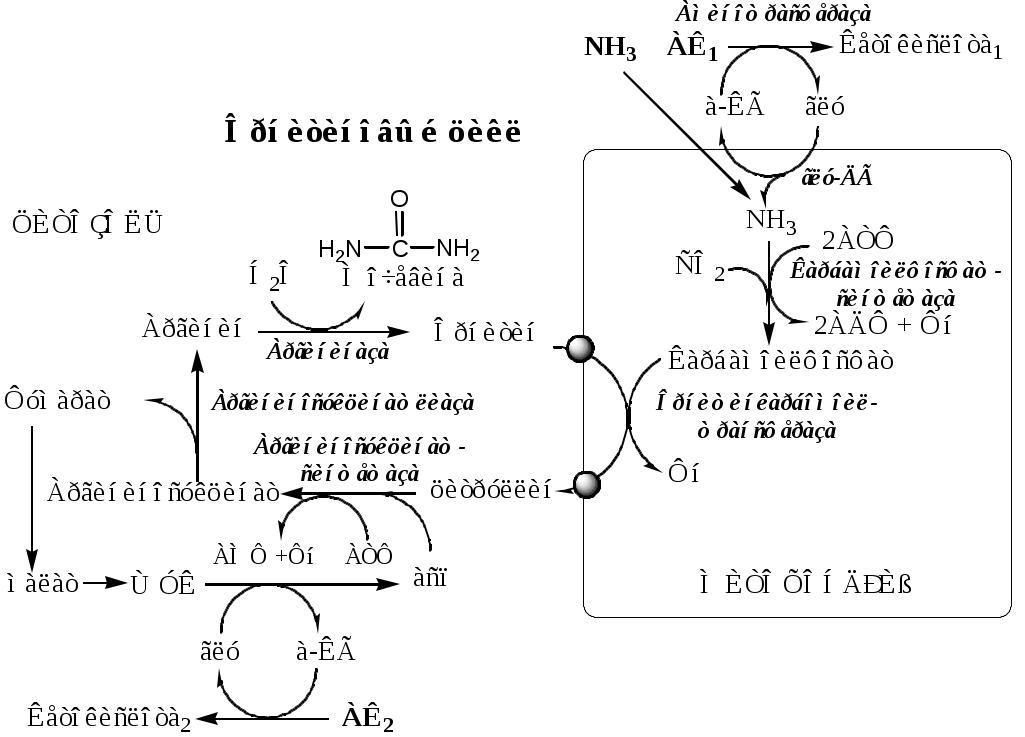
Энергетический баланс орнитинового цикла
На синтез 1 мочевины расходуются 4 макроэргических связи 3 АТФ. Дополнительные затраты энергии связаны с трансмембранным переносом веществ и экскрецией мочевины. Энергозатраты при этом частично компенсируются:
при окислительном дезаминировании глутамата образуется 1 молекула НАДН2, которая обеспечивает синтез 3 АТФ;
в ЦТК, при превращении малата в ЩУК образуется еще 1 молекула НАДН2, которая также обеспечивает синтез 3 АТФ;
Орнитиновый цикл в печени выполняет 2 функции:
превращение азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
синтез аргинина и пополнение его фонда в организме.
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются в разных тканях. В энтероцитах, есть карбамоилфосфатсинтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках есть аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени.
Выделение азота из организма
Азот выводиться из организма с мочой, калом, потом и с выдыхаемым воздухом в виде различных соединений. Основная масса азота выделяется из организма с мочой в виде мочевины (до 90%). В норме соотношение азотсодержащих веществ в моче составляет: мочевина 86%, креатинин 5%, аммиак 3%, мочевая кислота 1,5% и другие вещества 4,5%. Экскреция мочевины в норме составляет 25 г/сут, солей аммония 0,5 г/сут.
ГИПЕРАММОНИЕМИЯ
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм.
Причинами гипераммониемии могут быть:
генетические дефекты ферментов орнитинового цикла в печени;
вторичное поражение печени в результате цирроза, гепатита или других заболеваний.
Известны пять наследственных заболеваний, обусловленные дефектом пяти ферментов орнитинового цикла.
Наследственные нарушения орнитинового цикла и их основные проявления
| Заболевание | Дефект фермента | Тип наследования | Клинические проявления | Метаболиты | |
| кровь | моча | ||||
| Гиперам-мониемия, тип I | Карбамоил-фосфат-синтетаза I | Аутосомно-рецессивный | В течение 24-48 ч после рождения кома, смерть | Глн Ала NH3 | Оротат |
| Гиперам-мониемия, тип II | Орнитин-карбамоил-трансфераза | Сцепленный с Х-хромосомой | Гипотония, снижение толерантности к белкам | Глн Ала NH3 | Оротат |
| Цитрул-линемия | Аргинино-сукцинат-синтетаза | Аутосомно-рецессивный | Гипераммониемия тяжёлая у новорождённых. У взрослых — после белковой нагрузки | Цитруллин NH3 | Цитруллин |
| Аргинино-сукцина-турия | Аргинино-сукцинатлиаза | Аутосомно-рецессивный | Гипераммониемия, атаксия, судороги, выпадение волос | Аргини-носукцинат NH3 | Аргини-носукци-нат, Глн, Ала, Лиз |
| Гиперар-гининемия | Аргиназа | Аутосомно-рецессивный | Гипераргининемия | Apг NH3 | Apг Лиз Орнитин |
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
При гипераммониемиях I и II типа происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой.
Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака (до 6000 мкмоль/л),глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
тошнота, повторяющаяся рвота;
головокружение, тремор, судорожные припадки;
нечленораздельная речь;
потеря сознания, отёк мозга (в тяжёлых случаях);
отставание умственного развития (при хронической врождённой форме).
В тяжёлых случаях развивается кома с летальным исходом.
Все симптомы гипераммониемии — проявление действия аммиака на ЦНС.
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени.
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов АК в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
путём связывания и выведения NH3 в составе фенилацетилглутамина и гиппуровой кислоты. Пищевой фенилацетат при конъюгации с глутамином образует фенилацетилглутамин, а пищевой бензоат при конъюгации с глицином образует гиппуровую кислоту, которые потом выводится с мочой;
повышением концентрации промежуточных метаболитов цикла (аргинина, цитруллина, глутамата), образующихся вне блокируемых реакций. Введение больших доз цитруллина стимулирует синтез мочевины из аспартата. Большие дозы аргинина стимулируют регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
Обмен аминокислот и аммиака между тканями
Печень
В печень азот поступает в основном в виде аммиака, глутамина, аланина, а меньше в виде других АК в основном из мышц и кишечника. Поглощает АК с разветвленной цепью (вал, лей, иле). Синтезирует глюкозу в основном из аланина и серина.
Мышцы
Поглощают АК с разветвленной цепью (вал, лей, иле). Выделяют много аланина и глутамина меньше других АК.
Кишечник
Поглощает глутамин. Выделяет много аланина. С пищей из кишечника поступают все аминокислоты.
Мозг
Поглощает много АК с разветвленной цепью (вал, лей, иле). Выделяет много глутамина.
Почки
Поглощают глутамин. Выделяют много серина и немного аланина.
ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ
Некоторые АК и их производные могут подвергаться декарбоксилированию – отщеплению α-карбоксильной группы. У млекопитающих декарбоксилируются: три, тир, вал, гис, глу, цис, арг, орнитин, SAM, ДОФА, 5-окситриптофан и т.д. Реакцию необратимо катализируют декарбоксилазы, которые содержат в активном центре пиридоксальфосфат. Механизм реакции похож на реакцию переаминирования.
Продуктами реакции являются СО2 и биогенные амины, выполняющие регуляторные функции (гормоны, тканевые гормоны, нейромедиаторы).
Серотонин
Серотонин образуется из три в надпочечниках, ЦНС и тучных клетках.
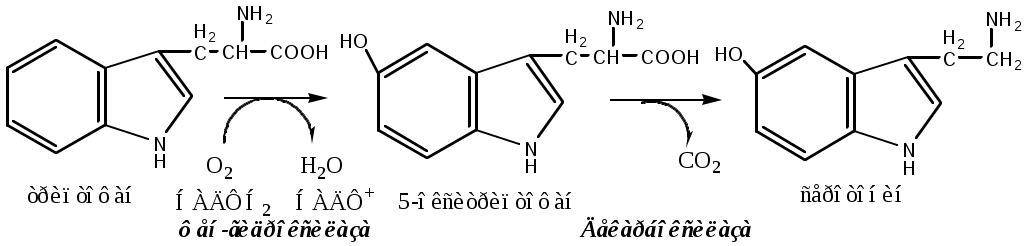 Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.ГАМК
ГАМК образуется и разрушается в ГАМК-шунте ЦТК в высших отдела мозга. Он имеет очень высокую концентрацию.
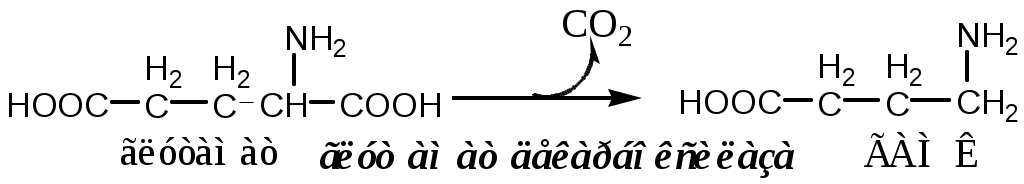
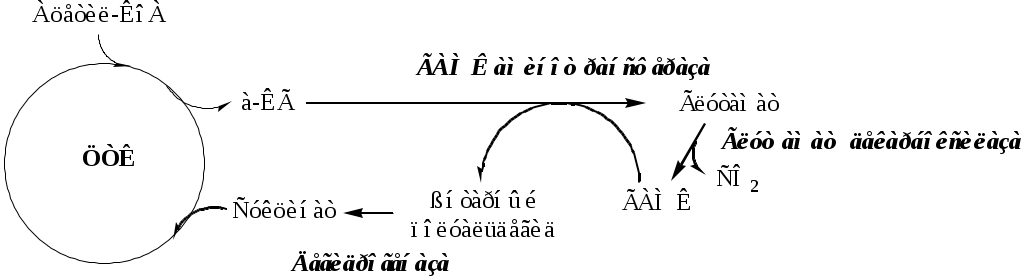
ГАМК – тормозной нейромедиатор (повышает проницаемость постсинаптических мембран для К+), повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга.
Гистамин
Гистамин образуется в тучных клетках. Секретируется в кровь при повреждении ткани, развитии иммунных и аллергических реакций.
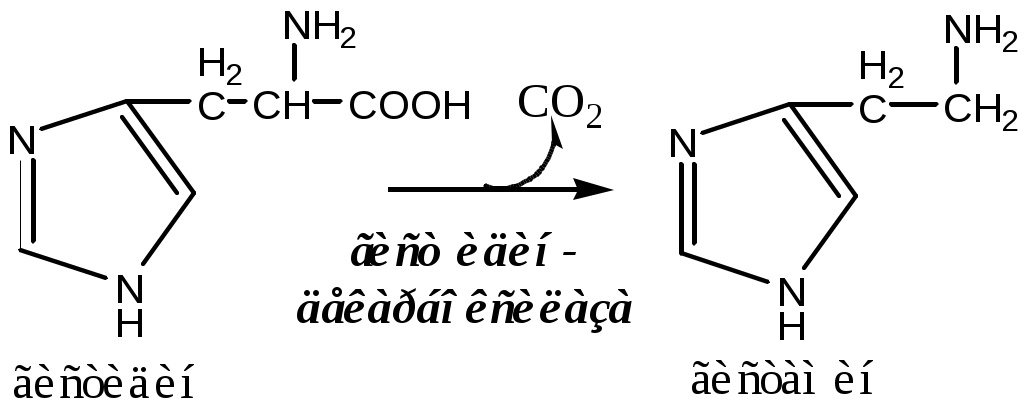
Гистамин – медиатор воспаления, аллергических реакций, пищеварительный гормон:
стимулирует секрецию желудочного сока, слюны;
повышает проницаемость капилляров, расширение сосудов, покраснение кожи, вызывает отеки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
сокращает гладкую мускулатуру легких, вызывает удушье;
вызывает аллергическую реакцию;
нейромедиатор;
медиатор боли.
Дофамин
Дофамин образуется (фен → тир → ДОФА → дофамин) в мозге и мозговом веществе надпочечников.
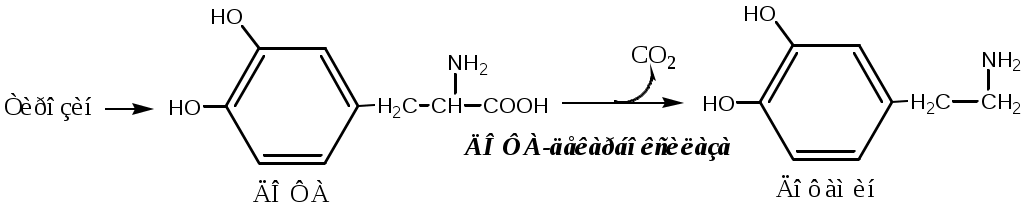
Дофамин – нейромедиатор среднего отдела мозга.
ГОУВПО УГМА Федерального агентства по здравоохранению и социальному развитию
кафедра биохимии
Утверждаю
Зав. каф. проф., д.м.н.
Мещанинов В.Н.
_____‘’_____________2006 г
ЛЕКЦИЯ № 19
