отчет по химии. Кафедра фундаментальной и прикладной химии Лабораторная работа Приготовление растворов заданной концентрации Отчет
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования Новгородский государственный университет имени Ярослава Мудрого Кафедра фундаментальной и прикладной химии Лабораторная работа Приготовление растворов заданной концентрации Отчет Работу выполнил студент: Моисеев Максим Денисович группа 1013 «13» Октября 2021г. Работу проверил преподаватель: Телешова Е.Н. ________________________ «___»____________2021_г. Великий Новгород 2021г Цель работы: изучить способы выражения состава растворов и освоить методику приготовления растворов заданной концентрации. Опыт 1. Приготовление раствора с заданной массовой долей растворенного вещества из навески этого вещества Задание: Методом растворения твердого вещества в воде приготовьте 50 мл водного раствора Хлорид натрия с массовой долей 18% и плотностью 1,1325 г∙см-3. Методом денсиметрии (с помощью ареометра) определите концентрацию приготовленного раствора. Выразите состав приготовленного раствора разными способами. Выполнение опыта: 1 Рассчитали массу соли, необходимую для приготовления раствора заданной концентрации. mсоли = (ωNaCl* Vводы * ρраст) / 100% = (18*50*1,1325 )/ 100% = 10,1925 г. m (NaCl) = 10,1925 г. 2 Полученную навеску соли количественно перенесли в мерную колбу на 50 мл, используя воронку. Затем растворяли соль, приливая дистиллированную воду порциями при перемешивании круговыми движениями кисти руки (объем первой порции воды был не больше половины объема расширенной части мерной колбы). После полного растворения соли добавили воду до круговой отметки на горле колбы (чтобы не перелить, последние капли воды добавляли с помощью глазной пипетки) так, чтобы нижняя сторона мениска жидкости совпала с круговой отметкой при строго горизонтальном взгляде на круговую отметку:  Приготовленный раствор тщательно перемешали, для этого колбу закрыли пробкой и несколько раз перевернули вверх дном. 3 Измерили плотность приготовленного раствора с помощью ареометра, для этого раствор перелили в цилиндр, выбрали подходящий ареометр, осторожно опустили ареометр в раствор и по шкале ареометра определили значение плотности (ρэксп.) приготовленного раствора. 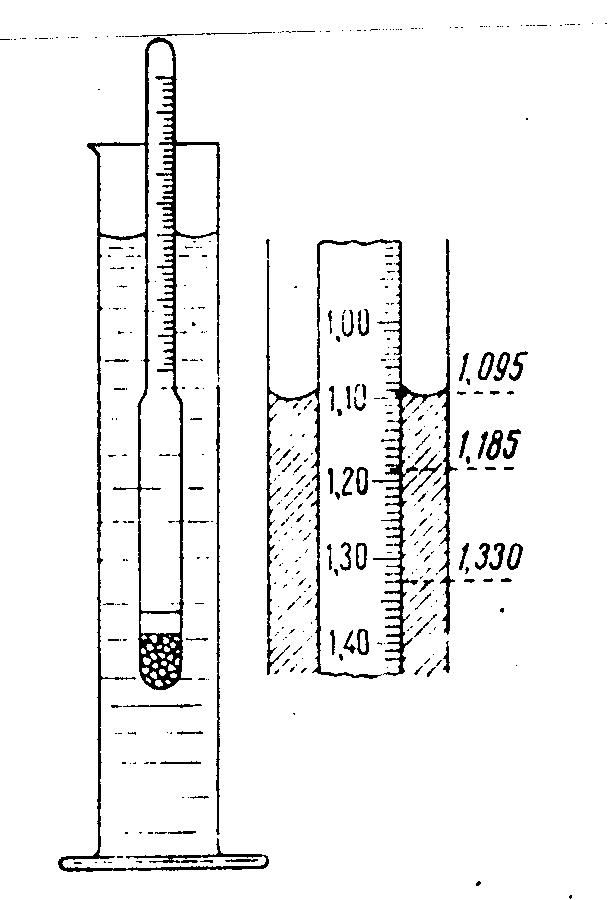 Затем по справочнику определили массовую долю (ω%,эксп.) соли в приготовленном растворе, соответствующую плотности этого раствора: ρэксп. = 1,1325 ; ω%,эксп.= 18. Для определения массовой доли соли в растворе по значению плотности этого раствора применили метод интерполяции (суть метода: зависимость массовой доли растворенного вещества в растворе от плотности раствора в узком интервале значений имеет прямо пропорциональный характер): ρтеор.1 = 1,1319 ; ему соответствует ω%,теор.1 = 18; ρэксп. = 1,1325; ему соответствует ω%,эксп. = 18; ρтеор.2 = 1,1478 ; ему соответствует ω%,теор.2 = 20. Значение ρтеор.1 и ρтеор.2 – это ближайшие к ρэксп. значения из справочника, при этом ρтеор.1 < ρэксп., а ρтеор.2 > ρэксп. Составили и решили пропорцию: (ρтеор.2 - ρтеор.1):( ρэксп. - ρтеор.1)=(ω%,теор.2 - ω%,теор.1):( ω%,эксп. - ω%,теор.1) ( 1,1478 - 1,1319):( 1,1325. - 1,1319)=( 20 - 18):( 18 — 18); ( 1,1478 - 1,1319):( 1,1325. - 1,1319)=0; (1,0159):(1,0001)=0. ω%,эксп(KCl)= 18% 4 Рассчитали состав приготовленного раствора разными способами, результаты эксперимента и расчетов внесли в таблицу:
Вычисления: mр-ра= 1,132*50=56,6г. mсоли = (ωNaCl* Vводы * ρраст) / 100% = (18*50*1,1325 )/ 100% = 10,1925 г. mводы=56,6- 10,1925= 46,4075 г. M(KCl)=22.98+35,45=58,4 г/моль. СМ = 56,6/(58,4*50)*1000=19,3 моль/л. Сн = 56,6*1/(58,4*50)*1000= 19,3 моль/л. z (NaCl) = 1 Сm = 10,1925*1000/58,4*46,4075= 3,7607 моль/кг. Т = 56,6/50 = 1,132 г/мл. N = (0.93/0,93) + 2,7 = 0,26 Рассчитали абсолютную и относительную погрешности: ∆ = ρпракт – ρтеорет = 1,132-1,1478=-0,0158(абсолютная погрешность) 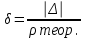 0,0158/ 1,1478 = 1,3765% Вывод: В ходе выполнения работы мы освоили методику приготовления растворов заданной концентрации, теоретически рассчитали плотность раствора и измерили плотность эксперементально. В результате плотность приготовленного нами раствора с учётом погрешности соответствует расчётам. | ||||||||||||||||||||||||||||||||||||
