Кафедра химии химия лабораторный журнал
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
ФЕДЕРАЛЬНОЕ Государственное бюджетное образовательное учреждение Высшего образования ТверскоЙ государственнЫЙ медицинскИЙ университет МинИСТЕРСТВА здравООХРАНЕНИЯ РоссИЙСКОЙ ФЕДЕРАЦИИ Кафедра химии ХИМИЯ ЛАБОРАТОРНЫЙ ЖУРНАЛ для студентов, обучающихся по специальностям «Лечебное дело» (31.05.01) и «Педиатрия» (31.05.02) студента______________________________________________ группы № ____________________________________________ ТВЕРЬ 2020 УДК 54 ББК 24 Авторы-составители: Зубарева Г.М., Бордина Г.Е., Лопина Н.П., Беляева И.А. Под общей редакцией профессора, док.биол.наук. Зубаревой Г.М. Рецензенты: Харитонова Е.А. – канд. биол. наук, доцент кафедры биологии ФГБОУ ВО Тверского ГМУ Минздрава России Лещенко Д.В. – канд. биол. наук, доцент кафедры биохимии с курсом клинической лабораторной диагностики ФПДО, ординатуры ФГБОУ ВО Тверского ГМУ Минздрава России Утвержден ЦКМС ТГМУ Химия: лабораторный журнал для студентов,обучающихся по специальностям «Лечебное дело» (31.05.01) и «Педиатрия» (31.05.02)[Электронный ресурс] / Зубарева Г.М., Бордина Г.Е., Лопина Н.П., Беляева И.А. // Под общей редакцией: доктора биологических наук, профессора Г.М. Зубаревой. – Тверь. 2020. – 663 КБ. Лабораторный журнал составлен коллективом преподавателей кафедры химии ФГБОУ ВО Тверского ГМУ Минздрава России и предназначен в помощь студентам, обучающимся по специальностям «Лечебное дело» (31.05.01) и «Педиатрия» (31.05.02) для подготовки к лабораторно-практическим занятиям. Авторы-составители – сотрудники кафедры химии Тверского государственного медицинского университета: Галина Мефодьевна Зубарева – докт. биол. наук, профессор кафедры химии Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии Надежда Петровна Лопина –канд. хим. наук, доцент кафедры химии Ирина Александровна Беляева – ассистент кафедры химии . МЕРЫ БЕЗОПАСНОСТИ Обучающийся обязан соблюдать меры безопасности при работе в химической лаборатории! НЕОБХОДИМО: работать в застегнутом хлопчатобумажном халате; личные вещи хранить в специально отведенном месте; при попадании химических реактивов на стол, пол и другие предметы сообщить преподавателю, для проведения работы по нейтрализации разлитых реактивов; опыты с едкими, ядовитыми или сильно пахнущими веществами разрешается проводить только в вытяжном шкафу; при разбавлении концентрированных кислот необходимо соблюдать порядок смешивания: кислоту постепенно вливать в воду; после завершения работы необходимо отключить газ, воду, вытяжные шкафы и электроэнергию; при попадании раствора щелочи или кислоты в глаза или другие участки кожи необходимо промыть их проточной водой (3-5 минут), а затем раствором борной кислоты (в случае попадания щелочи) или питьевой соды (в случае попадания кислоты), после чего обратиться к врачу. КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ: принимать пищу в лаборатории; проводить опыты в загрязненной посуде; набирать жидкие растворы в пипетку ртом; нагревать, смешивать и взбалтывать реактивы вблизи лица; зажигать одну спиртовку от другой; переносить горящую спиртовку; выливать в раковину остатки растворов кислот и щелочей, огнеопасных и взрывоопасных веществ; бросать в раковину осколки стекла от разбитой посуды, бумагу и вату; открывать окна без разрешения преподавателя; работать с распущенными длинными волосами. ЗА НЕСОБЛЮДЕНИЕ МЕР БЕЗОПАСНОСТИ ОБУЧАЮЩЕЙСЯ ОТСТРАНЯЕТСЯ ОТ ЗАНЯТИЙ! С мерами безопасности Инструктаж провел (а) ознакомлен и обязуюсь их выполнять ___________________ Приготовление стандартных растворов Раствор с точно известной концентрацией может быть получен растворением навески вещества в известном объеме, или установлением концентрации по другому раствору, который заранее стандартизирован. В первом случае получается раствор с приготовленным титром, во втором – с установленным титром. Навеска – порция вещества, точно взвешенная на весах. Титр – способ выражения концентрации, означающий массу определяемого вещества, соответствующую 1мл титранта. Титр применяется, как правило, при массовом проведении анализов. Концентрация стандартных растворов должна быть определена с точностью до трех или четырех значащих цифр. Наиболее надежны растворы с приготовленным титром. Однако это возможно не для всех веществ. Например, растворы обычно применяемых кислот соляной, серной, азотной нельзя приготовить из точных навесок, так как исходные растворы кислот содержат переменное количество воды. Едкие щелочи поглощают из воздуха воду и углекислый газ, и точные навески их взять невозможно. Для получения раствора с приготовленным титром пригодны лишь такие вещества, которые могут быть хорошо очищены от примесей, имеют постоянный состав, не изменяются на воздухе и при хранении. Вещества, удовлетворяющие перечисленным требованиям, называются исходными или стандартными. К ним относятся многие соли (тетраборат натрия, оксалат натрия, хлорид натрия, дихромат калия), щавелевая кислота и ряд других. Если в работе используются стандартные растворы веществ, которые не удовлетворяют перечисленным требованиям, то их стандартизируют титрованием. Тщательно приготовленные и проверенные стандартные растворы хранят в условиях, исключающих изменение концентрации за счет испарения, разложения вещества или попадания примесей из окружающей среды. Концентрацию стандартных растворов периодически проверяют. Стандартные растворы можно готовить также из имеющихся в продаже стандарт-титров (фиксаналов). Это стеклянные ампулы, содержащие точно определенные количества различных твердых или растворенных веществ. Вскрыв ампулу, вещество количественно (без остатка) переносят в мерную колбу после чего растворяют его и добавляют воду до метки. М  ерные колбы. Это колбы с длинными узким горлышком, на котором наносится кольцевая метка (рис.1). На колбе указывается ее объем, который реализуется при наполнении колбы до метки. Мерные колбы бывают на 25, 50, 100, 200, 250, 500, 1000 или 2000 мл. Они изготавливаются из тонкого стекла и предназначаются для приготовления заданных объемов растворов точной концентрации. Нагревание их на пламени или плитках не допускается. Возможно лишь погружение колбы в подогретую воду, если, например, требуется ускорить растворение вещества. ерные колбы. Это колбы с длинными узким горлышком, на котором наносится кольцевая метка (рис.1). На колбе указывается ее объем, который реализуется при наполнении колбы до метки. Мерные колбы бывают на 25, 50, 100, 200, 250, 500, 1000 или 2000 мл. Они изготавливаются из тонкого стекла и предназначаются для приготовления заданных объемов растворов точной концентрации. Нагревание их на пламени или плитках не допускается. Возможно лишь погружение колбы в подогретую воду, если, например, требуется ускорить растворение вещества.Посуда, применяемая в объемном анализе В объемном анализе применяется специальная мерная посуда: бюретки, пипетки и мерные колбы. Б  юретки. Это градуированные стеклянные трубки, приспособленные для отмеривания растворов небольшими порциями или отдельными каплями. Бюретка укрепляется вертикально в штативе, и отсчет делений ведется сверху вниз. Нижняя часть бюретки сужена и соединяется короткой резиновой трубкой с тонким стеклянным носиком. В резиновую трубку вставляется стеклянный шарик чуть большего диаметра, чем диаметр самой трубки. Шарик служит для удерживания раствора в бюретке. В тех случаях, когда применяемый раствор может реагировать с резиной, используют бюретку с обычным стеклянным краном. На рис.2 показаны некоторые разновидности бюреток. Они изготавливаются объемом от 1 до 50мл. Для работы выбирается бюретка в зависимости от объема раствора, применяемого в анализе. В микроанализе удобны бюретки объемом 3-6мл («микробюретки»). юретки. Это градуированные стеклянные трубки, приспособленные для отмеривания растворов небольшими порциями или отдельными каплями. Бюретка укрепляется вертикально в штативе, и отсчет делений ведется сверху вниз. Нижняя часть бюретки сужена и соединяется короткой резиновой трубкой с тонким стеклянным носиком. В резиновую трубку вставляется стеклянный шарик чуть большего диаметра, чем диаметр самой трубки. Шарик служит для удерживания раствора в бюретке. В тех случаях, когда применяемый раствор может реагировать с резиной, используют бюретку с обычным стеклянным краном. На рис.2 показаны некоторые разновидности бюреток. Они изготавливаются объемом от 1 до 50мл. Для работы выбирается бюретка в зависимости от объема раствора, применяемого в анализе. В микроанализе удобны бюретки объемом 3-6мл («микробюретки»).В зависимости от объема, а, следовательно, и диаметра бюретки цена делений может составлять от 0,01 до 0,1мл. Н  аполнение бюретки титрантом. Бюретку ополаскивают сначала дистиллированной водой, а затем раствором, которым предполагается ее заполнять. Жидкости заливают через воронку приблизительно на 1/3 высоты бюретки, а сливают через носик. После этого титрант наливают немного выше нулевого деления. Пузырек воздуха из носика бюретки удаляют, отогнув слегка носик вверх и приоткрывая затвор. Вынимают воронку и устанавливают уровень раствора на нулевом делении, снова приоткрывая затвор или кран. Правильная установка на «ноль» и последующий отсчет делений производится по центру мениска (часто не точно говорят: по нижнему мениску). Отсчет показаний бюретки следует производить с точностью не менее 0,5 от наименьшего деления. Для повышения точности отсчета целесообразно за бюреткой помещать бумажный квадрат, наполовину закрашенный черной тушью. На его фоне резче выделяется мениск. Используются также усовершенствованные бюретки с впаянной цветной полосой позади шкалы. Преломление света в мениске вызывает появление разрыва полосы, точно указывающего уровень раствора. Каждый опыт по титрованию начинают с нулевого деления, чем обеспечивается работа в одной и той же области шкалы. аполнение бюретки титрантом. Бюретку ополаскивают сначала дистиллированной водой, а затем раствором, которым предполагается ее заполнять. Жидкости заливают через воронку приблизительно на 1/3 высоты бюретки, а сливают через носик. После этого титрант наливают немного выше нулевого деления. Пузырек воздуха из носика бюретки удаляют, отогнув слегка носик вверх и приоткрывая затвор. Вынимают воронку и устанавливают уровень раствора на нулевом делении, снова приоткрывая затвор или кран. Правильная установка на «ноль» и последующий отсчет делений производится по центру мениска (часто не точно говорят: по нижнему мениску). Отсчет показаний бюретки следует производить с точностью не менее 0,5 от наименьшего деления. Для повышения точности отсчета целесообразно за бюреткой помещать бумажный квадрат, наполовину закрашенный черной тушью. На его фоне резче выделяется мениск. Используются также усовершенствованные бюретки с впаянной цветной полосой позади шкалы. Преломление света в мениске вызывает появление разрыва полосы, точно указывающего уровень раствора. Каждый опыт по титрованию начинают с нулевого деления, чем обеспечивается работа в одной и той же области шкалы.Пипетки. Это специальные стеклянные трубки, предназначенные для отмеривания и переноса заданного объема раствора из одного сосуда в другой. Часто применяемые разновидности пипеток показаны на рис.3. пипетка Мора 1 имеет в средней части шаровое или цилиндрическое расширение, нижний конец ее сужен, а выше расширения нанесена кольцевая метка (риска). На расширенной части пипетки указывает ее объем и температура, при которой производилась калибровка. При выливании раствора из пипетки, наполненной до метки, объем раствора в точности соответствует маркировке. Наполнение пипетки производят всасыванием раствора резиновой грушей, плотно приставленной к верхнему концу пипетки. Д  ругая разновидность пипеток 2 напоминает бюретки. С их помощью можно набирать заданные количества раствора. Пипетки изготавливаются различных объемов: пипетка Мора – от 5 до 50мл; градуированные – от 0,1 до 10мл. Их держат в специальных подставках в вертикальном положении (рис. 4). ругая разновидность пипеток 2 напоминает бюретки. С их помощью можно набирать заданные количества раствора. Пипетки изготавливаются различных объемов: пипетка Мора – от 5 до 50мл; градуированные – от 0,1 до 10мл. Их держат в специальных подставках в вертикальном положении (рис. 4).О 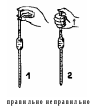 тмеривание растворов пипетками. Анализируемый растворов при титровании берут с помощью пипетки, которую опускают в склянку с раствором почти до дна. Наполнение пипетки производится всасыванием раствора резиновой грушей, плотно приставленной к ее верхнему концу. В первый раз набирают раствор для ополаскивания пипетки. Перенеся эту порцию в сливную склянку, набирают раствор снова немного выше метки. Верхний конец пипетки быстро зажимают указательным пальцем (рис. 5). Ослабляя нажим пальца, дают раствору медленно вытекать до установки мениска точно на метке. Снимают каплю раствора с носика пипетки, коснувшись им горлышка склянки. тмеривание растворов пипетками. Анализируемый растворов при титровании берут с помощью пипетки, которую опускают в склянку с раствором почти до дна. Наполнение пипетки производится всасыванием раствора резиновой грушей, плотно приставленной к ее верхнему концу. В первый раз набирают раствор для ополаскивания пипетки. Перенеся эту порцию в сливную склянку, набирают раствор снова немного выше метки. Верхний конец пипетки быстро зажимают указательным пальцем (рис. 5). Ослабляя нажим пальца, дают раствору медленно вытекать до установки мениска точно на метке. Снимают каплю раствора с носика пипетки, коснувшись им горлышка склянки.Осторожно, следя за тем, чтобы раствор не капал, подносят пипетку к колбе, куда намечено перенести данный объем раствора. Открывают верхний конец пипетки и свободно переливают раствор. Если на пипетке нет нижней метки, то сливают весь раствор, касаясь кончиком стенки колбы. Выжидают 10 с для стекания жидкости со стенок. Если на пипетке имеются деления, то плотно зажимают верхний конец в момент прохождения мениска у требуемого деления. Отмеренную порцию раствора называют аликвотной долей. Остаток раствора переносят обратно в склянку. Проведение титрования. Коническую колбу с раствором, приготовленным для титрования, помещают под наконечником бюретки на листе белой бумаги. Наконечник должен находиться на уровне горлышка колбы. Приоткрывая затвор, добавляют титрант в колбу небольшими порциями. Одновременно с добавлением титранта правой рукой осторожно встряхивают колбу для перемешивания растворов. Вблизи точки эквивалентности раствор в месте попадания капли титранта на короткое время приобретает окраску, характерную для точки эквивалентности. Это служит признаком приближающегося конца титрования. Титрант начинают добавлять по одной капле, каждый раз полностью перемешивая раствор. Как только произошло стойкое изменение окраски раствора, титрование прекращают и записывают показание бюретки. Первое титрование служит для ориентировочного установления объема, и его результат не входит в число контрольных измерений. Затем проводят титрование еще не менее четырех раз. Проведение второго и последующих опытов ускоряется одноразовым добавлением титранта в объеме, лишь на доли миллилитра меньшем результата первого титрования. После этого добавляют титрант по каплям до точки эквивалентности. Дата_______________ Лабораторная работа № 1 «Концентрация растворов. Приготовление растворов заданной концентрации» Цель работы: приобрести навыки приготовления растворов с заданной концентрацией. Ход работы: Опыт 1. Приготовление растворов заданной концентрации В лабораторной практике часто приходится проводить пересчет концентрации имеющихся растворов из одних единиц в другие. При пересчете весовой концентрации в объемную и наоборот необходимо помнить, что массовая доля рассчитывается на определенную массу раствора, а молярная и нормальная концентрации — на объем, поэтому для расчета необходимо знать плотность раствора. Плотность раствора приводится в справочниках в соответствующих таблицах. Задача 1. Приготовить 100 мл 0,1н раствора NaCl из 10% раствора NaCl c плотностью 2,17 г/мл. Задача 2. Приготовить 100 мл 0,01М раствора С6Н12О6 из 10% раствора С6Н12О6 c плотностью 1,54 г/мл. Задача 3. Приготовить 100 мл 0,15н раствора СН3СООН из 10% раствора СН3СООН c плотностью 1,05 г/мл. Задача 4. Приготовить 100 мл 0,02М раствора С12Н22О11 раствора С12Н22О11 c плотностью 1,59 г/мл из 10%. Расчеты:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________ Выполнение работы проверил(а) _____________________________ Дата_______________ Лабораторная работа № 2 «Учение о растворах. Наблюдение явлений плазмолиза и гемолиза эритроцитов» Цель работы: изучить влияние концентрации веществ в окружающей среде на состояние эритроцитов и объяснить его на основе осмотического давления. Ход работы: Опыт 1. В 3 пробирки вносят пипеткой по 3 мл трех растворов хлорида натрия разных концентраций. В каждую пробирку добавляют микропипеткой по 0,5 мл крови. Перемешивают стеклянной палочкой. По одной капле каждой смеси наносят палочкой на предметные стекла, закрывают покровными стеклами и изучают препараты под микроскопом. Зарисовывают форму эритроцитов в каждом случае. Если эритроциты не наблюдается, то это также отмечают в протоколе работы. Рассчитывают осмотическое давление примененных в работе растворов хлорида натрия, и объясняют на этой основе наблюдаемые явления плазмолиза и гемолиза эритроцитов. Выполняют рисунки наблюдаемых явлений. Делают вывод о значение явления осмоса для состояния клеток. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Выполнение работы проверил(а) _____________________________ Дата_______________ Лабораторная работа № 3 «Термодинамика» Цель работы: приобрести навыки калориметрического определения теплоты химической реакции и обработки данных эксперимента. Ход работы: Опыт 1. Определение теплоты реакции нейтрализации. Для практических и научных целей возможно экспериментальное и расчетное определение энергетических эффектов – теплоты (∆Н или Q) и максимальной работы реакций (∆G). Изучается выделение теплоты при реакции нейтрализации по повышению температуры раствора. Для всех сильных кислот и щелочей реакция нейтрализации описывается одним и тем же уравнением: Н+ + ОН- = Н2О ΔH = - 56 кДж Для выполнения работы используют калориметр. Внутренний стакан имеет емкость 0,2 л, внешний – 0,5 л. Цена делений термометра должна составлять 0,1о. Во взвешенный калориметрический стакан помещают 50 мл 1н раствора щелочи и записывают показание термометра. В отдельный стакан отмеряют 50 мл 1н раствора кислоты и измеряют его температуру. Затем через воронку вливают раствор кислоты в калориметр, непрерывно помешивая смесь стеклянной палочкой. Отмечают самую высокую температуру, которую покажет термометр после сливания растворов. Определение проводят два раза: 2 NaOH · aq + H2SO4 · aq = Na2SO4 · aq + 2 H2O(ж) + Q Результаты опытов записывают в таблицу:
По результатам опытов вычисляют теплоты нейтрализации, используя формулу: 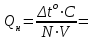 ∆to = to2 – to1 = C = m1·C1 + m2·C2 = Удельную теплоемкость стекла (C1) принять равной 0,753Дж/г.град, раствора (C2) – 4,184Дж/г.град, плотность раствора – 1г/мл. В какой единице необходимо выразить объем, подставляя его в формулу? Сравните полученные величины Qн с общепринятым значением теплоты реакции нейтрализации. Найдите отклонения результатов опытов от истинного значения теплоты нейтрализации сильной кислоты сильным основанием. Расчеты:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ | |||||||||||||||||||||||||||
