Расчеты: рН1=
рН2=
рН3=
Константа диссоциации уксусной кислоты Кg =1,8 ∙ 10 -5
Cделайте вывод о зависимости рН буферных растворов от соотношения концентраций компонентов и разведения.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Определение буферной емкости растворов.
В колбу налить 10 мл буферного раствора с рН 5 (4 мл 0,1н СН3СООН + 6мл 0,1н. СН3СООNa) и прибавить 3 капли индикатора метилового красного. Раствор титровать 0,1 н раствором NaОН до появления окраски (рН 6,3).
Рассчитать буферную емкость по формуле:
В =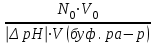 = [моль/л] = [моль/л]
где N0 – нормальная концентрация раствора NaOH;
V0 – объем раствора NaOH , пошедший на титрование, мл;
∆ рН – изменение рН испытуемого буферного раствора в процессе титрования
V(буф.р-р) – объем испытуемого буферного раствора, мл.
____________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Влияние разбавления на буферную емкость.
К 10 мл буферного раствора с рН=5 (4 мл СН3СООН + 6 мл СН3СООNa) добавить 10 мл дистиллированной воды и прибавить 3 капли индикатора метилового красного и титровать 0,1 н раствором щелочи. Определить буферную емкость как и в предыдущей работе.
V(буф.р-р) = 20 мл (10+10)
Сделать вывод о влиянии разбавления на буферную емкость
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнение работы проверил(а)
_____________________________
Дата_______________
Лабораторная работа № 7 «Адсорбция из растворов»
Цель работы: определение влияния природы адсорбента, адсорбтива и растворителя на адсорбцию красителей из растворов.
Ход работы:
Опыт 1. Адсорбция электролитов, красителей и золей углем.
В пробирки наливают по 5 мл сильно разбавленных слабо окрашенных растворов CuSO4, K2Cr2O7, фуксина водного, флюоресцеина, эозина, золей гидроксида железа (III) и берлинской лазури. Затем внесите немного (около 0,2 г) растертого в порошок активированного угля, встряхивайте смесь в течении 5 минут и оставьте в штативе. Спустя 15-20 минут отфильтруйте через бумажные фильтры.
Как изменился цвет растворов?
В выводе охарактеризуйте адсорбционные свойства активированного угля.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 2. Адсорбция ионов свинца углем.
В пробирку налейте примерно 5мл раствора нитрата свинца (II) Pb(NO3)2 Добавьте около 0,2г растертого в порошок активированного угля, встряхивайте смесь в течении 5 минут и отфильтруйте через бумажный фильтр. К фильтрату добавьте немного раствора дихромата калия K2Cr2O7. В отдельную пробирку налейте примерно 5мл раствора свинца (II) и сразу добавьте немного раствора дихромата калия.
В каком случае наблюдается выпадение осадка?
Pb(NO3)2 + K2Cr2O7 → PbCr2O7↓ + 2КNO3
В выводе объясните наблюдаемые явления, укажите цвет осадка.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________
Опыт 3. Влияние растворителя на адсорбцию.
В одну пробирку налейте примерно 5 мл слабо окрашенного водного раствора фуксина, в другую – 5 мл так же слабо окрашенного спиртового раствора фуксина, внесите в обе пробирки примерно по 0,1г порошка активированного угля. Смесь встряхивайте в течение 5 минут и оставьте в штативе. Спустя 10 -15 минут отфильтруйте через бумажные фильтры.
Как изменилась окраска растворов в пробирках?
В каком случае обесцвечивание растворов произошло в большей степени?
В выводе объясните наблюдаемые явления в соответствии с правилом Ребиндера.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнение работы проверил(а)
_____________________________
Дата_____________
Лабораторная работа №8 «Хроматография на бумаге
(распределительная и осадочная)»
Цель работы: приобрести навыки разделения смеси веществ с помощью бумажной хроматографии.
Ход работы:
Опыт 1. Хроматографическое разделение на бумаге катионов Cu2+ и Fe3+ с использованием распределительного механизма и расчетом коэффициента распределения Rf.
Схема установки для получения восходящей хроматограммы (бывают еще нисходящие и круговые бумажные хроматограммы) приведена на рис.1.
Х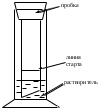 роматографирование проводят в цилиндрах высотой 20-30см, закрытых герметически пробкой и насыщенных парами растворителя (24часа). Растворителем служит смесь, содержащая 87% ацетона, 5% воды и 8% концентрированной соляной кислоты. Из хроматографической бумаги вырезают полоску шириной 2см и длиной 14-15см. На расстоянии 2,5см от одного края полоски карандашом проводят стартовую линию. Каплю исследуемого раствора (смесь CuSO4 и Fe2(SO4)3, содержащую 2мг каждого иона в 1мл раствора) наносят на полоску бумаги на стартовую линию так, чтобы капля не растеклась, обводят ее карандашом и высушивают на воздухе. Полоску бумаги подвешивают в цилиндр с растворителем таким образом, чтобы место нанесения капли (обведенное карандашом) было над уровнем растворителя, а нижний край полоски был погружен в растворитель. Цилиндр плотно закрывают пробкой и дают растворителю подниматься по полоске бумаги вверх до ее середины ( роматографирование проводят в цилиндрах высотой 20-30см, закрытых герметически пробкой и насыщенных парами растворителя (24часа). Растворителем служит смесь, содержащая 87% ацетона, 5% воды и 8% концентрированной соляной кислоты. Из хроматографической бумаги вырезают полоску шириной 2см и длиной 14-15см. На расстоянии 2,5см от одного края полоски карандашом проводят стартовую линию. Каплю исследуемого раствора (смесь CuSO4 и Fe2(SO4)3, содержащую 2мг каждого иона в 1мл раствора) наносят на полоску бумаги на стартовую линию так, чтобы капля не растеклась, обводят ее карандашом и высушивают на воздухе. Полоску бумаги подвешивают в цилиндр с растворителем таким образом, чтобы место нанесения капли (обведенное карандашом) было над уровнем растворителя, а нижний край полоски был погружен в растворитель. Цилиндр плотно закрывают пробкой и дают растворителю подниматься по полоске бумаги вверх до ее середины (
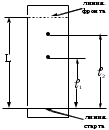
40-50мин.). Затем полоску вынимают, отмечают карандашом фронт растворителя и высушивают в сушильном шкафу. После этого полоску опрыскивают раствором проявителя K4[Fe(CN)6] и снова высушивают. Ионы меди Cu2+ и Fe3+ дают с проявителем цветные осадки, поэтому на хроматограмме появляются окрашенные зоны. Синее пятно указывает на присутствие ионов Fe3+, а буро-красное пятно – на присутствие ионов Cu2+. Место обнаружения пятна отмечают карандашом и рассчитывают коэффициенты распределения Rf по формуле:
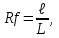 где где
ℓ – длина пути, пройденного веществом (см. рис.2),
L – путь пройденный растворителем.
Результаты опыта записать в таблицу.
Разделяемые ионы
|
Проявитель
|
Цвет зоны
|
Длина пути
|
Rf
|
Cu2+
|
|
|
ℓ1=
|
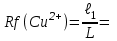
|
Fe3+
|
|
|
ℓ2=
|
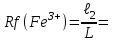
|
|
|
|
L=
|
|
Опыт 2. Осадочная хроматография на бумаге смеси катионов Sn2+ и Sb3+.
Для разделения смеси катионов олова и сурьмы надо пропитать обыкновенную фильтровальную бумагу комбинированным реагентом (смесь 20г Na2S2O3 и 2г KJ на 100мл H2O), действующим как осадитель и восстановитель одновременно. Для этого следует на полоску фильтровальной бумаги (размером 3х4см) нанести пипеткой 1-2 капли указанного реагента,, затем подсушить на воздухе. В центре образовавшегося пятна с помощью капилляра следует поместить каплю исследуемой смеси солей сурьмы и олова. Полоску опустить на 15-20секунд в фарфоровую чашку с расплавленным парафином (температура 80-90о), затем вынуть, дать стечь парафину и охладить на воздухе. Горячий парафин ускоряет выпадение осадков, способствует разделению катионов, а после охлаждения затормаживает процесс диффузии. В результате опыта в центре хроматограммы образуется пятно оранжево-красного цвета (сурьмяная киноварь Sb2OS2), окаймленное резко очерченным серо-черным осадком SnS.
При длительном хранении образовавшиеся зоны осадков на бумажной хроматограмме становятся еще более резко очерченными.
Опыт 3. Разделение катионов Hg2+ и Mn2+ методом бумажной осадочной хроматографии.
На полоску (3х4см) фильтровальной бумаги в качестве осадителя наносят 1-2 капли 4%-ного раствора хлорида натрия, затем подсушивают на воздухе. В центре пятна осадителя капилляром наносят каплю раствора, содержащего смесь катионов ртути (I) и марганца (II). Спустя 1-2мин. образовавшуюся на бумаге хроматограмму «проявляют» путем выдерживания над концентрированным 25%-ным раствором аммиака. На проявленной хроматограмме в центре появляется черное пятно ртути, окруженное бурым кольцом соединений марганца (IV).
ВНИМАНИЕ: Рекомендуется придерживаться такой последовательности в выполнении работ.
1. Начать опыт 1, довести его до такого момента, когда надо ожидать результаты в течение 40-50минут.
2. Выполнить опыты 2 и 3.
3. Закончить опыт 1 измерениями ℓ1 и ℓ2, с расчетом величин Rf для катионов меди и железа.
Выполнение работы проверил(а)
_____________________________
Дата_______________
Лабораторная работа № 9 «Получение, свойства и методы очистки коллоидных растворов»
Цель работы: научиться готовить коллоидные растворы различными методами, очищать их от примесей с помощью диализа.
Ход работы:
Опыт 1. Получение золя парафина методом замены растворителя.
В пробирку налить приблизительно 10мл (1/2 пробирки) дистиллированной воды; добавить 5 капель спиртового раствора парафина, смесь энергично перемешать.
Изучить свойства полученного коллоидного раствора: окраску, прозрачность в проходящем и отраженном свете. Отметить наличие или отсутствие конуса Фарадея-Тиндаля.
Для наблюдения эффекта Фарадея-Тиндаля пробирку с коллоидным раствором помещают на пути луча света проекционного фонаря. Наблюдение проводят под углом 90 к направлению падающего света.
Результаты наблюдений внести в таблицу 1.
Опыт 2. Получение золя гидроксида железа (III) методом гидролиза
В пробирку налить приблизительно 10мл (1/2 пробирки) дистиллированной воды и нагреть до кипения.
В кипящую воду добавить 5 капель 2% раствора хлорида железа(III) и продолжить нагревание до появления красно-бурой окраски.
Изучить свойства полученного коллоидного раствора: окраску, прозрачность в проходящем и отраженном свете. Отметить наличие или отсутствие конуса Фарадея-Тиндаля.
Результаты наблюдений записать в таблицах 1 и 2.
Опыт 3. Получение золя иодида серебра по реакции двойного обмена.
В пробирку налить приблизительно 10мл. (1/2 пробирки) 0,002н. раствора KJ, прибавить 1мл 0,01н. AgNO3 и взболтать. Получается желтоватый мутный золь с отрицательным зарядом гранул (избыток KJ).
Проверить наличие или отсутствие конуса Фарадея-Тиндаля.
Результаты наблюдений внести в таблицы 1 и 2.
В таблицу 2 записать химическую реакцию и схему строения молекулы для случая, когда в избытке находится AgNO3.
Опыт 4. Получение золя серы по реакции двойного обмена
В пробирку налить приблизительно 15мл. (3/4 пробирки) 0,5н. раствора Na2S2O3 и прибавить примерно 5мл разбавленной в 50 раз H3PO4 (=1,7).
Изучить свойства полученного коллоидного раствора: окраску, прозрачность в проходящем и отраженном свете. Отметить наличие или отсутствие конуса Фарадея-Тиндаля.
Результаты наблюдений внести в таблицу 2.
Опыт 5. Диализ золя гидроксида железа (III).
На электроплитке нагреть в отдельных стаканах небольшое количество (10-15мл) золя гидроксида железа (III) и дистиллированную воду (примерно 1/2 стакана). Горячий золь гидроксида железа (III) осторожно налить в пергаментный мешочек и, повесив мешочек на стеклянную палочку, погрузить его в стакан с горячей дистиллированной водой так, чтобы вода не переливалась через край мешочка. Через 10-12 минут мешочек вынуть, отлить примерно 2-3мл дистиллированной воды из стакана в пробирку и добавить немного раствора AgNO3. Установить наличие хлорид-ионов в пробе воды по помутнению раствора (образуется осадок AgCl).
Отметить отсутствие окрашивания воды, так как частицы золя не проходят через полупроницаемый пергамент.
В выводе отметить, за счет чего достигается очистка золя от низкомолекулярных примесей.
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Таблица 1
№ опыта
|
Название полученного золя
|
Метод получения
|
Внешний вид
(цвет, прозрачность)
|
Наличие или отсутствие конуса Фарадея-Тиндаля
|
диспергационный или конденсационный
|
физический или химический
|
В проходящем свете
|
В отраженном свете
|
1.
|
|
|
|
|
|
|
2.
|
|
|
|
|
|
|
3.
|
|
|
|
|
|
|
4.
|
|
|
|
|
|
| |
 Скачать 0.61 Mb.
Скачать 0.61 Mb.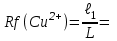
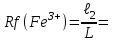

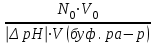 = [моль/л]
= [моль/л] роматографирование проводят в цилиндрах высотой 20-30см, закрытых герметически пробкой и насыщенных парами растворителя (24часа). Растворителем служит смесь, содержащая 87% ацетона, 5% воды и 8% концентрированной соляной кислоты. Из хроматографической бумаги вырезают полоску шириной 2см и длиной 14-15см. На расстоянии 2,5см от одного края полоски карандашом проводят стартовую линию. Каплю исследуемого раствора (смесь CuSO4 и Fe2(SO4)3, содержащую 2мг каждого иона в 1мл раствора) наносят на полоску бумаги на стартовую линию так, чтобы капля не растеклась, обводят ее карандашом и высушивают на воздухе. Полоску бумаги подвешивают в цилиндр с растворителем таким образом, чтобы место нанесения капли (обведенное карандашом)
роматографирование проводят в цилиндрах высотой 20-30см, закрытых герметически пробкой и насыщенных парами растворителя (24часа). Растворителем служит смесь, содержащая 87% ацетона, 5% воды и 8% концентрированной соляной кислоты. Из хроматографической бумаги вырезают полоску шириной 2см и длиной 14-15см. На расстоянии 2,5см от одного края полоски карандашом проводят стартовую линию. Каплю исследуемого раствора (смесь CuSO4 и Fe2(SO4)3, содержащую 2мг каждого иона в 1мл раствора) наносят на полоску бумаги на стартовую линию так, чтобы капля не растеклась, обводят ее карандашом и высушивают на воздухе. Полоску бумаги подвешивают в цилиндр с растворителем таким образом, чтобы место нанесения капли (обведенное карандашом) 
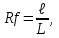 где
где