Кафедра химии химия лабораторный журнал
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
Таблица 2
Выполнение работы проверил(а) _____________________________ Дата_______________ Лабораторная работа № 10 «Коагуляция золей. Определение порога коагуляции. Коллоидная защита» Цель работы: приобрести навыки определения порогов коагуляции и коагулирующей способности электролитов, познакомиться с явлением коллоидной защиты. Ход работы: Опыт 1. Определение знака заряда частиц методом каппиляризации. На листок фильтровальной бумаги нанести с помощью бюретки каплю золя гидроксида железа(III) и отдельно каплю золя берлинской лазури. После всасывания капли положительно заряженные золи дают окрашенное в центре и бесцветное по краям пятно. Отрицательно заряженные золи дают равномерно до краев окрашенное пятно. Объясняется это тем, что отрицательно заряженная по отношению к воде бумага адсорбирует положительные частицы и не адсорбирует отрицательные. В тетради зарисуйте то, что наблюдается на фильтровальной бумаге и определите по полученным экспериментальным данным знак заряда частиц золей гидроксида железа(III) и берлинской лазури.
капля золя гидроксида капля золя железа(III) берлинской лазури В выводе напишите, что наблюдается на бумаге при растекании капли положительно и отрицательно заряженных золей. -------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- Опыт 2. Определение порога коагуляции золя гидроксида железа (III) электролитами. Проводят последовательно опыт с растворами электролитов 1М KCl, 0,01М K2SO4, 0,001М K3[Fe(CN)6]. 1) Приготовление исходных растворов электролита различных концентраций и золя В четырёх пробирках готовят с помощью пипеток и бюреток растворы электролита различных концентраций, смешивая для этого исходный раствор электролита и воду в соотношениях, указанных в таблице 1. В другие четыре хорошо вымытых пробирки набирают с помощью бюреток по 5мл гидрозоля гидроксида железа(III). 2) Смешивание приготовленных растворов электролита с золем Полученные растворы электролита приливают по возможности все одновременно в пробирки с золем гидроксида железа(III) и тотчас же перемешивают, встряхивая.
3) Результаты наблюдений. Через десять минут отмечают, в каких пробирках произошла явная коагуляция (помутнение или седиментация). Результаты наблюдений записывают в таблицу.
4) Расчёт порогов коагуляции золя (Спор.) и коагулирующих способностей (К.С.) для каждого электролита: Спор= 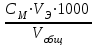 ммоль/л; К.С.= ммоль/л; К.С.=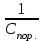 где См – молярная концентрация раствора электролита; VЭ – наименьший объём исходного раствора электролита, вызывающий коагуляцию данного объёма золя; Vобщ – общий объём золя, раствора электролита и воды.
Опыт 3. Правило Шульце – Гарди. В 6 чистых пробирок набрать с помощью бюреток по 5мл золя гидроксида железа (III), а в 6 других пробирок – по 5мл золя берлинской лазури. Затем в пробирки прилить с помощью пипеток по 1мл растворов электролитов в порядке, указанном в таблице.
Пробирки встряхнуть, поставить в штатив и записать в соответствующем столбце таблицы, в какой последовательности начинается коагуляция и седиментация золей. Учитывая концентрацию растворов электролитов, расположить катионы и анионы электролитов в ряд по убывающему коагулирующему воздействию для каждого золя в отдельности и сопоставить результаты с правилом Шульце – Гарди, учитывая заряд частиц изучаемых золей. В выводе отметьте соответствуют ли полученные данные правилу Шульце-Гарди. -------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- Опыт 4. Определение способности желатина защищать гидрозоль берлинской лазури от коагуляции его электролитами. В 2 пробирки налить из бюретки по 5мл золя берлинской лазури. Пробирки пропонумеровать карандашом для стекла или фломастером. В пробирку №1 добавить пипеткой 1мл свежеприготовленного 0,5%-ного раствора желатина и перемешать содержимое пробирки. В пробирку №2 (контрольную) из бюретки добавить 1мл дистиллированной воды, содержимое пробирки перемешать. Через 1-2 минуты в обе пробирки добавить по 1мл 0,02М раствора Al(NO3)3, содержимое перемешать. В какой пробирке происходит седиментация? Результаты наблюдений записать в таблицу.
Сделать вывод о причине наблюдаемых явлений. -------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- Выполнение работы проверил(а) _____________________________ Дата ________________ Лабораторная работа № 11 «Набухание высокомолекулярных соединений» Цель работы: изучить влияние электролитов на величину набухания полимеров. Ход работы: Опыт 1. Влияние кислоты, щелочи, солей и неэлектролитов на набухание желатина. В восемь узких пробирок одинакового диаметра налить по 5 мл различных растворов согласно следующей таблице:
В каждую пробирку внести приблизительно по 0,3 г порошка желатина, осторожно встряхнуть пробирку и дать желатину опуститься на дно. Приложив полоску миллиметровой бумаги, определить высоту осадка желатина и внести эти данные в таблицу. Оставить пробирки на 1-2 часа, периодически несколько раз встряхивать осадок. Определить высоту набухшего осадка и результаты записать в таблицу. В выводах отметить влияние различных веществ на набухание в соответствии с обращенным лиотропным рядом. ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________ ________________________________________________________________________________________________________________________________________ Выполнение работы проверил(а) _____________________________ Содержание
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
