кар. Карбоновые кислотытупицына. Карбоновые кислоты
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
Карбоновые кислоты 10-11 класс Тупицына Юлия Извините, что делаю в печатном виде, повредила руку сильно ЛАБОРАТОРНАЯ РАБОТА №1 ТЕМА: КАРБОНОВЫЕ КИСЛОТЫ. ЦЕЛЬ РАБОТЫ: Изучить химические и физические свойства карбоновых кислот. Научиться определять содержание карбоновых кислот с помощью качественных реакций. ОПЫТ 1: Свойства олеиновой кислоты. РЕАКТИВЫ: Олеиновая кислота, бромная вода, раствор перманганата калия, раствор карбоната калия. ОБОРУДОВАНИЕ: Пробирки, штатив, стеклянные трубки. ХОД РАБОТЫ: Взаимодействие олеиновой кислоты с бромной водой. В пробирку помещают немного олеиновой кислоты и по каплям добавляют бромную воду при встряхивании пробирок. Что наблюдается? Напишите уравнения реакций. Лабораторная работа №2 “Свойства уксусной кислоты, общие со свойствами минеральных кислот” Цель работы:изучить свойства карбоновых кислот. Оборудование и реактивы:штатив с пробирками (3 шт.), пробка с длинной стеклянной трубкой-холодильником, химический стакан, уксусная кислота (70%), магний, цинк, фенолфталеин, гидроксид натрия, этанол, серная кислота (конц.), вода, хлорид натрия. Ход работы: Опыт № 1. Взаимодействие уксусной кислоты с некоторыми металлами. В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а во вторую – несколько гранул цинка. В первой пробирке происходит бурная реакция, а во второй – реакция протекает спокойно (иногда она начинается только при нагревании). Задания для самостоятельного вывода: 1. Как уксусная кислота реагирует с магнием и цинком? 2. Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде. Опыт № 2. Взаимодействие уксусной кислоты с основаниями. Влейте в пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавление уксусной кислоты происходит обесцвечивание. Опыт № 3. Взаимодействие уксусной кислоты со спиртами. В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл этанола. Затем в пробирку осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте. Жидкость налейте в сосуд с насыщенным раствором хлорида натрия. Задания для самостоятельного вывода: 1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? 2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями? 3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? 4. Напишите уравнения всех этих трѐх опытов. 5. Составьте уравнения реакций муравьиной кислоты: а) с цинком; б) с гидроксидом калия; в) с содой. Лабораторная работа №3 «Очистка и разделение веществ» При оформлении лабораторной работы следует четко выделить следующие разделы: название работы; цель; описание опытов и результаты; обработка результатов экспериментов; выводы. Опыт 1. Очистка бензойной кислоты методом возгонки. Обязательные требования к оформлению лабораторной работы. 1. Характеристика метода возгонки; Дать определение возгонки. Очень коротко описать суть метода, какие вещества могут быть очищены методом возгонки. 2. План проведения эксперимента; Описать план проведения эксперимента (очень коротко и последовательно). 3. Рисунок установки, структурная формула очищаемого вещества; Привести рисунок установки для очистки вещества методом возгонки, подписать составные части установки, привести структурную формулу очищаемого вещества. 4. Таблица с названием, наличие всех данных, необходимых для проведения расчета массовой доли чистого вещества в техническом образце бензойной кислоты, а также массовой доли посторонних примесей в техническом образце; Полностью заполнить таблицу, название таблицы. В таблицу внести все исходные данные, а также результаты эксперимента, которые необходимы для обработки и достижения цели лабораторной работы. 5. Обработка результатов эксперимента. Расчет массовой доли чистого вещества в техническом образце бензойной кислоты, а также массовой доли посторонних примесей в техническом образце; Привести рисунок установки для очистки вещества методом возгонки, подписать составные части установки, привести структурную формулу очищаемого вещества. 6. Таблица с названием, наличие всех данных, необходимых для проведения расчета массовой доли чистого вещества в техническом образце бензойной кислоты, а также массовой доли посторонних примесей в техническом образце; Привести все расчеты. Установка для проведения возгонки Приборы: фарфоровая чашка, химическая воронка, фильтр, плитка. Реактивы: загрязненная бензойная кислота. Ход работы: Перед возгонкой необходимо подготовить кружок фильтровальной бумаги, проколотый шилом (20-30 проколов), который будет препятствовать обратному попаданию очищенной бензойной кислоты в чашку. На весах отмеряют 1 г загрязненной бензойной кислоты и помещают ее в фарфоровую чашку. Чашку накрывают проколотым кружком фильтровальной бумаги и ставят на плитку. Трубку химической воронки неплотно закрывают ватой, к наружной части воронки прикладывают смоченный в воде кусок ткани для охлаждения. Аккуратно помещают воронку на чашу. Включают плитку и проводят возгонку до тех пор, пока объем вещества в фарфоровой чашке не будет оставаться постоянным. Закончив возгонку, полностью охлаждают прибор и аккуратно разбирают его. Вещество с воронки и фильтра осторожно счищают шпателем на часовое стекло и взвешивают. Заполняют таблицу и проводят необходимые расчеты. Вещество, название, структурная формула Справочные данные: Т пл , 0 С Масса загрязненного вещества, г Масса вещества после очистки, г Выход, % Лабораторная работа№4 Замораживание уксусной кислоты Описание. Безводная уксусная кислота кристаллизуется при температурах, близких к комнатной. Приготовим охлаждающую смесь – смесь воды и льда. Поместим пробирку в охлаждающую смесь и нальем немного безводной уксусной кислоты. Кислота быстро остывает до точки замерзания. Замерзшая уксусная кислота похожа на лед. Безводную уксусную кислоту называют ледяной уксусной кислотой. Если немного подогреть пробирку, ледяная уксусная кислота начинает плавиться. Лабораторная работа № 5Жиры. Изучение химических свойств жировЦель работы. Знакомство со структурой и свойствами жиров. Реактивы и материалы. Четыреххлористый углерод CCl4, растительное масло, животный жир, раствор брома в CCl4, спирт этиловый, NaOH 30-40 % раствор, насыщенный раствор NaCl, дистиллированная вода, бисульфат калия К2НSO4, водяная баня, нагревательный прибор. Пробирки, стаканы, стеклянная трубочка, стеклянная палочка Задания: 1. Определить остатки ненасыщенных карбоновых кислот в составе жиров 2. Изучить качественные реакции жиров. 3. Провести реакцию омыления жиров. Порядок выполнения работы. Опыт № 1. Определение остатков ненасыщенных кислот в жирах. В пробирку наливают 1 мл растительного масла, растворяют его в 2-3 мл СCl4. В полученный раствор прибавляют 1 - 2 капли раствора брома в CCl4 или бромной воды и взбалтывают. Буровато-желтая окраска бромного раствора исчезает, что указывает на присутствие в растительном масле ненасыщенных жирных кислот. Опыт № 2. Омыление жиров. В пробирку налейте 1 г растительного масла, 1 мл этилового спирта и 2мл 30-40 % раствора NaOH. Пробку закройте пробкой, снабженной стеклянной трубочкой, которая выполняет роль воздушного холодильника. Смесь перемешайте и нагрейте в водяной бане. Смесь быстро становится однородной и через 3-5 минут омыление заканчивается. Реакция омыления проходит по следующей схеме: 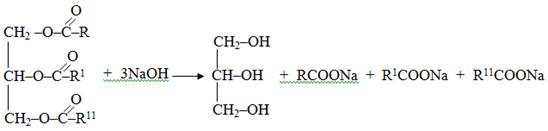 В реакционную смесь добавьте горячий насыщенный раствор хлорида натрия NaCl. Раствор становится мутным и мыло всплывает на поверхность жидкости. Реакционную смесь кипятят еще несколько минут в водяной бане и охлаждают холодной водой. При этом мыло становится твердым. Мыло отделяют при помощи шпателя или стеклянно палочки. Далее проверяется растворимость мыло в воде и его пенообразование. Для этого 0,1 - 0,2 г мыла растворяют в 6 - 7 мл дистиллированной воде и перемешивают. Отмечают качество появившегося мыльного пена. Опыт № 3. Качественные реакции на жиры а) Образование масляного пятна. Каплю масла наносят стеклянной палочкой на кусочек бумаги. Образуется пятно, не исчезающее при нагревании. б) Акролеиновая реакция. С помощью пробы на акролеин определяют наличие глицерина в жирах. При нагревании жира с кислым сернокислым калием (КНSO4), натрием (NaHSO4) происходит отщепление от молекулы глицерина двух молекул воды и образование акрилового альдегида или акролеина, обладающего резким раздражающим запахом. Реакция протекает по следующей схеме: 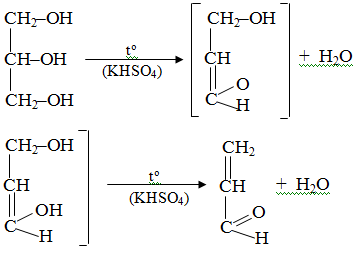 В сухую пробирку вносят несколько капель растительного масла или кусочек животного жира, добавляют немного порошка кислого сернокислого калия или натрия и осторожно подогревают. Появляются белые пары акролеина, обладающие резким запахом. Опыт № 4. Выделение свободных жирных кислот. К 5 мл раствора мыла добавляют 1- 2 мл раствора соляной кислоты. При взаимодействии сильной кислоты с мылом выделяются свободные жирные кислоты, которые всплывают на поверхность жидкости. Реакция идет по следующему уравнению: С17Н35СООNa + HCl > C17H35COOH + NaCl Опыт № 5. Растворимость жиров. Ставят два ряда пробирок по 4 в каждом, в пробирки первого ряда вносят по несколько капель растительного масла, в пробирки второго ряда - по кусочку твердого жира. в первую пробирку каждого ряда наливают 2 мл дистиллированной воды, во вторую - с только же диэтилового эфира, в третью - ацетона, четвертую - спирта. Все пробирки взбалтывают и наблюдают растворимость жиров в различных растворителях. Лабораторная работа «Сравнение свойств карбоновых кислот» Цели: провести сравнительный анализ химических свойств карбоновых кислот; способствовать формированию умений строить гипотезы, доказывать их экспериментальным путем, делать обобщенные выводы; развивать коммуникативные компетентности. Работу целесообразно организовать в группах, предоставив разные кислоты (муравьиную, уксусную, щавелевую) каждой группе, и обсудить полученные результаты в процессе эвристической беседы. Оборудование и реактивы:пробирки, штатив лабораторный с зажимом, спиртовка; растворы: уксусной, муравьиной, щавелевой кислот (в пробирках с пробками), гидроксида натрия (подкрашенный фенофталеином), карбоната натрия; цинк в гранулах, оксид меди (II), аммиачный раствор оксида серебра, кислотно-основный индикатор. ТБ: 1) осторожно обращаться с лабораторным оборудованием; 2) использовать минимальные количества веществ; 3) не нюхать растворы кислот; 4) тушить спиртовку, накрывая колпачком. Ход исследования Задание 1. Вспомните химические свойства кислот. Задание 2. Пользуясь инструкционной таблицей и материалами учебника, проведите соответствующие опыты и запишите уравнения реакций. Наблюдения Уравнения реакций 1. Индикатор 2. Zn 3. CuO 4. NaOH 5. Na2CO3 6. [Ag(NH3)2]OH Выводы: _______________________________________________ ___________________________________________________________ ___________________________________________________________ Задание 3. Отметьте свойства, с помощью которых можно распознать выданную вам кислоту среди других органических веществ. ___________________________________________________________ ___________________________________________________________ ___________________________________________________________ ___________________________________________________________ ___________________________________________________________ Задание 4. Действие окислителей на карбоновые кислоты: Муравьиная кислота Уксусная кислота Щавелевая кислота Р-р KMnO4, подкисленный H2SO4 Концентрированная H2SO4 ___________________________________________________________ ___________________________________________________________ ___________________________________________________________ ___________________________________________________________ ___________________________________________________________ Выводы: _______________________________________________ ___________________________________________________________ ___________________________________________________________ Лабораторная работа «Сравнение свойств карбоновых кислот» Лабораторные опыты к уроку-исследованию, в результате которых происходит более глубокое осмысление причин различий в свойствах органических веществ. Цель: провести сравнительный анализ свойств карбоновых кислот. Примечание: 1) необходимо пояснить, что муравьиная и уксусная кислоты имеют резкий запах; 2) целесообразно продемонстрировать перед выполнением лабораторной работы внешний вид щавелевой кислоты (кристаллическое вещество белого цвета) и задать проблемный вопрос с межпредметным содержанием: с чем связаны названия муравьиной и щавелевой кислот? Дополнительная информация. Муравьиная кислота: содержится в ядовитых железах муравьев, в крапиве, в еловой хвое. В 10 раз сильнее всех карбоновых кислот, является действенным средством против клещей у пчел. Впервые получена синтетическим путем в 1831 году Т. Пелузом из синильной кислоты. Уксусная кислота: синтетическим путем получена Г. Кольбе в 1845 г. В естественных условиях образуется при скисании вин под действием бактерий. Входит также в состав пота, мочи и желчи, встречается в некоторых растениях. За сутки человеческий организм выделяет 0,5 кг этой кислоты. Щавелевая кислота: впервые синтезирована в 1824 г. немецким химиком Ф. Вёлером из дициана. Кристаллическая кислота может вызвать ожоги слизистых оболочек ротовой полости, пищевода и желудка. Является ядовитым веществом. В природе содержится в щавеле, ревене, кислице и некоторых других растениях в свободном виде и в виде солей – оксалатов калия и кальция. При нарушении водно-солевого обмена может накапливаться в организме человека в виде оксалатов и образовывать так называемые камни в почках. Проблемные вопросыдля совместного обсуждения: 1) Как объяснить окисление муравьиной кислоты аммиачным раствором оксида серебра (реакция «серебряного зеркала») при отсутствии подобной реакции у уксусной кислоты. Решение: особенности строения муравьиной кислоты (отсутствие углеводородного радикала и наличие карбонильной группы, как у альдегидов) объясняет наличие реакции «серебряного зеркала»: HCOOH + 2[Ag(NH3)2]OH = Ag↓ + (NH4)2CO3 + 2NH3↑+ H2O 2) Что можно ожидать при окислении этих кислот более сильными окислителями (раствором перманганата калия или концентрированной серной кислотой)? Решение получаем путем дополнительных демонстрационных опытов окисления кислот (наблюдения обучающимся рекомендуется занести в отчет): а) окисление подкисленным раствором перманганата калия (KMnO4): к 1 мл муравьиной кислоты приливают 10 мл разбавленного раствора перманганата калия и немного 10%-ной серной кислоты. Нагревают пробирку. Газоотводную трубку опускают в известковую воду. Перманганат калия при реакции обесцвечивается, содержимое пробирки пенится от образующегося газа, а известковая вода мутнеет (можно идентифицировать углекислый газ с помощью зажженной лучины). Пояснения к проведению опыта с щавелевой кислотой: смешать раствор щавелевой кислоты с концентрированным раствором перманганата калия в соотношении 2 : 1. Наблюдается вскипание смеси, выделяется большое количество газа, на стенках пробирки образуются капли воды. (Можно просто растереть сухую смесь реактивов в ступке – реакция начнется без добавления воды.) Реактивы: кислоты в пробирках (муравьиная, уксусная, щавелевая), щавелевая кислота кристаллическая, раствор KMnO4, конц. H2SO4, газоотводная трубка, раствор Ca(OH)2 или лучина для определения наличия углекислого газа; б) окисление концентрированной серной кислотой. Наблюдения: Муравьиная кислота Уксусная кислота Щавелевая кислота Р-р KMnO4, подкисленный H2SO4 Раствор KMnO4 обесцвечивается, выделяется газ (горящая лучина гаснет) Раствор KMnO4 не обесцвечивается Раствор KMnO4 обесцвечивается, выделяется газ (горящая лучина гаснет) Концентрированная H2SO4 Бурное выделение газа, горящего голубоватым пламенем Видимых признаков реакции нет Бурное выделение газа (горящая лучина гаснет) Выводы: 1) Уксусная кислота устойчива к действию окислителей. 2) Муравьиная и щавелевая кислоты окисляются до углекислого газа и воды (написание уравнений реакций приведет к заключению о том, что при окислении щавелевой кислоты концентрированной серной кислотой образуются угарный и углекислый газы). Уравнения (запись осуществляется при помощи пояснений учителя): 1) 5HCOOH + 2KMnO4 + 3H2SO4 = 5CO2↑ + 2MnSO4 + K2SO4 + 8H2O 2) 5HOOC-COOH + 2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 10CO2↑+ +8H2O Н2SO4, t° 3) НCOOH CO↑ + H2O Н2SO4, t° 4) HOOC-COOH CO↑ + СО2↑ + Н2О Заключительный вопрос, показывающий степень усвоения данной темы: – Какие из продемонстрированных химических реакций можно использовать в виде качественных при идентификации рассмотренных карбоновых кислот? (Реакцию окисления серной кислотой.) |
