методы очистки. Каталитические методы очистки газов. Каталитические процессы очистки газов от сероводорода
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Министерство образования и науки Российской Федерации ФГБОУ ВО УГНТУ Кафедра нефтехимии и химической технологии Реферат По дисциплине: Современные направления развития газохимии На тему: Каталитические процессы очистки газов от сероводорода Проверил: доцент, к.н. Климкин М.А. Выполнил: ст.гр МТС01-21-01 Попова Е.И. Уфа 2022 СОДЕРЖАНИЕ Введение 3 1 Каталитические методы очистка газов от серосодержащих примесей 5 2 Процесс Клауса 7 3 Разложение сероводорода на элементную серу и водород 10 4 Методы нейтрализации 11 5 Аммиачные методы 13 Заключение 15 Список использованной литературы 16 ВВЕДЕНИЕ В основе каталитических методов очистки лежит химическое превращение серосодержащих компонентов газа в иную безопасную или легко отделяемую форму. Так сероводород окисляют кислородом воздуха до атомарной серы по реакции 2H2S + O2 -> H2O + 2S, что является необратимым процессом. В естественных условиях такой процесс не протекает, поэтому для его реализации используют катализаторы, обеспечивающие перенос кислорода. В качестве катализаторов в процессах очистки газовых смесей могут выступать: горячие растворы мышьяковых солей щелочных металлов, гидрат окиси железа в растворе соды и т.д. В свою очередь SO2 с помощью катализаторов окисляют до SO3, который используется в производстве серной кислоты. Для удаления из газа сероводорода используются самые разные способы, однако для работы с большим газовым потоком, движущимся с относительно большой скоростью, лучше всего себя показали абсорбционные методы. В качестве абсорбентов могут использоваться растворы солей щелочных металлов, а также моно- и диэтаноламины. В качестве старого и менее эффективного, чем современные, зато крайне простого способа очистки от сероводорода можно привести Сиборд-процесс. Суть его заключается в промывке газа раствором 1-3% кальцинированной соды, регенерация которого осуществляется простой продувкой воздуха. Обратимая реакция поглощения протекает следующим образом: Na2CO3 + H2S = NaHCO3 + NaHS Большую популярность в качестве абсорбента получили моно- и диэтаноламины ввиду большей стабильности и реакционной способности. Реакция поглощения обратима и для случая использования моноэтаноламина имеет следующий вид: (HOCH2CH2)NH2 + H2S = (HOCH2CH2)NH3HS Десорбция сероводорода протекает при 105°C, после чего поглотительный раствор может быть использован вновь. Поглощение же сероводорода обычно проводят при 30-40°C, что, однако, требует охлаждения в процессе очистки дымовых газов. К основным методам очистки газов от SO2, которые были проверены и отработаны на практике, относят: каталитические методы; методы нейтрализации; аммиачные методы. 1 Каталитические методы очистка газов от серосодержащих примесей Основная идея каталитических методов очистки газов от диоксида серы заключается в его превращении в серную кислоту в присутствии катализатора. Существует множество вариантов проведения такого превращения, различающихся как условиями проведения, так и, что самое важное, используемым катализатором. К наиболее распространенным методам относят пиролюзитный и озонокаталитический метод, являющийся развитием предыдущего. В пиролюзитном методе очистки диоксид окисляется кислородом воздуха до триоксида серы в присутствии катализатора пиролюзита, основу которого составляет MnO2, при этом Mn2+ также окисляется до Mn3+: 4Mn2+ + 3O2 = 2Mn2O3 2SO2 + O2 = 2SO3 Следующим этапом идет взаимодействие образовавшегося оксида Mn3+ с SO2, где первый восстанавливается назад до валентности 2+, а диоксид окисляется до триоксида: 2Mn2O3 + 6SO2 + 3O2 = 2Mn2(SO4)3 Mn2(SO4)3 + SO2 + 2H2O = 2 MnSO4 + 2H2SO4 С накоплением кислоты в растворе интенсивность процесса замедляется вплоть до практически полной остановки, что обусловлено снижением растворимости кислорода и сернистого ангидрида в жидкой фазе. Ниже приведен пример технологической схемы пиролюзитного метода очистки отходящих газов сернокислотного производства.  Рисунок 1 - Технологическая схема пиролюзитного метода очистки отходящих газов сернокислотного производства В начале очищаемый газ подается в абсорбционную колонну, где он охлаждается и происходит частичная конденсация паров серной кислоты и воды. Излишки циркулирующего раствора серной кислоты отводятся в сборник. Далее газ поступает в барботеры, где контактирует с раствором пиролюзита, который готовится отдельно в смесителе, куда поступают вода и раздробленный в мельнице пиролюзит. В барботерах происходит основная химия процесса, и образующаяся серная кислота также отводится в сборник. Поступает в сборник кислота в загрязненном виде с примесью катализатора, который требуется удалить, чтобы раствор принял вид готовой продукции. Для этого после сборника устанавливают центрифугу с промежуточными емкостями, где происходит очистка раствора серной кислоты и ее подача в цех. 2 Процесс Клауса Наиболее распространенным способом переработки сероводорода в серу является процесс Клауса, впервые осуществленный в 1890 г. До 20 млн т/год серы в мире производится в процессе Клауса. Он основан на следующих реакциях: 1) H2S + 3/2О2 = SO2 + H2O, 2) 2H2S + SO2 = 3S + 2Н20; протекают также такие реакции: 3) H2S + 1/2O2 = S + H2O, 4) S + O2 = SO2. Собственно реакцией Клауса часто называют реакцию 2. Протекают также реакции взаимодействия метана и СO2 с H2S, SO2 и S. Процесс Клауса разделяют на термическую и каталитическую стадии. Часть H2S сжигают в печи до SО2 + S. Вследствие высокой температуры (1100-1300°С) часть сероводорода в печи разлагается на Н2 + S. Кроме H2S и Н20 в газах имеются также СО2, COS, CS2, СО, Н2, углеводороды. После конденсации серы образующийся S02 в каталитических реакторах при 250-280°С реагирует с непрореагировавшим H2S по реакции 2. Эта реакция характеризуется небольшим тепловым эффектом, что сильно облегчает поддержание температуры в каталитическом слое. Выше 600°С преимущественно образуется элементная сера S2, при низких температуpax - S8. Реакции 1, 3 и 4 - практически необратимые, реакция 2 - обратимая. Константа ее равновесия равна единице при 500-600°С (для разных форм серы) и растет со снижением температуры. Понижение температуры, повышение давления и отвод продуктов реакции (воды) благоприятно сказываются на конверсии. В качестве катализаторов второй стадии процесса, т.е. реакции H9S + S02, широко применяли природные бокситы (руды, содержащие смесь гидроксидов алюминия) вследствие их достаточно высокой активности, доступности и низкой стоимости. Их недостатки - быстрая дезактивация и непостоянство состава. Сейчас в качестве катализатора используются оксид алюминия, а именно Аl2O3, в виде гранул сферической формы, реже - в форме экструдатов с удельной поверхностью 250-300 м2/г. Иногда применяют TiO2. На тех же катализаторах удаляют и примесные газы CS2 и COS по реакции гидролиза. Дезактивация А12O3 происходит за счет уменьшения удельной поверхности, зауглероживания и сульфатации. Катализатор регенерируют восстановительной обработкой в H2S, взаимодействующем с сульфатом. В хвостовых газах процесса Клауса содержится 0.5-1.8% H2S + SO2 и 0.04-0.16% COS + CS2. Ранее эти газы сжигали, чем загрязняли атмосферу. Позднее был разработан процесс взаимодействия H2S с SO2 на Аl2O3 при 125-150°С. Преимущество низких температур заключается в том, что они смещают реакцию ниже точки росы серы и позволяют сдвинуть равновесие в сторону серы. Таким образом достигается полная конверсия H2S и SO2. Иногда для очистки хвостовых газов производят поглощение H2S и SO2 в жидкой фазе с реакцией между ними в присутствии гомогенного катализатора (например, Na-coли сульфокислоты) и образованием твердой серы. Есть сведения и о проведении заключительной стадии процесса Клауса в среде жидкой серы. Каталитическое окисление сероводорода молекулярным кислородом. Было бы удобнее при сероочистке сероводород окислять прямо в серу, а не в SO2. Первая промышленная установка по окислению H2S молекулярным кислородом в серу для переработки газа, содержащего 13-17% H2S, была пущена в 1982 г. С ростом содержания H2S в исходной смеси по условиям равновесия вероятность образования серы по сравнению с SO2 возрастает. Кинетический и термодинамический анализ, проведенный Т.Г. Алхазовым, показывает, что для достижения высоких степеней превращения H2S в S2 (не менее 99%) должны быть выполнены следующие условия: отношение величин активности катализатора в реакции Клауса и прямом окислении H2S молекулярным кислородом не должно превышать 0.01; порядок реакции по кислороду должен быть меньше 1; реакцию желательно проводить в избытке кислорода. Если катализатор показывает нулевой порядок реакции по кислороду, то для достижения высокой степени конверсии H2S достаточно стехиометрического количества O2; в противном случае высокая конверсия H2S обеспечивается лишь в избытке кислорода. При каталитическом окислении H2S до серы образующаяся сера оказывает автокаталитический эффект на реакцию. По данным ЭПР, сера на поверхности находится в виде нескольких свободных радикалов разного строения и состава. При окислении серы кислород реагирует с этими радикалами. Появляются три разных сигнала ЭПР, которые можно отнести к цепочке, состоящей из атомов S; на конце этой цепочки находится один или два атома кислорода. Восстановление кислорода в SxO2 осуществляется фрагментами диссоциативно адсорбированного сероводорода. При температуре выше 175°С образуется SO2. Катализаторами окисления сероводорода в серу могут быть многие пористые твердые тела. Их активность во времени может уменьшаться, проходить через максимум или даже возрастать. Это связано с образованием и отложением в порах элементной серы, проявляющей часто более высокую каталитическую активность, чем исходное твердое тело. Катализаторы, активные в реакции Клауса, обычно малопригодны для селективного окисления сероводорода в серу. На бокситах и А12O3 наблюдаются сравнительно небольшие степени конверсии H2S в серу. Алхазов изучил ряд катализаторов - оксидов переходных металлов - в окислении H2S до серы при типичных условиях: температуре 200-300°С, объемной скорости 6000 ч-1, содержании H2S 3% и O2 9%. Из простых оксидов более селективными были ТiO2 (рутил), Сг2О3, Fe2O3. Наилучшим среди них оказался Fe2O3, промотированный другими оксидными добавками. Он активен, селективен, обладает высокой механической прочностью. Положительное свойство железного катализатора заключается в его способности проводить окисление сероводорода в элементную серу в присутствии больших количеств углеводородов природного газа, которые при этом не подвергаются каталитическим превращениям. 3 Разложение сероводорода на элементную серу и водород При температуре выше 1000°С может происходить термическая диссоциация молекулы H2S: Применение катализаторов позволяет снизить температуру до 600-800°С. При более низких температурах протекает обратная реакция. Для того чтобы избежать обратной реакции образования H2S, необходима также разработка эффективного быстрого метода отделения водорода от паров серы при высоких температурах. В ряде работ показано, что в качестве эффективных катализаторов для разложения H2S можно использовать сульфиды переходных металлов. На-пример, на минерале, состоящем из 43.5% Fe2O3, 29.4% Si02, 7.4% Аl2O3, 3.3% Mn304, было осуществлено каталитическое разложение H2S при 600-800°С. При высоких температурах происходит также разложение меркаптанов с образованием углеводородов и серы или углеводородов и H2S: 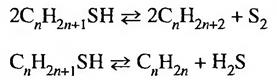 Скорость разложения меркаптанов может быть увеличена в присутствии катализаторов, в качестве которых применяли Аl2O3 и цеолиты. В продуктах реакции обнаруживают серу и сероводород. 4 Методы нейтрализации Методы этой группы заключаются в нейтрализации сернистого ангидрида с образованием соответствующих солей. Существуют содовый (Na2CO3), известковый (CaO), магнезитовый (MgO) и подобные методы нейтрализации. Помимо сравнительно простой реализации и небольших капитальных затрат они имеют преимущество в отсутствии кислых сред в процессе, что не требует использования кислотостойких материалов. В качестве примера рассмотрим содовый метод. Очищаемый газ последовательно проходит две абсорбционные насадочные колонны, орошаемые раствором соды, который готовится отдельно в специальном подготовителе. Циркуляцию поглотительного раствора обеспечивают насосы. Сам процесс поглощения сернистого ангидрида из газа происходит по следующему механизму: 2Na2CO3 + SO2 + H2O = 2NaHCO3 + Na2SO3 2NaHCO3 + SO2 = Na2SO3 + 2CO2 + H2O Na2SO3 + SO2 + H2O = 2NaHSO3 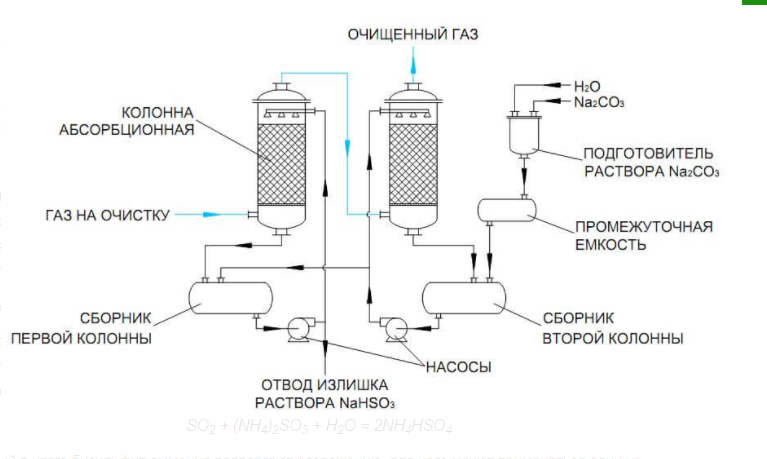 Рисунок 2 – Технологическая схема содовой очистки газов от SO2 Рисунок 2 – Технологическая схема содовой очистки газов от SO2В ходе очистки циркулирующий раствор поглощает диоксид серы и как следствие насыщается бисульфитом натрия. При достижении определенной концентрации часть раствора выводят из циркуляции в виде готового продукта, а недостачу восполняют добавлением такого же объема раствора соды для восстановления поглотительной способности. 5 Аммиачные методы Такие методы достаточно экономичны и позволяют получать диоксид серы и соли аммония в качестве продуктов, но требуют использования аммиака. В их основе лежит процесс взаимодействия диоксида серы c водным раствором сульфата аммония, то есть метод относится к абсорбционным. SO2 + (NH4)2SO3 + H2O = 2NH4HSO4 Получаемый в итоге бисульфит аммония подвергают разложению, для чего может применяться один из следующих способов: кислотный, автоклавный и циклический. В зависимости от выбора способа разложения будут отличаться и получаемые продукты, так использование кислот или циклического метода позволяет получить на выходе SO2 , а автоклавным разложением получают серу и сульфат аммония. В качестве примера возьмем установку для осуществления аммиачно-сернокислого метода очистки. Как следует из названия, для разложения бисульфита аммония применяется серная кислота: 2NH4HSO4 + H2SO4 = 2(NH4)2SO4 + 2H2O + SO2  Рисунок 3 - Установка для осуществления аммиачно-сернокислого метода очистки Очищаемый газ подается в абсорбер, в данном случае распылительного типа, где происходит его контакт с раствором сульфита аммония. В нижней части аппарата происходит отделение капель жидкости с сульфитом и бисульфитом аммония, а газ выводится и направляется на доочистку вначале в каплеотбойник, и далее в электрофильтр. Конденсат из электрофильтра и отделенная жидкая фаза абсорбера поступают в сборник. Эффективность абсорбции зависит от соотношения компонентов в поглотительном растворе. Баланс сульфита и бисульфита поддерживается путем добавления в раствор аммиака, запускающего реакцию: NH4HSO4 + NH3 -> (NH4)2SO4 Увеличение концентрации солей в поглотительном растворе может привести к выпадению их в осадок, поэтому периодически часть насыщенного раствора (с концентрацией 500-600 г/л) отводят в другой сборник. Далее насыщенный раствор поступает в колонну разложения с насадкой, подогреваемую острым паром, куда также подается серная кислота, что инициирует цепочку превращений: 2NH4HSO3 + H2SO4 = (NH4)2SO4 + 2SO2 + 2H2O (NH4)2SO3 + H2SO4 = (NH4)2SO4 + SO2 + H2O Диоксид серы и сульфат аммония, который нейтрализуется раствором аммиака, представляют собой готовую продукцию и отводятся на склад. ЗАКЛЮЧЕНИЕ Каталитические методы очистки газов применяют часто для предварительной очистки технологических газов. Каталитические методы газоочистки основаны на взаимодействии примесей с другими газообразными компонентами в присутствии катализатора преимущественно при 300-400 °С и высоких объемных скоростях газа. К каталитическим методам газоочистки относятся окисление примесей с применением О2 и их восстановление так называемым газом-восстановителем (гидрирование при использовании Н2). Окисляют обычно: кислородсодержащие органические соединения до СО2 и Н2О, например спирты и эфиры. Каталитическая очистка газов с применением газа-восстановителя предназначена для гидрирования сераорганических соединений в H2S в производстве H2S (кобальтмолибденовый кат. при 300-400 °С) с последующим улавливанием образовавшегося H2S оксидом Zn или после охлаждения газа растворами алканоламинов; восстановления метаном и конвертированным природным газом SO2 и паров S в H2S с его селективным извлечением в производстве серы (кобальтмолибденовый или никельмолибденовый катализатор при 300-450 °С); восстановления до N2 оксидов азота, например отходящих газов производства HNO3, с помощью СН4 или Н2 (при 800-900 °С), которые одновременно связывают О2, содержащийся в газе, в СО2 и Н2О, или селективного восстановления с использованием NH3 (при 200-270 °С) в присутствии катализаторов на основе Pt или Pd. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 1 Глинка Н.Л. Общая химия. Изд. 17-е, испр. - Л.: "Химия", 1975. - 728 с. 2 Кузнецов В.В., Усть-Качкинцов В.Ф. Физическая и коллоидная химия. Учеб. пособие для вузов. - М.: Высш. школа, 1976. - 277 с. 3 Носков А.С, Пай З.П. Технологические методы защиты атмосферы от вредных выбросов на предприятиях энергетики. Новосибирск, СО РАН, ГПНТБ, 1996, 156 с. 4 Основы химической технологии: Учебник для студентов хим.-технол.спец. вузов / И.П. Мухленов, А.Е. Горштейн, Е.С. Тумаркина; Под ред. И.П. Мухленова. - 4-е изд., перераб. и доп. - М.: Высш. школа, 1991. - 463 с. 5 Попова Н.М. Катализаторы очистки газовых выбросов промышленных производств.- М.: Химия, 1991. 6 Успехи химии и технологии редкоземельных элементов. - М.: Металлургия, 1970. |
