КИСЛОТЫ И ИХ СВОЙСТВА. Кислоты и их свойства
 Скачать 312 Kb. Скачать 312 Kb.
|
|
КИСЛОТЫ И ИХ СВОЙСТВА. Кислоты — электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка Общая формула кислот HnAc, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac — кислотный остаток. Классификация кислот 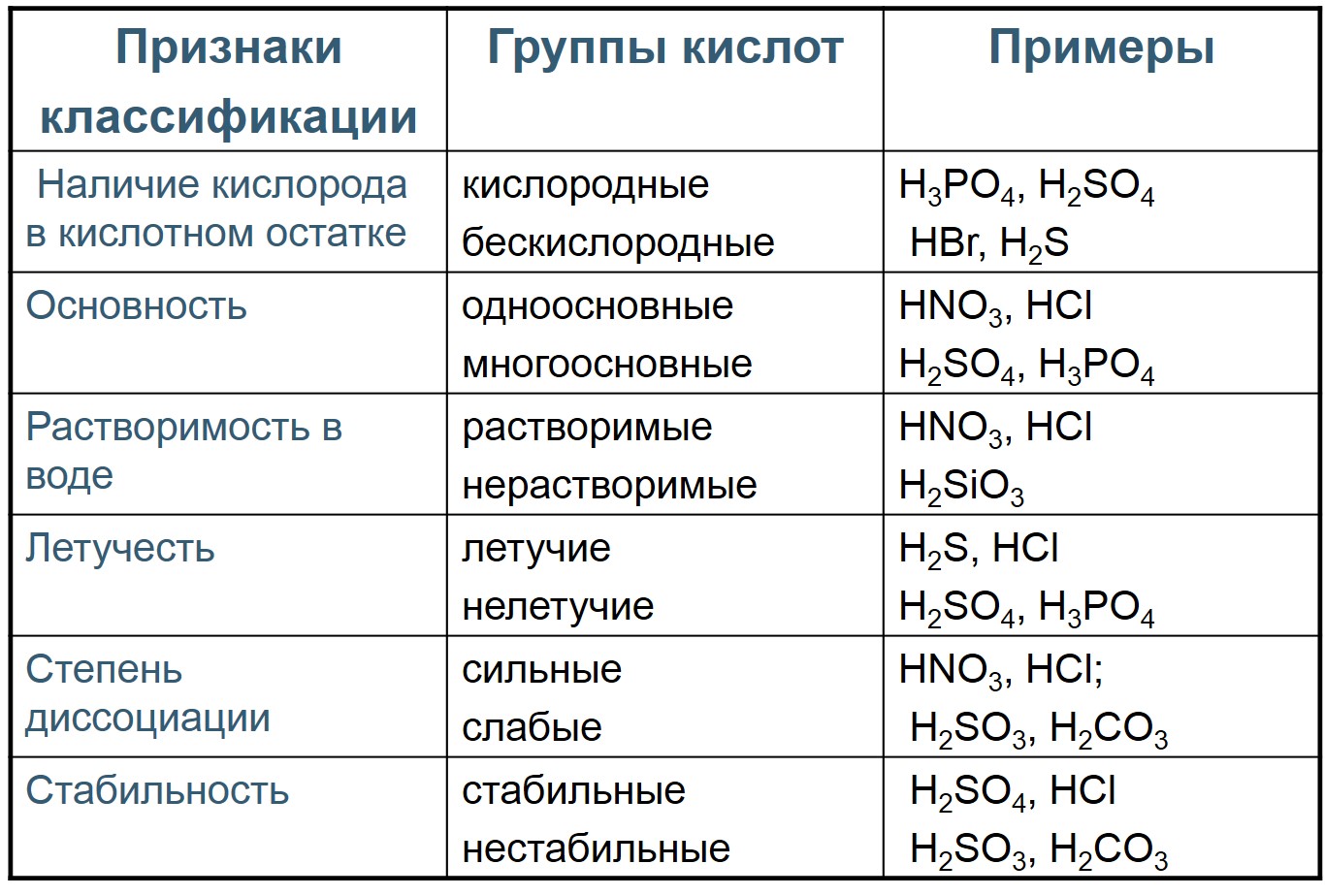 Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 Получение кислот 1) Взаимодействие простых веществ (получают бескислородные кислоты) H2 + Cl2 = 2HCl, H2 + S = H2S. 2) Взаимодействие кислотных оксидов с водой (получают кислородсодержащие кислоты) SO3 + H2O = H2SO4, 3) Взаимодействие солей с растворами сильных кислот (получают слабые кислоты) Na2SiO3 + 2HCl = H2SiO3 + 2NaCl, 4) Электролиз водных растворов солей 2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4. Химические свойства кислот 1) Изменяют окраску индикаторов: Лакмуса → красный цвет, М-О → в розовый, Ф-Ф→ не изменяется. 2) В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток: HCl = H+ + Cl—. Многоосновные кислоты диссоциируют ступенчато: H2SO4 = H+ + HSO4—, HSO4— = H+ + SO42-. Суммарное уравнение: H2SO4 = 2H+ + SO42- 3) Взаимодействие с металлами Ca + 2HCl = CaCl2 + H2 Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода. Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород! Cu + 4HNO3 = Cu(NO3)2+ 2NO2↑+2H2O Cu +2H2SO4 конц = CuSO4+SO2↑ + 2H2O 3) Взаимодействие с основными оксидами (если образуется растворимая соль) CaO + 2HCl = CaCl2 + H2O 4) Взаимодействие с основаниями (реакция нейтрализации) H2SO4 + 2KOH = K2SO4 + 2H2O, 2HCl + Cu(OH)2 = CuCl2 + 2H2O Многоосновные кислоты образуют кислые и средние соли: H2SO4 + NaOH = NaHSO4 + H2O, H2SO4 + 2NaOH = Na2SO4 + 2H2O. 5) Взаимодействие с солями Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок. Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O, 6) Специфические свойства кислот Связаны с ОВР, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства): 2KMn+7O4 + 16HCl— = Cl20 + 2KCl + 2Mn+2Cl2 + 8H2O, H2S-2 + Br20 = S0 + 2HBr—. Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте: H2S+4O3 + Cl20 + H2O = H2S+6O4 + 2HCl—. Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами: C0 + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O, 3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O. В 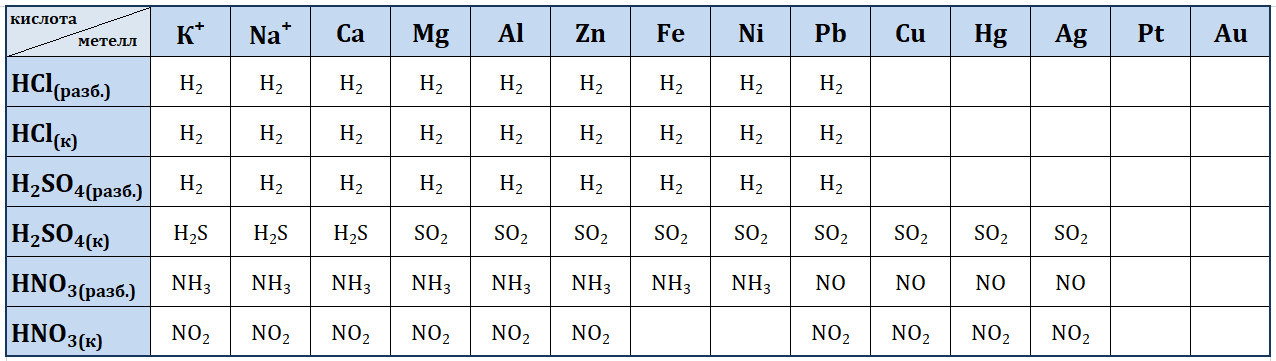 заимодействие кислот с металлами: заимодействие кислот с металлами: |
