3 атт 1 часть. Классификация массообменных процессов
 Скачать 2.06 Mb. Скачать 2.06 Mb.
|
|
Классификация массообменных процессов. В зависимости от контактирующих фаз массообменные процессы делятся: - на жидкость-пар – это дистилляция и ректификация - на жидкость-газ – это абсорбция и обратный процесс – десорбция - на жидкость-жидкость – это экстракция - на жидкость-твердое тело – это выщелачивание - на газ-твердое тело-жидкость – это адсорбция Схема переноса вещества между двумя фазами  Графическое представление о массопереносе. 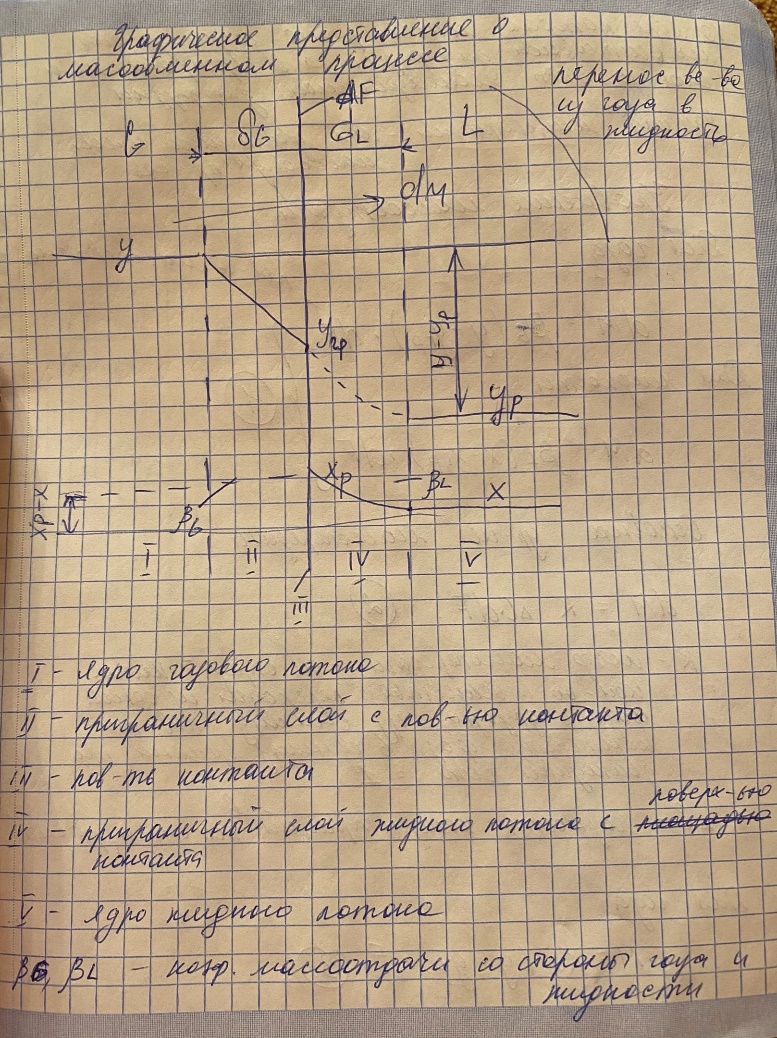 Основные уравнения массоотдачи Уравнение массоотдачи для газа: dM = βG*(y-yгр)*dF Уравнение массоотдачи для жидкости: dM = βL*(x-xгр)*dF Основное уравнение массопередачи dM = K*дельта C*dF К – коэф массопередачи – определяет какое количество вещества переходит из одной фазы в другую через единицу поверхности контакта фаз в единицу времени при движущей силе = 1. Дельта С – разность концентраций в потоке и равновесии Для газа: М = Ку*(у-ур)* F Для жидкости М = Кх*(хр-х)* F Материальный баланс массообменного процесса  Теоретические тарелки. Определение и графическое представление. - это такое контактируемое устройство, в котором выходящие потоки находятся в фазовом равновесии 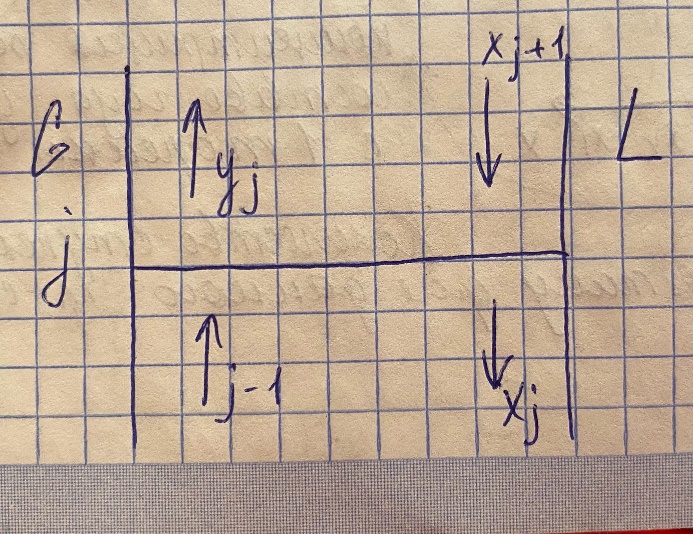 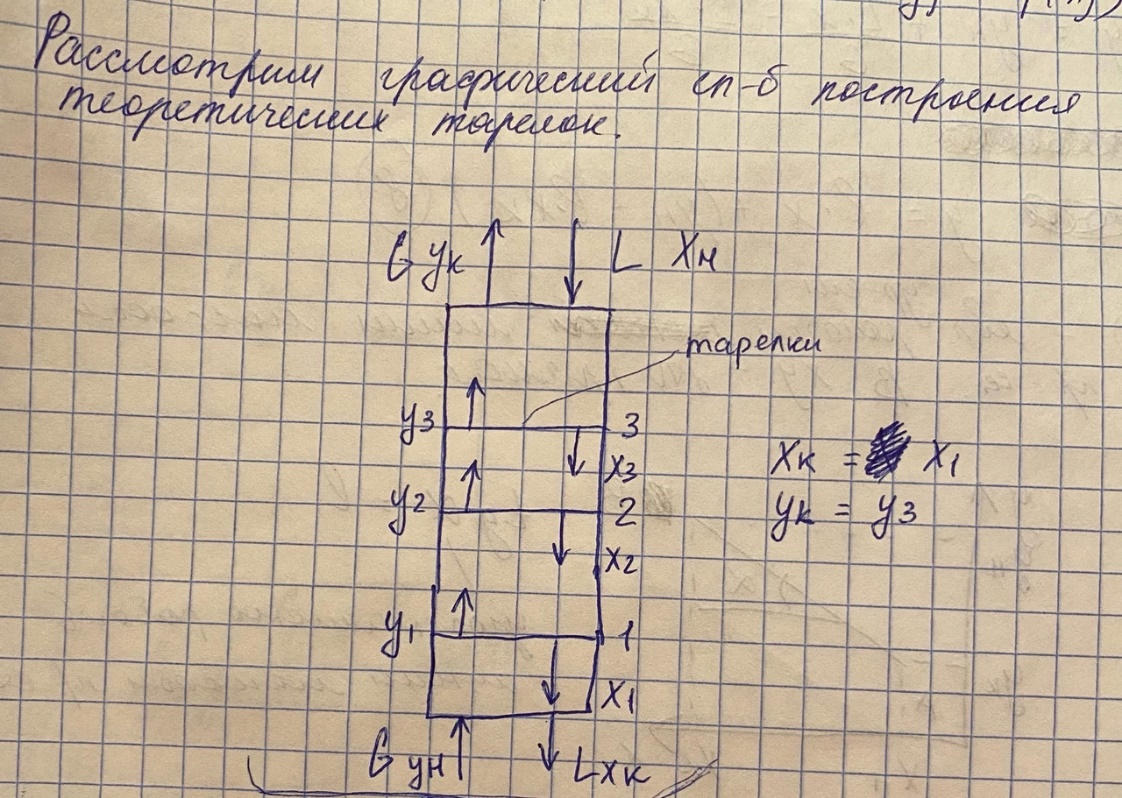 Насыщенные и перегретые пары. Уравнение Антуана Насыщенный пар – состояние пара, которое находится в фазовом равновесии с жидкостью Перегретый пар – пар находится только в паровой среде 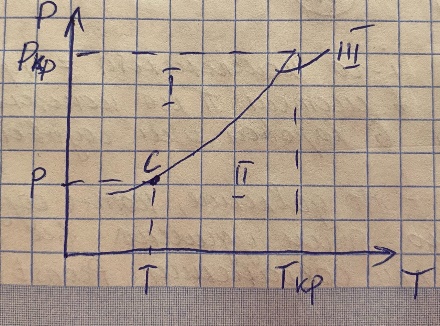  Давление насыщенных паров определяется уравнением Антуана lg P = A – B/(C+T) Р – давление фазового равновесия Т – температура в кельвинах А,В,С – коэф-ты табличные, которые определяются экспериментальным исследованием. Основные законы фазового равновесия. Состояние равновесия характеризуется правилом Гибса L = n+2 = N L – число степеней свободы системы n – число компонентов N – число фаз, участвующих в масообменном процессе В качестве степеней свободы выступают давление, температура и концентрация компонентов. Закон Дальтона pi = π*yi - парциальное давление i-го компонента = произведению общего давления в системе пи на концентрацию i-го компонента в паровой или газовой фазах. Парциальное давление – давление, которое создавал бы газ, если бы из него ыли удалены все компоненты, кроме i-го, при сохранении давления и температуры постоянными. Закон Рауля pi = Рi * хi – парциальное давление i -го компонента = произведению насыщенных паров i -го компонента на концентрацию паров i -го компонента в жидкой фазе. Р – давление насыщенных паров Равновесные составы фаз Решая совместно уравнение Рауля и Дальтона, мы находим уравнение фазового равновесия: π*yi = Рi * хi yi = Рi/ π * хi Кi = Рi/ π – константа фазового равновесия i -го компонента ∑ yi = ∑ Кi * хi – уравнение изотермы жидкой фазы идеального раствора |
