Химия шпоры. Химия (Ответы на вопросы). Классификация основных классов неорганических веществ. Составление формул и номенклатура химических соединений
 Скачать 489.52 Kb. Скачать 489.52 Kb.
|
Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
Все перечисленные комбинации возможны и реально существуют. Несколько особняком стоит первый случай — Г1/Г2. Как правило, смеси газов образуют гомогенную молекулярно-дисперсную систему. И только некоторые газы при высоком давлении способны давать смесь с ограниченной растворимостью — гетерогенные смеси. Следует также отметить своеобразие таких систем, как пены, пенопласты, концентрированные эмульсии, пасты. Своеобразие заключается в том, что в этом случае диспергирована не только дисперсная фаза, но и дисперсионная среда, так как частицы диспергированного материала разделены тончайшей пленкой среды; толщина пленки может достигать коллоидных размеров, т. е. среда также коллоидно-дисперсна, но только в одном измерении — по толщине. В коллоидно-дисперсном состоянии дисперсная фаза состоит из сравнительно небольшого числа молекул. Отдельные коллоидные частицы представляют собой, по существу, зародыши фазы, агрегатное состояние которой иногда трудно установить с полной уверенностью. Кроме того, опыт показывает, что различие в агрегатном состоянии диспергированного вещества (при неизменном агрегатном состоянии дисперсионной среды) не влечет за собой существенных изменений в свойствах коллоидной системы. В связи с этим классификация упрощается, и возможные девять типов дисперсных систем можно свести к трем — по агрегатному состоянию среды: системы с газообразной, жидкой и твердой средой. Для краткости их именуют соответственно аэрозоли, лиозоли и солидозоли. В зависимости от природы дисперсионной среды лиозоли называют гидрозолями, алкозолями, этерозолями и т. д. Дисперсионной средой этих золей является соответственно вода, спирт, эфир. Микрогетерогенные системы с жидкой дисперсионной средой и твердой дисперсной фазой называют суспензиями, с жидкой дисперсной фазой — эмульсиями. Указанные три группы золей существенно отличаются друг от друга свойствами, в частности устойчивостью. Вопрос об устойчивости коллоидных систем — это очень важный вопрос, касающийся непосредственно самого их существования. Поэтому он заслуживает более внимательного рассмотрения. Ранее уже отмечалось, что коллоидно-дисперсные системы термодинамически неустойчивы. Но это положение следует уточнить, тем более, что для различных золей (аэрозолей, лиозолей, солидозолей) окончательная обстановка складывается неодинаковой. Суспензии — дисперсные системы, в которых дисперсной фазой является твердое вещество, а дисперсионной средой — жидкость, — причем твердое вещество практически нерастворимо в жидкости. Чтобы приготовить суспензию, надо вещество измельчить до тонкого порошка, высыпать в жидкость, в которой вещество не растворяется, и хорошо взболтать (например, взбалтывание глины в воде). Со временем частички выпадут на дно сосуда. Этот процесс называется седиментацией. Очевидно, чем меньше частички, тем дольше будет сохраняться суспензия. Поэтому седиментационная неустойчивость тем выше, чем крупнее частицы. Эмульсии — дисперсные системы, в которых и дисперсная фаза и дисперсионная среда являются жидкостями, взаимно не смешивающихся. Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Примером эмульсии является молоко, в котором мелкие шарики жира плавают в жидкости. Суспензии и эмульсии — двухфазные системы. Пены. Как и эмульсии, пены — грубодисперсные системы, Поэтому во многих технологических процессах пены получают теми же диспергационными методами, которые применяют для получения газовых пузырьков. Аэрозоль – дисперсная система, состоящая из мелких, твёрдых или жидких частиц, взвешенных в газовой среде. Аэрозоли, дисперсная фаза которых состоит из капелек жидкости, называются туманами, а в случае твёрдой дисперсной фазы – дымами. Пыль относят к грубодисперсным аэрозолям. раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия. Основными компонентами раствора являются растворитель (дисперсионная среда) и растворенное вещество (дисперсная фаза). Это деление чисто условно. Если раствор образуется при смешивании компонентов одинакового агрегатного состояния, то растворителем считается компонент, которого в растворе больше. В остальных случаях растворителем обычно является жидкость или компонент агрегатное состояние которого не меняется при образовании раствора. Золь — раствор) — высокодисперсная коллоидная система (коллоидный раствор) с жидкой (лиозоль) или газообразной (аэрозоль) дисперсионной средой, в объёме которой распределена другая (дисперсная) фаза в виде капелек жидкости, пузырьков газа или мелких твёрдых частиц, размер которых лежит в пределе от 1 до 100 нм (10−9—10−7м) 3оли занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиями, эмульсиями). Золи диффундируют медленнее, чем неорганические соли, обладают эффектом светорассеяния (Эффект Тиндаля). В противоположность гелям, в золях частицы дисперсной фазы не связаны в пространственную структуру, а свободно участвуют в броуновском движении. 52. Природа растворов. Коллигативные свойства растворов. Коллигативными (общими) свойствами раствора являются те свойства, которые зависят от природы растворителя и концентрации растворенного вещества, но не зависят от свойств самого растворенного вещества. К ним относятся: Относительное понижение давления насыщенного пара растворителя над раствором. Увеличение температуры кипения раствора по сравнению с чистым растворителем. Уменьшение температуры замерзания раствора по сравнению с чистым растворителем. Осмотическое давление. раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия. 53. Законы Генри и Рауля. Осмотическое давление. Закон Вант-Гоффа. Закон Рауля: Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества. закон Генри: Масса газа, растворяющегося при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа. Осмотическое давление – это такое давление, которое нужно приложить к раствору, отделенному от растворителя полупроницаемой перегородкой, чтобы наступило состояние равновесия (прекратился осмос). Осмос – самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Закон Вант-Гоффа: Для разбавл. растворов осмотическое давление независимо от рода р-теля и р-ного в-ва при данной температуре пропорциональна молярной концентрации р-ра. Используя осмитич. Давление также можно определить молек. массы р-ных в-в. Pосм=CmRT=nRT/Vр-ра=mр/мр/Vр-ра 54. Качественные и количественные характеристики растворов. Для качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит много растворенного вещества). При работе с растворами необходимо знать их количественный состав. Количественный состав растворов выражается различными способами. Мы изучим два способа: а) массовая доля растворенного вещества; б) молярная концентрация (молярность). Массовая доля растворённого вещества -это отношение массы растворённого вещества к массе раствора. Для расчёта процентной концентрации используется формула: 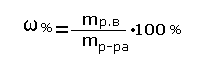 Массовая доля растворённого вещества wрастворённого вещества- это безразмерная величина, равная отношению массы растворённого вещества mрастворённого вещества к общей массе раствора mраствора : mраствора= mрастворённого вещества+ mрастворителя Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.  Молярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах. Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М.Например, раствор концентрации 1 М содержит 1 моль вещества на литр раствора. Такой раствор называют МОЛЯРНЫМ. 55. Электролиты и неэлектролиты. Классификация электролитов. Теория электролитической диссоциации. Диссоциация электролитов. Все вещества делятся на 2 большие группы: электролиты и неэлектролиты. Электролитами называются вещества (исключая металлы), растворы или расплавы которых проводят электрический ток. К электролитам относятся соединения, образованные ионными или ковалентными полярными связями. Это сложные вещества: соли, основания, кислоты, оксиды металлов (проводят электрический ток только в расплавах). Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят. К ним относятся простые и сложные вещества, образованные малополярными или неполярными ковалентными связями. Свойства растворов и расплавов электролитов впервые объяснил в конце XIXвека шведский учёный Сванте Аррениус. Им была создана специальная теория электролитической диссоциации, основные положения которой, доработанные и развитые другими учёными, в настоящее время формулируются следующим образом. Молекулы (или формульные единицы) электролитов в растворах или расплавах распадаются на положительно и отрицательно заряженные ионы. Этот процесс называется электролитической диссоциацией. Общая сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов, поэтому растворы или расплавы электролитов в целом остаются электронейтральными.Ионы могут быть какпростые, состоящие только из одного атома (Na+,Cu2+,Cl–,S2-), так исложные, состоящие из атомов нескольких элементов (SO42–,PO43–,NH4+, [Al(OH)4]–). Распад электролитов на ионы в расплавах осуществляется за счёт действия высоких температур, а в растворах за счёт действия молекул растворителя. Особенностью ионных соединений является то, что в узлах их кристаллической решётки имеются уже готовые ионы и в процессе таких веществ растворения диполям растворителя (воды) остаётся только разрушить эту ионную решётку Процесс электролитической диссоциации протекает одновременно с процессом растворения веществ, и поэтому в растворах все ионы находятся в гидратированном состоянии (окружены оболочками из молекул Н2О). Ионы электролитов в растворе или расплаве за счёт теплового движения хаотически перемещаются по всем направлениям. Но если в раствор или расплав опустить электроды и пропустить электрический ток, то положительно заряженные ионы электролита начинают двигаться к отрицательно заряженному электроду – катоду (поэтому они иначе называются катионами), а отрицательно заряженные ионы – к положительно заряженному электроду – аноду (поэтому они иначе называются анионами). Таким образом, электролиты являются проводниками второго рода. Они переносят электрический заряд за счёт направленного движения ионов. Металлы же являются проводниками первого рода, т.к. проводят электрический ток за счёт направленного движения электронов. Процесс электролитической диссоциации обратим. Наряду с распадом молекул на ионы всегда протекает обратный процесс – соединение ионов в молекулы или ассоциация. Поэтому в уравнениях реакций электролитической диссоциации веществ вместо знака равенства «=» ставят знак обратимости Степенью диссоциации называется отношение количества электролита, распавшегося на ионы (n), к общему количеству электролита (n0) В зависимости от величины степени диссоциации различают слабые и сильные электролиты. К слабым электролитам относят вещества, у которых степень диссоциации в 0,1 М растворах меньше 3%; если степень диссоциации в 0,1 М растворе превышает 30%, то такой электролит называют сильным. Электролиты, степень диссоциации которых лежит в пределах от 3% до 30%, называются электролитами средней силы. 56. Количественные характеристики электролитической диссоциации: степень диссоциации и константа диссоциации. Степенью диссоциации α называют – отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0). α = (n/n0)∙100 Процесс электролитической диссоциации характеризуют константой диссоциации(К). Так, для реакции КА К+ + А– константа диссоциации: К = [К+]∙[ А–]/[КА] Между константой и степенью электролитической диссоциации существует количественная связь. В приведенном примере общую концентрацию растворенного вещества обозначим с, а степень диссоциации α. Тогда [К+] = [А–] = α∙с и соответственно концентрация недиссоциированных частиц [КА] = (1 – α)с. 57. Закон разбавления Освальда. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:{\displaystyle \mathrm {K={\frac {c\lambda ^{2}}{\lambda _{\mathcal {1}}(\lambda _{\mathcal {1}}-\lambda )}}} } Здесь {\displaystyle \mathrm {K} }  — константа диссоциации электролита, {\displaystyle c} — константа диссоциации электролита, {\displaystyle c} — концентрация, {\displaystyle \lambda } — концентрация, {\displaystyle \lambda } и {\displaystyle \lambda _{1}} и {\displaystyle \lambda _{1}} — значения эквивалентной электропроводности при концентрации {\displaystyle c} — значения эквивалентной электропроводности при концентрации {\displaystyle c} и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства{\displaystyle \mathrm {{\frac {\lambda }{\lambda _{\mathcal {1}}}}=\alpha ,} } и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства{\displaystyle \mathrm {{\frac {\lambda }{\lambda _{\mathcal {1}}}}=\alpha ,} }где {\displaystyle \alpha }  — степень диссоциации. — степень диссоциации.Закон разбавления Оствальда выведен В.Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации. Очень важно понимать, что закон разбавления Оствальда применим только для растворов слабых электролитов, не содержащих посторонних веществ, усиливающих или подавляющих диссоциацию слабого электролита. 58. Ионное произведение воды. Водородный и гидроксильный показатели. Ионное произведение воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Водородный показатель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: Водородный показатель имеет важное значение для жизнедеятельности организма, и отклонение его от нормы приводит к расстройству его деятельности. Также рН влияет на урожайность почвы и экологию водоемов. По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10. По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10. 59. Индикаторы. Вода: особенности строения и свойств. Активированная вода. Активированной называется вода, обладающая повышенной биологической активностью. Повышенную биологическую активность имеет вода, насыщенная кислородом и его активными формами, и вода, насыщенная водородом. Основным способом получения активированной воды была электрохимическая активация. Понятие «электрохимическая активация» появилось в 1974 году, когда было установлено, что вода, получающаяся после электролиза, обладает биологической активностью [2]. На аноде образуется вода, насыщенная кислородом, на катоде – водородом. Выяснили, что это разные сорта воды, и их влияние на живые организмы принципиально отличается. На аноде образуется вода, насыщенная кислородом и его активными формами. Из стабильных активных долгоживущих форм кислорода сейчас известна перекись водорода. Кислородная вода имеет повышенный окислительно–восстановительный потенциал (ОВП) по сравнению с обычной водой. Кислородная вода стимулирует химические процессы окисления, получения энергии. Поэтому кислородная вода бодрит, улучшает обмен веществ. Молекула воды H2O несимметрична. Атомы водорода, несущие положительный заряд, смещены в одну сторону от центра молекулы, атом кислорода – в другую. В результате молекула воды представляет собой диполь: положительный заряд которого сосредоточен в одном конце молекулы, а отрицательный – в противоположном. Если молекулы окажутся ориентированными относительно друг друга разноимёнными полюсами, то они будут притягиваться Кислотно-основными индикаторами называют вещества, меняющие свою окраску в определенной области значений рН раствора. Индикаторами могут быть слабые органические кислоты НInd и основания IndOH, молекулы и ионы которых имеют разную окраску. Будучи введенными в исследуемый раствор диссоциируют по одному из следующих механизмов Так как процесс диссоциации слабых электролитов обратим, положение равновесия в системах зависит от кислотности исследуемого раствора. В кислых растворах индикаторы, представляющие собой слабые кислоты, в соответствии с принципом Ле-Шателье находятся преимущественно в виде молекул и окраска раствора соответствует молекулярной форме индикатора HInd. Индикаторы, являющиеся слабыми основаниями, в растворах кислот, напротив, будут находиться в своей ионной форме Ind+, которая обуславливает окраску раствора 60. Ионные реакции. Обратимые и необратимые реакции. ПР. Ионные реакции – реакции в растворах электролитов, при которых не происходит изменения зарядов ионов, входящих в соединения. Ионные реакции могут быть обратимыми и необратимыми: Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3H2 + N2 ⇆ 2NH3 Направление обратимых реакций зависит от концентраций веществ — участников реакции. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции. Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Необратимыминазывают такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании 2КСlО3 > 2КСl + ЗО2, Необратимыми называются такие реакции, при протекании которых: 1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа, Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O 2) образуется малодиссоциированное соединение, например вода: НСl + NаОН = Н2О + NаСl 3) реакция сопровождается большим выделением энергии, например горение магния Произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита при данной температуре есть величина постоянная (табличная), называемая произведением растворимости. Произведение растворимости позволяет регулировать процессы образования и растворения труднорастворимых веществ. Например, для |
