Химия шпоры. Химия (Ответы на вопросы). Классификация основных классов неорганических веществ. Составление формул и номенклатура химических соединений
 Скачать 489.52 Kb. Скачать 489.52 Kb.
|
|
§ если § если б) газообразных (легколетучих) веществ: например, Если эту реакцию проводить до конца в открытом сосуде, то в) слабых электролитов (малодиссоциирующих соединений): например, § образование воды: § образование слабого основания: § образование слабой кислоты: При образовании малодиссоциирующих соединений происходит связывание ионов реагирующих веществ, и растворы становятся слабыми проводниками электрического тока. г) комплексных ионов: 61. Гидролиз солей.: определение, случаи гидролиза, ступенчатый гидролиз. Гидролиз – это химическая реакция, происходящая при взаимодействии какого-либо вещества (неорганические соли, белки, аминокислоты, углеводы и др. вещества органической природы) с водой. Если соль образована слабой многоосновной кислотой или слабым многокислотным основанием, то гидролиз данной соли может протекать ступенчато. Число ступеней гидролиза зависит от основности слабой кислоты и кислотности слабого основания. Рассмотрим гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В водном растворе этих солей на первой ступени гидролиза образуется кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуются соли K2SiO3, Na2SO3, Na2S, Na3PO4 и др. Размещено на реф.рф Например, гидролиз Na2CO3 должна быть изображен в виде уравнений. Первая ступень˸ Na2CO3 + Н2О ↔ NaHCO3 + NaOH; CO32- + H2O ↔ НCO-3 + OH-. Продуктами первой ступени гидролиза является кислая соль гидрокарбонат натрия NaHCO3 и гидроксид натрия NaOH. Вторая ступень˸ NaHCO3 + Н2О ↔ Н2СО3 + NaOH; HCO-3 + Н2О ↔ Н2СО3 + ОН-. Продуктами второй ступени гидролиза карбоната натрия Na2CO3 являются гидроксид натрия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени. Среда раствора соли карбоната натрия Na2CO3 - щелочная (рН > 7), так как в растворе увеличивается концентрация гидроксид-ионов ОН-. Гидролиз солей трехосновных слабых кислот протекает по трем ступеням. В качестве примера приведем уравнения гидролиза фосфата натрия. Первая ступень˸ Na3РО4 + Н2О ↔ Na2НРО4 + NaOH; РО43- + Н2О ↔ НРО42- + NaOH. Вторая ступень˸ Na2НРО4 + Н2О ↔ NaH2PO4 + NaOH; НРО42- + Н2О ↔ H2PO-4 + ОН-. Третья ступень˸ NaH2PO4 + Н2О ↔ Н3РО4 + NaOH; Н2РО-4 + Н2О ↔ Н3РО4 + ОН-. Гидролиз по первой ступени происходит в значительно большей степени, чем по второй. По третьей ступени гидролиз фосфата натрия практически не идет. Рассмотрим гидролиз соли, образованной слабым многокислотным основанием и сильной кислотой. В водных растворах таких солей на первой ступени образуется основная соль вместо основания и сильная кислота. Ступенчатому гидролизу подвергаются соли˸ MgSO4, FeCl3, FeCl2, ZnCl2 и др. Размещено на реф.рф Например, гидролиз хлорида цинка ZnCl2 протекает по двум ступеням. Первая ступень˸ ZnCl2+ H2О ↔ ZnOHCl + HC1; Zn2+ + Н2О ↔ (ZnOH)+ + Н+. Вторая ступень˸ ZnOHCl+ H2O ↔ Zn(OH) 2 + HC1; (ZnOH)+ + Н2О ↔ Zn(OH)2 + H+. Гидролиз соли идет по катиону, так как соль образована слабым основанием Zn(OH)2 и сильной кислотой НСl. Катионы цинка Zn2+ связывают гидроксид-ионы ОН- воды. На первой ступени образуется основная соль ZnOHCl и сильная кислота НСl. На второй ступени образуется слабое основание Zn(OH)2 и тоже сильная хлороводородная кислота. Гидролиз по первой ступени протекает значительно больше, чем по второй. В растворе увеличивается концентрация ионов водорода Н+ и реакция среды будет кислая (рН <7). гидролизу подвергаются только те соли, которые образуют при диссоциации ион от слабого электролита. Соли, образованные сильными основаниями и сильными кислотами гидролизу не подвергаются. Таким образом, возможность протекания гидролиза соли определяется наличием иона от слабого электролита (от кислоты или от основания, реакцией между которыми могла быть образована данная соль). Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью, а в других случаях гидролиз идет незначительно и преимущественно по первой ступени (один моль ион слабого электролита взаимодействует только с одним молем молекул воды). Реакцию среды при гидролизе можно определить по иону сильного электролита. Если соль образована катионом сильного основания и анионом слабой кислоты(S2-, CO32-, CN-и др.), то происходит гидролиз по аниону, а среда будет щелочной. Процесс гидролиза протекает тем интенсивнее, чем слабее электролит, образовавший соль в процессе реакции нейтрализации. Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону, а среда будет кислотной. Гидролиз солей, образованных слабым основанием и слабой кислотой, протекает достаточно глубоко (практически полностью). Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды в присутствии ионов соли почти не нарушается. Поэтому растворы таких солей практически нейтральную реакцию среды. 62. Смещение равновесия гидролиза солей. Количественные характеристики гидролиза: степень и константа гидролиза. Процессы, сопутствующие гидролизу. гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества. Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя. Степень гидролиза— это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ. Обычно, ее обозначают через hгидр (или α ): hгидр = (nидр/nобщ)·100 % Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания. Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов. Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие. Является количественной характеристикой гидролиза. Факторы, влияющие на степень протекания гидролиза. Необратимый гидролиз. Степень гидролиза – отношение части соли, подвергающейся гидролизу к общей концентрации её ионов в растворе. Температура, то есть повышение температуры смещает равновесие в системе вправо. Степень гидролиза возрастает ( так как реакция гидролиза эндотермическая) Концентрация продуктов гидролиза в соответствии с принципом Ле Шателье рост концентрации продуктов гидролиза вызывает смещение равновесия влево. Степень гидролиза будет уменьшаться. Для гидролиза по катиону (слаб. Осн., сильн. кис-та) добавление катионов H (подкисление растовра) гидролиз подавляет. Для гидролиза по аниону (сильн.осн., слаб.кис-та) добавление гидроксид-ионов (подщелачивание растворов) так же вызывает подавление гидролиза). Концентрация соли. Увеличение подавляет гидролиз, степень уменьшается. Разбавление. При разбавлении растворов слей равновесие смещается вправо, следовательно степень гидролиза возрастает. Добавка посторонних веществ. Посторонние вещества влияют на положение равновесия только в том случае, если взаимодействуют с одним из участников реакции. Гидролиз считается необратимым тогда, когда гидролизу подвергаются соли, образованные слабой кислотой и слабым основанием, ионы этой соли одновременно связывают ионы Н+ и ОН–, смещая равновесие диссоциации воды. Так как гидролиз большинства солей является обратимым процессом, то степень гидролиза можно изменять, смещая равновесие реакций гидролиза и нейтрализации. Важнейшими факторами, влияющими на степень гидролиза, являются следующие: 1) константа диссоциации кислоты или основания, образующих соль, 2) общая концентрация соли, 3) температура, 4) рН раствора. Влияние первого фактора видно из формулы Кг= К  /Кдисс (табл.2). Константа гидролиза тем больше, чем меньше Кдисс. электролита, то есть чем слабее образующийся электролит, тем сильнее гидролизуется соль. Из уравнения h =  следует, что разбавление раствора усиливает гидролиз, а повышение концентрации соли подавляет его. Влияние температуры на степень, гидролиза можно вывести из принципа Ле -Шателье. Реакция нейтрализации экзотермична, следовательно, гидролиз, (обратный ей процесс) эндотермичен, как и диссоциация воды. Поэтому при повышении температуры раствора гидролиз усиливается, охлаждение раствора подавляет гидролиз. К числу таких реакций относятся взаимодействия солей двухвалентных катионов (кроме Ca2+, Sr2+, Ba2+) с водными растворами карбонатов натрия или калия, сопровождающиеся образованием осадков менее растворимых основных кар-бонатов 2Cu(NO3)2 + 2Na2CO3 + H2O => Cu2(OH)2CO3¯ + 4NaNO3 + CO2↑ А также реакции взаимодействия солей Al3+, Cr3+ и Fe3+ (*При взаимодействии водных растворов солей трёхвалентного железа с сульфидами щелочных металлов протекает окислительно-восстановительная реакция: 2Fe3+ + S2- => 2Fe2+ + S0) с водными растворами карбонатов и сульфидов щелочных металлов: 2AlCl + 3Na2CO3 + 3H2O => 2Al(OH)3¯ + 3CO2↑ + 6NaCl 63. Характерные особенности окислительно-восстановительных реакций, окислители и восстановители. Типы ОВР. Методы уравнивания ОВР. К окислительно-восстановительным реакциям относятся такие, которые сопровождающиеся перемещением электронов от одних частиц к другим. Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление - это процесс отдачи электронов атомом, ионом или молекулой реагента. Вещества, которые отдают свои электроны в процессе реакции и при этом окисляются, называют восстановителями. Восстановление – это процесс принятия электронов атомом, ионом или молекулой реагента. Вещества, которые принимают электроны и при этом восстанавливаются, называют окислителями. Реакции окисления-восстановления всегда протекают как единый процесс, называемый окислительно-восстановительной реакцией. Например, при взаимодействии металлического цинка с ионами меди восстановитель (Zn) отдает свои электроны окислителю – ионам меди (Cu2+): Zn + Cu2+  Zn2+ + Cu Различают четыре типа окислительно-восстановительных реакций: 1. Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ. Реакции, рассмотренные в примерах 2-6, относятся к этому типу. 2. Внутримолекулярные окислительно-восстановительные реакции, при которых степень окисления изменяют атомы разных элементов одного и того же вещества. По такому механизму протекают реакции термического разложения соединений. Например, в реакции +5 -2 +4 0 Pb(NO3)2 ® PbO + NO2 + O2 изменяет степень окисления азот (N+5 ® N+4) и атом кислорода (О-2 ® О20), находящиеся внутри молекулы Pb(NO3)2. 3. Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации). В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционирования характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента. Существует несколько способов подбора коэффициентов в уравнениях ОВР, из которых наиболее распространены метод электронного баланса и метод ионно-электронных уравнений (иначе метод полуреакций). Оба метода основаны на реализации двух принципов: 1. Принцип материального баланса – число атомов всех элементов до и после реакции должно быть одинаковым; 2. Принцип электронного баланса – число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. 64. Стандартный электродный потенциал. Ряд напряжений металлов. Разность потенциалов, возникающую между металлом и окружающей его водной средой, называют электродным потенциалом. Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu2+/Eu[источник не указан 2084 дня] до +1,691 В у пары Au+/Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au+. В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода. Ряд напряжений используется на практике для сравнительной [относительной] оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе: Металлы, стоящие левее водорода, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой. Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют. При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей. 65. Окислительно-восстановительный потенциал. Окислительно-восстановительный потенциал (ОВП) – это параметр, описывающий уровень окисления (оксидации) и восстановления вещества. Другими словами, это способность отдавать или принимать электроны в результате взаимодействия химических элементов в зависимости от природы процессов и условий протекания реакций. Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение , так и окисленное соединение . Если полуреакцию восстановления представить уравнением: Aox + n·e− → Ared, то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста. Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях 66. Уравнение Нернста. Направление ОВР. Влияние среды на ОВР. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. , В зависимости от рН среды меняется характер протекания окислительно-восстановительного процесса между одними и теми же реагентами. Например, взаимодействие восстановителя сульфита натрия Na2SO3 с окислителем перманганатом калия KMnO4 в кислотной (рН < 7), нейтральной (pH = 7) и щелочной (pH >7 ) среде приводит к образованию различных продуктов Прибавление к раствору кислоты (понижение рН) вызывает увеличение концентрации ионов Н+ и в соответствии с принципом Ле Шателье смещает равновесие в сторону обратной реакции. Прибавление раствора щелочи (повышение рН) смещает равновесие в направлении прямой реакции. 67. Связь энергии Гиббса со стандартным электродным потенциалом. Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу молей вещества n в системе: Если система состоит из частиц нескольких сортов с числом молей частиц каждого сорта, то соотношения Гиббса-Дюгема приводят к выражению Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов. Так, исходя из соотношений Гиббса — Дюгема и из условий равенства химических потенциалов находящихся в равновесии друг с другом фаз, можно получить уравнение Клапейрона — Клаузиуса, определяющее линию сосуществования двух фаз в координатах через термодинамические параметры (удельные объёмы) фаз и теплоту перехода между фазами Если пластинку металла М погрузить в раствор, содержащий его ионы Мn+(р) + nе- = М(к) то между металлом и раствором возникнет разность потенциалов, называемая электродным потекциалом. Эта разность зависит от природы металла и концентрации (точнее активности) ионов в растворе, а также от температуры и pH среды. Связь между энергией Гиббса ΔG и электродным потенциалом φ выражается уравнением: — ΔG = nFφ, где n — количество передаваемого электронами вещества, F — постоянная Фарадея. 68. Определение и классификация электрохимических явлений. Гальванические элементы: классификация, электродные процессы, схемы. Электрохимическими процессами называют процессы взаимного превращения химической и электрической форм энергии. К электрохимическим процессам относятся: Возникновение разности потенциалов и, следовательно, постоянного электрического тока в результате протекания химической реакции. Устройства, в которых реализуется это явление, называют химическими источниками тока (например, гальванические элементы, аккумуляторы). Химические процессы, протекающие при пропускании постоянного электрического тока через электролит. Это явление называют электролизом, а устройства, в которых оно реализуется – электролизерами. Электрохимический процесс может быть обратимым, т.е. протекать в одном или другом направлении в зависимости от условий (примером такой обратимости являются заряжение и разряд аккумулятора). Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. Ионным проводником служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Гальванические элементы можно разделить на две группы: а) химические гальванические элементы; б) концентрационные гальванические элементы. Химические гальванические элементы (например, гальванические элемент Даниэля - Якоби, Вестона) состоят из двух различных электродов, помещенных в растворы электролитов одинаковой концентрации. Для этих гальванических элементов характерно превращение энергии химической реакции в энергию электрического тока. К этой группе гальванических элементов принадлежит и гальванический элемент Вестона, используемый в качестве гальванического элемента - эталона. Концентрационные гальванические элементы состоят из двух одинаковых электродов, помещенных в растворы различных концентраций. Опыт показывает, что электрод, погруженный в менее концентрированный раствор, является отрицательным электродом, а другой, погруженный в более концентрированный раствор - положительным. Сопоставление опытных фактов приводит к заключению о том, что в основе работы всякого гальванического элемента лежат окислительно - восстановительные реакции, протекающие раздельно: на отрицательном электроде (аноде) - окисление, а на положительном (катоде) - восстановление. При обозначении устройства гальванических элементов пользуются условной записью: вертикальными черточками обозначаются поверхности раздела фаз. Потенциал, возникающий на границе раздела двух растворов называется диффузионным. Чтобы подчеркнуть его отсутствие, в условной записи элемента используется двойная вертикальная черта: Zn | ZnSO4 || CuSO4 | Cu К электрохимическим процессам относятся: 1) возникновение разности потенциалов и, следовательно, постоянного электрического тока в результате протекания химической реакции.Устройства, в которых реализуется это явление, называют химическими источниками тока (например, гальванические элементы, аккумуляторы); 2) химические процессы, протекающие при пропускании постоянного электрического тока через электролит. Это явление называют электролизом, а устройства, в которых оно реализуется, – электролизерами. Электрохимический процесс может быть обратимым, т.е. протекать в одном или другом направлении в зависимости от условий (примером такой обратимости являются разряд и заряд аккумулятора). Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. Ионным проводником служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Электродные процессы– процессы, связанные с переносом зарядов через границу между электродом и раствором. Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с растворением металла электрода. Возможность протекания того или иного электродного процесса в общем случае определяется изменением ΔH и ΔS в ходе соответствующей химической реакции. Зная эти изменения, по уравнению Гельмгольца можно рассчитать минимальную величину напряжения, которое необходимо наложить на электроды для протекания данного электродного процесса. 69. Определение ЭДС гальванического элемента. Элемент Даниэля-Якоби. Устройство и принцип работы свинцового кислотного и железоникелевого щелочного аккумуляторов. Гальванический элемент состоит из двух электродов — анода и катода. Его устройство и принцип работы рассмотрим на примере элемента Даниэля-Якоби. В этом элементе используют медный и цинковый электроды. Каждый электрод помещен в ёмкость с раствором электролита, катионы которых "одноимённый" материалу электрода. Ёмкости разделены перегородкой. Цинковый электрод опущен в раствор ZnSO4.При замыкании цепи гальванического элемента между электродом и раствором электролита идёт реакция окисления: 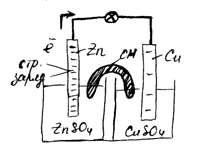 Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны; таким образом цинковая пластинка заряжается отрицательно и становится анодом. Возникает отрицательный электродной потенциал Между медным электродом и окружающем его раствором CuSO4 идёт реакция восстановления: Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом. Электродный потенциал его будет равен Рассмотрим гальванический элемент Якоби-Даниэля. Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. Схема гальванического элемента: Zn | ZnSO4| | CuSO4| Cu, Zn | Zn2+ | | Cu2+ | Cu. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие: Zn-2e « Zn2+. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие: Сu2+ + 2е « Сu, поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди. Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь). Итак, при работе элемента Якоби-Даниэля протекают следующие процессы: 1) реакция окисления цинка: Zn - 2е ® Zn2+. Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами; 2) реакция восстановления ионов меди: Сu2+ + 2е « Сu. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами; движение электронов во внешней цепи; движение ионов в растворе: анионов (SO4-2) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем: Zn + Cu2+ = Zn2+ + Сu. Аккумулятор – химический источник тока, обладающий способностью накапливать и сохранять в течение некоторого времени электрическую энергию и по мере необходимости отдавать её во внешнюю цепь. Аккумулятор сам не производит электрическую энергию. Он только накапливает её при заряде: пропускание тока от постороннего источника сопровождается превращением электрической энергии в химическую, в результате, аккумулятор сам становится источником тока. В зависимости от состава электролита различают: · кислотные · и щелочные аккумуляторы. Простейший кислотный аккумулятор состоит из двух свинцовых электродов, погруженных в раствор серной кислоты.  Процессы, проходящие в кислотном аккумуляторе, можно представить следующим уравнением: PbO2+Pb+2H2SO4 2PbSO4+2H2O РbO2 –порошок перекиси свинца; Щелочные аккумуляторы. Наиболее распространены никель-железные (НЖ) и никель-кадмиевые (НК) щелочные аккумуляторы. В тех и других активная масса положительного электрода в заряженном состоянии состоит из гидрата окиси никеля NiOOH, к которому добавляют графит и окись бария. Графит увеличивает электропроводность активной массы, а окись бария – срок службы. Активная масса отрицательного электрода никель-железного аккумулятора состоит из порошкового железа с добавками, а никель-кадмиевого аккумулятора из смеси порошкового кадмия и железа. Электролитом служит раствор едкого калия с примесью моногидрата лития, которая увеличивает срок службы аккумулятора. Электрохимические реакции, протекающие при заряде и разряде щелочного аккумулятора, можно представить следующими уравнениями: 2Ni(OOH)+2KOH+Fe  2Ni(OH)2+2KOH+Fe(OH)2 Разность потенциалов катода и анода называется электродвижущей силой (ЭДС) гальванического элемента и вычисляется по формуле: ЭДС = Eкат. – Eан. 70. Схема цинк-марганиевой батареи. Марганцево-цинковый элемент, также известный как элемент Лекланше — это первичный химический источник тока, в котором катодом является диоксид марганца MnO2 (пиролюзит) в смеси с графитом (около 9,5 %), электролитом — раствор хлорида аммония NH4Cl, анодом — металлический цинк Zn Является самым известным первичным элементом (батарея одноразового использования), который сегодня широко используется в переносных устройствах. Изначально элементы заполнялись жидким электролитом. В дальнейшем электролит стали загущать с помощью крахмалистых веществ — это позволяло сделать более практичные элементы питания, называемые сухими, в которых сведена к минимуму возможность вытекания электролита. При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции: Анод: Zn → Zn 2+ + 2e− На угольном стержне электроны расходуются на восстановление H3O+-ионов: Катод: 2H3O+ + 2e− → H2 + 2H2O Ионы H3O+ образуются в результате частичного протолиза NH4+-ионов электролита: NH4+ + H2O ↔ H3O+ + NH3 При восстановлении H3O+-ионов образуется водород, который не может удалиться (корпус герметичен) и образует вокруг угольного стержня прослойку газа (поляризация угольного электрода). Ток медленно затухает. Чтобы избежать образования водорода, угольный электрод окружают слоем диоксида марганца (MnO2). В присутствии диоксида марганца H3O+-ионы восстанавливаются с образованием воды: 2MnO2 + 2H3O+ + 2e− → 2MnO (OH) + 2H2O В качестве электродов в «сухом элементе» выступают цинковый стакан и угольный стержень. Поэтому сухой элемент называют ещё угольно-цинковым элементом. Положительным электродом «+» является угольный стержень, отрицательным — цинковый стакан. Угольный стержень окружен смесью диоксида марганца MnO2 и угля (сажи). В качестве электролита выступает раствор хлорида аммония NH4Cl с небольшой добавкой хлорида цинка ZnCl2 71. Электролиз: определение, катодные и анодные процессы. Электролиз расплавов и растворов с активными и инертными анодами. Электролиз— совокупность окислительно-восстановительных процессов, протекающих на электродах при прохождении электрического тока через расплав или раствор электролита. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду. На катоде, происходит процесс восстановления (принятие электронов). На аноде идет процесс окисления (отдача электронов). |
