Классификация углеводов
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
Глава 5. Углеводы Углеводы относятся к органическим соединениям, содержащим в молекуле одновременно альдегидную или кетонную группу и несколько спиртовых групп. Другими словами, углеводы являются многоатомными альдегидоспиртами (полиоксиальдегидами) или многоатомными кетоспиртами (полиоксикетонами). Химия углеводов – одна из наиболее сложных и важных областей органической химии. Углеводы – довольно обширная группа природных веществ, которые играют большую роль в жизни человека, животных и растений. Они широко распространены в природе, особенно в растительном мире, и составляют основную массу органического вещества нашей планеты. Огромна роль углеводов в процессах, связанных с жизнедеятельностью живых организмов. Установлено, что они входят в состав нуклеотидов, из которых построены нуклеиновые кислоты, осуществляющие биосинтез белка и передачу наследственных свойств. Термин «углеводы» (предложен в 1844 г. К.Шмидтом) возник потому, что эти вещества по составу отвечали сочетанию углерода с водой, например: С6Н12О6 = 6С + 6Н2О. Хотя позднее были найдены углеводы, не соответствующие указанному составу, этот термин сохранился. Классификация углеводов. Все углеводы можно разделить на две основные группы. I. Простые углеводы, или моносахариды (монозы), - вещества, не способные подвергаться гидролизу. В зависимости от числа углеродных атомов в молекуле моносахарида различают тетрозы (С4), пентозы (С5), гексозы (С6), гептозы (С7). Если моносахариды содержат альдегидную группу, то они относятся к классу альдоз (альдегидоспиртов), если кетонную – к классу кетоз (кетоспиртов). II. Сложные углеводы – вещества, способные гидролизоваться и распадаться при этом с образованием моносахаридов. Сложные углеводы в свою очередь подразделяются на: олигосахариды – низкомолекулярные сахароподобные углеводы, растворимые в воде и сладкие на вкус; простейшими из них являются дисахариды (биозы), состоящие из двух остатков моносахаридов; полисахариды – высокомолекулярные, несахароподобные углеводы (высшие полисахариды), не сладкие на вкус и нерастворимые в воде. Они представляют собой природные полимеры (биополимеры). В зависимости от состава полисахариды можно разделить на две группы: а) гомополисахариды, состоящие из остатков одного и того же моносахарида; б) гетерополисахариды, состоящие из остатков различных моносахаридов. У 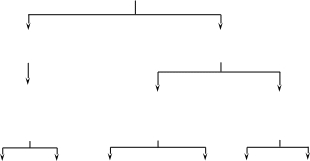 глеводы глеводыпростые углеводы сложные углеводы (моносахариды, или монозы) (полисахариды, или полиозы) тетрозы С4 низкомолекулярные высокомолекулярные понтозы С5 сахароподобные углеводы несахароподобные гексозы С6 (олигосахариды) углеводы (полиозы)
1. Моносахариды (монозы) Общая формула моносахаридов СnH2nOn. Различают моносахариды по количеству атомов углерода в молекуле и по химической природе. В соответствии с числом углеродных атомов в молекуле моносахариды разделяют на тетрозы, пентозы, гексозы, гептозы и т.д. В природе распространены почти исключительно пентозы и гексозы, однако редко встречающиеся гептозы и нонозы также играют важную роль в биологических процессах. В зависимости от характера оксогрупп, входящих в состав моносахаридов, последние делятся на альдозы и кетозы. И     з альдопентоз наиболее широко распространены рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот: з альдопентоз наиболее широко распространены рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот: D-рибоза 2-дезокси-D-рибоза И  з альдогексоз широко известны глюкоза, манноза и галактоза: з альдогексоз широко известны глюкоза, манноза и галактоза:D-глюкоза D-манноза D-галактоза D-глюкоза и D-манноза отличаются друг от друга конфигурацией лишь у асимметрического атома углерода, соседнего с карбонильной группой. Такие моносахариды называют эпимерами. Наиболее распространённая кетоза – фруктоза:    D-псикоза D-фруктоза D-сорбоза При рассмотрении свойств альдегидов и кетонов отмечалась их способность при взаимодействии со спиртовыми группами давать полуацетали. Карбонильная группа моносахарида также может взаимодействовать с одной из спиртовых групп с образованием полуацеталя. В результате внутримолекулярной перестройки образуется более устойчивые структуры – шестичленные или пятичленные кольца. В  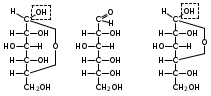 этом превращении вместе с карбоксильной группой альдогексозы могут принимать участие либо -гидроксил, либо -гидроксил. В первом случае образуется пятичленный гетероцикл, отвечающий строению фурана, и структура называется «фураноза», а во втором – шестичленный гетероцикл пирана , и структура называется «пираноза». Например, для глюкозы возможны следующие структуры: этом превращении вместе с карбоксильной группой альдогексозы могут принимать участие либо -гидроксил, либо -гидроксил. В первом случае образуется пятичленный гетероцикл, отвечающий строению фурана, и структура называется «фураноза», а во втором – шестичленный гетероцикл пирана , и структура называется «пираноза». Например, для глюкозы возможны следующие структуры:глюкопираноза D-глюкоза глюкофураноза У 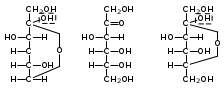 фруктозы происходит аналогичная циклизация: фруктозы происходит аналогичная циклизация:фруктопираноза D-фруктоза фруктофураноза Из карбонильного кислорода образовался новый гидроксил, связанный с углеродом, у которого ещё одна валентность затрачена на связь с кислородом (замкнувшим окисную цепочку) – полуацетальный гидроксил (выделен рамкой). Полуацетальный гидроксил отличается от всех других гидроксильных групп повышенной химической активностью, так как под влиянием второго кислорода, связанного с тем же атомом углерода, его подвижность сильно возрастает. П 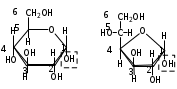 риведённые проекционные формулы Фишера не дают полного представления о пространственном расположении всех частей молекулы моносахарида. Для более наглядного изображения пространственной конфигурации молекул моносахаридов Хеуорзс предложил перспективные формулы циклических структур. Атомы углерода в цикле не пишутся, а только нумеруются, атомы и группы атомов, расположенные справа, помещаются внизу кольца, а расположенные слева – над кольцом (за исключением атома Н у углеродного атома, участвующего в замыкании кольца, который пишется внизу). Сторона кольца, расположенная ближе к наблюдателю, отмечается обычно более жирными линиями: риведённые проекционные формулы Фишера не дают полного представления о пространственном расположении всех частей молекулы моносахарида. Для более наглядного изображения пространственной конфигурации молекул моносахаридов Хеуорзс предложил перспективные формулы циклических структур. Атомы углерода в цикле не пишутся, а только нумеруются, атомы и группы атомов, расположенные справа, помещаются внизу кольца, а расположенные слева – над кольцом (за исключением атома Н у углеродного атома, участвующего в замыкании кольца, который пишется внизу). Сторона кольца, расположенная ближе к наблюдателю, отмечается обычно более жирными линиями: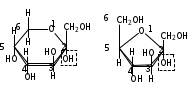 -D-глюкопираноза -D-глюкофураноза -D-глюкопираноза -D-глюкофураноза-D-фруктопираноза -D-фруктофураноза 1.1. Стереоизомерия моносахаридов. Для моносахаридов характерно большое число стереоизомеров. Это объясняется тем, что в состав молекул входит несколько асимметрических атомов углерода (С*). При рассмотрении формул строения альдо- и кетогексоз видно, что альдоза имеет четыре асимметрических атома углерода, а кетоза три:   D(+)-глюкоза L(-)-глюкоза D(+)-глюкоза L(-)-глюкозаD(-)-фруктоза L(+)-фруктоза Для глюкозы (а также маннозы и галактозы) D-конфигурация совпадает с правым вращением (+), а L – с левым (-). Однако левовращающая фруктоза относится к D-ряду, а правовращающая – к L-ряду. Принадлежность к D- или L-ряду определяется положением гидроксила при самом удалённом от карбонильной группы асимметричном атоме углерода: если у этого атома гидроксил соответствует гидроксилу D-глицеринового альдегида, то соединение относится к D-ряду. Истинное направление вращения плоскости поляризации света в растворе зависит от влияния атомов водорода и гидроксильных групп всех асимметрических атомов углерода молекулы и обычно определяется экспериментально. В растениях содержатся главным образом D-изомеры моносахаридов и их производные. При образовании циклической формы моносахаридов атом углерода бывшей карбонильной группы также становится асимметрическим. В связи с этим появляются новые стереоизомеры, определяемые по взаимному расположению полуацетального гидроксила и атома водорода относительно плоскости кольца. Эти стереоизомеры называют аномерами (от греч. ano – вверху) и обозначают как - и -формы. -аномерами считают те изомеры, у которых полуацетальный гидроксил находится в том же положении, что и у атомов углерода С2 у глюкозы или С4 у фруктозы. У -аномеров эти гидроксилы расположены по разные стороны от плоскости кольца.   -D-глюкопираноза -D-глюкопираноза -D-глюкопираноза -D-глюкопираноза-D-фруктофураноза -D-фруктофураноза 1.2. Таутомерия моносахаридов. В кристаллическом состоянии глюкоза имеет пиранозную форму. В растворе под влиянием растворителя часть молекул через открытую альдегидную форму превращается в фуранозную, давая уже не только исходную, например, -форму, но и её аномер – -форму. Переход одной формы в другую происходит непрерывно до достижения динамического равновесия. Таким образом, обычный раствор глюкозы представляет собой равновесную систему, состоящую из пяти изомерных форм. При этом на долю -D-глюкопиранозы приходится в этой смеси более 35 %, на -D-глюкопиранозы – более 63 %, ациклических молекул – менее 1 % и остальное составляют обе глюкофуранозы. Все эти формы связаны взаимными переходами – таутомерными превращениями.  -D-глюкопираноза -D-глюкопираноза открытая форма -D-глюкофураноза -D-глюкофураноза Ход таутомерного превращения можно проследить по изменению оптической активности растворов моносахаридов во времени; это явление называется мутаротацией ( от лат. muto – изменяю, rotatio – вращение). Так, первоначальное удельное вращение растворов -D-глюкопиранозы, равное +112,2, а -D-глюкопиранозы, равное +18,7, со временем достигает постоянной величины +52,7 вследствие образования равновесной системы (36 % -аномера и 64 % -аномера). 1.3. Номенклатура Для моносахаридов и вообще углеводов обычно используют тривиальные названия с характерным окончанием –оза, что означает сахар. Согласно номенклатуре ЮПАК для кетоз используется окончание –улоза. Зеркальные изомеры имеют одинаковые названия, отличающиеся символами D и L. Если известна оптическая активность, то после принадлежности к D или L ряду указывается знак вращения плоскости поляризации света: правое (+) или левое (-).    В названиях циклических форм моносахаридов после префикса (глюко-, рибо-, фрукто- и т.п.) указывается тип кольца. Моносахариды, имеющие пятичленное кольцо, называют фуранозами, шестичленное – пиранозами. В начале названия указывается конфигурация при аномерном атоме С1 ( или ). Например: В названиях циклических форм моносахаридов после префикса (глюко-, рибо-, фрукто- и т.п.) указывается тип кольца. Моносахариды, имеющие пятичленное кольцо, называют фуранозами, шестичленное – пиранозами. В начале названия указывается конфигурация при аномерном атоме С1 ( или ). Например: D-ксилулоза D(-)-гуллоза L(-)-глюкоза D-ксилулоза D(-)-гуллоза L(-)-глюкоза -D-глюкопираноза -D-фруктофураноза 1.4. Физические свойства. Моносахариды – бесцветные кристаллические или вязкие сиропообразные вещества. Благодаря возможности образования водородных связей между многочисленными гидроксильными группами сахара, как правило, образуют более твёрдые кристаллы, чем обычные органические соединения. Гигроскопичны, хорошо растворимые в воде, умеренно растворимы в этаноле и совсем нерастворимы в эфире, хлороформе, бензоле. Водные растворы имеют нейтральную реакцию среды. При нагревании разлагаются, превращаясь в прозрачную стеклообразную массу (карамелизуются). Важной особенностью сахаров является их сладкий вкус. 1.5. Химические свойства Химические свойства моносахаридов определяются тем, что они являются полиоксиальдегидами или полиоксикетонами, а также их таутомерными циклическими, полуацетальными структурами. Моносахариды – химически активные вещества, чрезвычайно реакционноспособные, образуют производные, как за счёт карбонильных, так и за счёт спиртовых групп. Важное биологическое и техническое значение имеют сложные и многообразные реакции, протекающие при участии биологических катализаторов – ферментов (например, брожение). I. Реакции ациклических форм моноз. 1  . Реакции окисления. Осторожное окисление альдоз с применением мягких окислителей (бромная вода) переводит альдегидную группу в карбоксильную, при этом образуются одноосновные полиоксикислоты – альдоновые кислоты (глюконовая, рибоновая, галактоновая и т.п.). Более сильные окислители (концентрированная азотная кислота) превращают в карбоксил и первичную спиртовую группу. В этом случае образуются двухосновные полиоксикислоты, называемые сахарными кислотами при окислении глюкозы получается сахарная кислота, галактозы – слизевая кислота, маннозы – маннаровая кислота): . Реакции окисления. Осторожное окисление альдоз с применением мягких окислителей (бромная вода) переводит альдегидную группу в карбоксильную, при этом образуются одноосновные полиоксикислоты – альдоновые кислоты (глюконовая, рибоновая, галактоновая и т.п.). Более сильные окислители (концентрированная азотная кислота) превращают в карбоксил и первичную спиртовую группу. В этом случае образуются двухосновные полиоксикислоты, называемые сахарными кислотами при окислении глюкозы получается сахарная кислота, галактозы – слизевая кислота, маннозы – маннаровая кислота):D-глюконовая кислота D-глюкоза D-сахарная кислота При качественных реакциях на глюкозу (реакция серебряного зеркала, реакция с фелинговой жидкостью и гидроксидом меди) также происходит окисление альдоз. В этом проявляются их восстанавливающие свойства: способность восстанавливать металлы из их оксидов и гидроксидов.   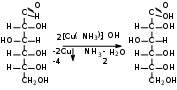 глюкоза глюконовая кислота глюкоза глюконовая кислота2  . Циангидриновый синтез. Синильная кислота способна присоединяться к альдегидной группе альдозы. При этом углеродная цепь удлиняется на один атом, а также возникает новый асимметрический центр. Эта реакция имеет большое значение, так как позволяет переходить от низших сахаров к высшим (от пентоз к гексозам и т.д.): . Циангидриновый синтез. Синильная кислота способна присоединяться к альдегидной группе альдозы. При этом углеродная цепь удлиняется на один атом, а также возникает новый асимметрический центр. Эта реакция имеет большое значение, так как позволяет переходить от низших сахаров к высшим (от пентоз к гексозам и т.д.):D-глюкоза -нитрил глюкогептоновая кислота D-глюкогептоновой кислоты 3. Образование озазонов. При нагревании глюкозы с избытком фенилгидразина образуется фенилгидразон – продукт замещения карбонильного кислорода на остаток фенилгидразина. Затем окисляется гидроксил, соседний с карбонильной группой, и вновь образовавшаяся С=О-группа реагирует с ещё одной молекулой фенилгидразина:   D-глюкоза фенилгидразон глюкозы D-глюкоза фенилгидразон глюкозыозазон глюкозы Полученные таким образом соединения называются озазонами. Они отличаются способностью образовывать окрашенные в жёлтый или оранжевый цвет кристаллы, форма и температура плавления которых позволяет установить, из какого сахара данный озазон получен. Манноза, глюкоза и фруктоза дают один и тот же озазон. 4  . Восстановление. Осторожное восстановление моносахаридов (боргидридом натрия, литийалюминийгидридом или водородом в присутствии никеля) переводит карбонильную группу в карбинольную, а моносахарид восстанавливается в соответствующий многоатомный спирт: глюкоза – в сорбит, манноза – в манит, галактоза – в дульцит, арабиноза – в арабит, ксилоза – в ксилит, рибоза – в рибит и т.п. . Восстановление. Осторожное восстановление моносахаридов (боргидридом натрия, литийалюминийгидридом или водородом в присутствии никеля) переводит карбонильную группу в карбинольную, а моносахарид восстанавливается в соответствующий многоатомный спирт: глюкоза – в сорбит, манноза – в манит, галактоза – в дульцит, арабиноза – в арабит, ксилоза – в ксилит, рибоза – в рибит и т.п. D-глюкоза D-сорбит D-фруктоза D-маннит Сахарные спирты имеют сладкий вкус, широко распространены в растениях и находят большое применение как заменители сахара в пище больных сахарным диабетом. 5. Образование сахаратов. Моносахариды взаимодействуют с гидроксидами, а также оксидами тяжёлых металлов подобно многоатомным спиртам. При этом водороды гидроксильных групп замещаются на металл и образуются производные моносахаридов – сахараты:  D-глюкоза сахарат меди 6  . Гидролитическая циклизация моносахаридов. При нагревании моносахаридов с разбавленной серной кислотой происходит их дегидратация с образованием непредельного гетероциклического альдегида. В результате такого воздействия на пентозы получается фурфурол, а на гексозы – оксиметилфурфурол: . Гидролитическая циклизация моносахаридов. При нагревании моносахаридов с разбавленной серной кислотой происходит их дегидратация с образованием непредельного гетероциклического альдегида. В результате такого воздействия на пентозы получается фурфурол, а на гексозы – оксиметилфурфурол: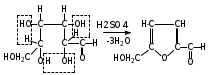 пентоза фурфурол пентоза фурфуролгексоза -оксиметилфурфурол II. Реакции циклических форм моносахаридов. 1 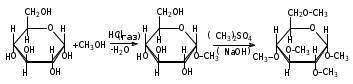 . Реакции алкилирования. Действие алкилирующих агентов на моносахариды приводит к образованию неполных и полных простых эфиров. При этом наиболее активно взаимодействует полуацетальный гидроксил. В результате образуются простые эфиры – гликозиды (в случае глюкозы – глюкозиды): . Реакции алкилирования. Действие алкилирующих агентов на моносахариды приводит к образованию неполных и полных простых эфиров. При этом наиболее активно взаимодействует полуацетальный гидроксил. В результате образуются простые эфиры – гликозиды (в случае глюкозы – глюкозиды):-D-глюкоза О-метил--D-глюкозид пента-О-метил- --D-глюкоза 2 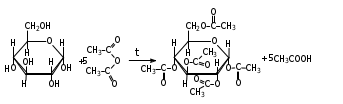 . Реакции ацилирования. При взаимодействии моносахаридов с ангидридами или галогенангидридами кислот образуются полные сложные эфиры: . Реакции ацилирования. При взаимодействии моносахаридов с ангидридами или галогенангидридами кислот образуются полные сложные эфиры:-D-глюкопираноза пентаацил--D-глюкопираноза 3  . Образование сложных эфиров с минеральными кислотами. Большое значение имеют эфиры с ортофосфорной кислотой – сахарофосфаты. Они участвуют в таких важных процессах, как фотосинтез, дыхание, синтез полисахаридов, брожение и многих других. Фосфаты D-рибозы и 2-дезоксирибозы – структурные фрагменты нуклеиновых кислот. . Образование сложных эфиров с минеральными кислотами. Большое значение имеют эфиры с ортофосфорной кислотой – сахарофосфаты. Они участвуют в таких важных процессах, как фотосинтез, дыхание, синтез полисахаридов, брожение и многих других. Фосфаты D-рибозы и 2-дезоксирибозы – структурные фрагменты нуклеиновых кислот.-D-глюкоза глюкоза-6-фосфат 4. Брожение моносахаридов. Брожением называется процесс распада органических веществ под влиянием ферментов, выделяемых микроорганизмами. Ферменты, являясь специфическими биологическими катализаторами, способны активизировать определённые химические реакции. Поэтому различные микроорганизмы выделяют ферменты, разлагающие те или иные вещества до различных конечных продуктов. По этим продуктам обычно и различают виды брожения: спиртовое, молочнокислое, маслянокислое, лимоннокислое. Спиртовое брожение вызывается дрожжевыми грибами Saccharomyces cerevisiae. При этом глюкоза, фруктоза и некоторые другие гексозы разлагаются до этанола и углекислого газа: С6Н12О6 2СО2 + 2 СН3–СН2–ОН Процесс брожения моносахаридов широко используется в технике для получения продуктов, применяемых в больших количествах в различных отраслях промышленности. М  олочнокислое брожение широко используется для получения молочной кислоты: олочнокислое брожение широко используется для получения молочной кислоты:глюкоза молочная кислота Маслянокислому брожению подвергаются сахаросодержащие вещества в анаэробных условиях, например в болотах, на дне озёр. С6Н12О6 СН3 – СН2 – СН2 – СООН + 2СО2 + 2 Н2 Л  имоннокислому брожению подвергаются многие моносахариды, а также дисахариды, при этом происходит изомеризация углеродного скелета молекулы сахара: имоннокислому брожению подвергаются многие моносахариды, а также дисахариды, при этом происходит изомеризация углеродного скелета молекулы сахара:глюкоза лимонная кислота 1.6. Способы получения В  о многих растениях моносахариды содержатся в свободном виде. Но главным образом они распространены в ди- и полисахаридах, гликозидах, нуклеиновых кислотах. В растениях углеводы образуются из диоксида углерода и воды в процессе фотосинтеза: о многих растениях моносахариды содержатся в свободном виде. Но главным образом они распространены в ди- и полисахаридах, гликозидах, нуклеиновых кислотах. В растениях углеводы образуются из диоксида углерода и воды в процессе фотосинтеза: nСО2 + nН2О СnH2nOn + nO2 1. Гидролиз ди- и полисахаридов. Это один из основных методов получения моносахаридов: С12Н22О11 + Н2О 2 С6Н12О6 (С6Н12О6)n + nН2О nС6Н12О6 2. Неполное окисление многоатомных спиртов. Путём осторожного окисления первичных групп в многоатомных спиртах можно получить соответствующие альдозы, а вторичных спиртовых групп – кетозы. Часто при таком окислении получают смеси альдоз и кетоз. Например, при окислении рибита образуется рибоза и рибулоза:  D-рибит D-рибоза D-рибулоза 3  . Реакции альдольной конденсации. Из формальдегида в присутствии гидроксида кальция можно получить сиропообразное сахаристое вещество. Этот продукт был впервые синтезирован А.М. Бутлеровым в 1861 г. Позже анализ показал, что полученный густой сироп представляет собой рацемическую смесь D- и L-фруктозы: . Реакции альдольной конденсации. Из формальдегида в присутствии гидроксида кальция можно получить сиропообразное сахаристое вещество. Этот продукт был впервые синтезирован А.М. Бутлеровым в 1861 г. Позже анализ показал, что полученный густой сироп представляет собой рацемическую смесь D- и L-фруктозы:+ + формальдегид гликолевый альдегид глицериновый альдегид 2. Олигосахариды (сахароподобные полисахариды) Дисахариды (биозы) Олигосахариды (от греч. oligos – немногочисленный, незначительный) – сложные углеводы, имеющие сравнительно невысокую молекулярную массу и схожие с моносахаридами свойства. В зависимости от числа молекул моносахаридов, образующихся при гидролизе низкомолекулярных полисахаридов (олигосахаридов), последние подразделяются на дисахариды, трисахариды и т.д. Особенно хорошо известны дисахариды (биозы), которые являются природными веществами. Их общая формула |
