8 кл соч. 8 кл, СОЧ. Количество баллов 25 Типы заданий мво задания с множественным выбором ответов ко
 Скачать 421.41 Kb. Скачать 421.41 Kb.
|
|
Задания по суммативному оцениванию за четверть СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 4 ЧЕТВЕРТЬ Обзор суммативного оценивания за 4 четверть Продолжительность - 40 минут Количество баллов - 25 Типы заданий: МВО – задания с множественным выбором ответов; КО– задания, требующие краткого ответа; РО – задания, требующие развернутого ответа. Структура суммативного оценивания Данный вариант состоит из11 заданий, включающих задания с множественным выбором ответов, с кратким и развёрнутым ответами. В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения. В вопросах, требующих развёрнутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Задание может содержать несколько структурных частей/подвопросов. Характеристика заданий суммативного оценивания за 4 четверть
Задания суммативного оценивания за 4 четверть по предмету «Химия 8класс» 1(а)Установите соответствие между формулами оксидов и характером их свойств
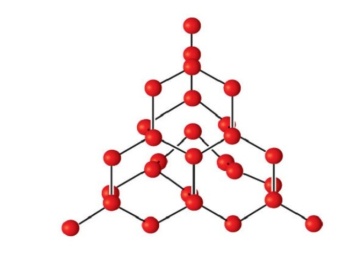
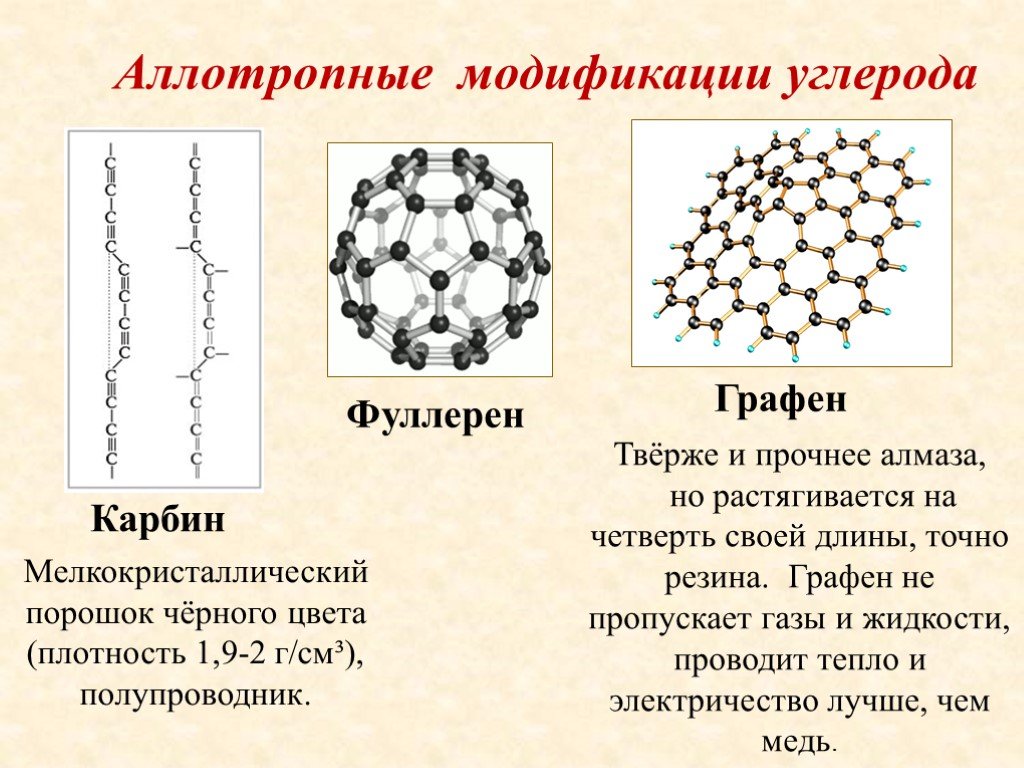
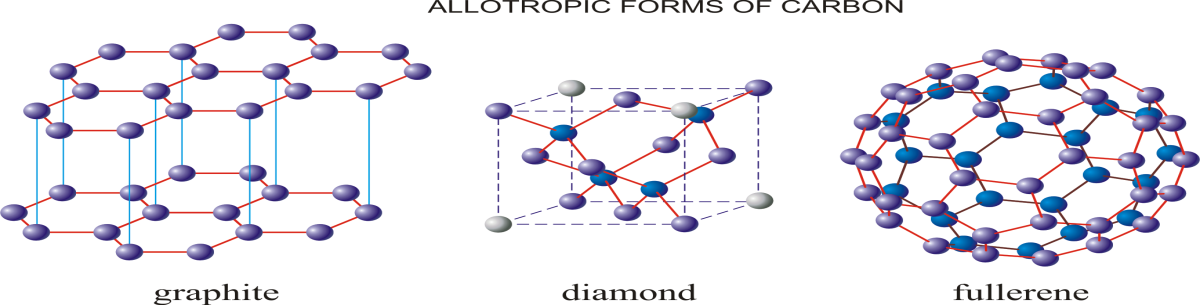
1______________________ 2______________________ 3______________________ 4______________________[1] б)Запишите уравнения реакции между оксидом натрия и водой .Расставьте коэффициенты __________________________________________________________________[1] 2(а).Дан ряд кислотHNO3, HCl, H3PO4, H2SO4, H2SO3, H2CO3, H2S, H2SiO3, HBr: Выпишите формулы кислот: А)азотной, кремневой ,фосфорной ____________________________________ Б)содержащих по два атома водорода(двухосновных)___________________ [1] (б)Даны вещества: H2СО3,NaOH,CuSO4,KHCO3 . Запишите уравнения реакции нейтрализации с соляной кислотой,используя одно из указанных формул __________________________________________________________________[1] 3.Выпишите растворимые и не растворимые в воде основания: Fe(OH)2, KOH, Zn(OH)2,Ba(OH)2,Al(OH)3,Cu(OH)2. Растворимые _____________________________________________________ Нерастворимые ___________________________________________________[1] 4.Запишите уравнения реакции серной кислоты с гидроксидом калия и расставьте коэффициенты __________________________________________________________________[1] 5.Взаимосвязь между классами соединений называется генетической связью. Составьте уравнения химической реакции и осуществите следующее превращения.   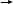  FeFeOFeSO4Fe(OH)2FeCl2 FeFeOFeSO4Fe(OH)2FeCl2 1_________________________________________ 2________________________________________ 3_________________________________________ 4_______________________________________________________ [4] 6.Углерод элемент IV группы имеет наибольшее значение ,так как входит в состав всех живых организмов. В свободном состоянии углерод встречается в виде алмаза, карбина, графита и других аллотропных видоизменений. А) Запишите схему строения атома углерода и электронного строения по энергетическим уровням. [1]
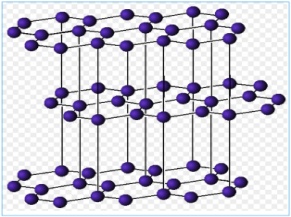
Б)Объясните почему атом углерода в большинстве соединений проявляет валентность ,равную IV? __________________________________________________________________________________________________________________________________________________________________________________________________________[1] 7.Укажите строение алмаза среди различных аллотропных видоизменений углерода _________________________________________________________________ [1]
8.а)Выберите верные утверждениясвойственные для CO2 1. Используется для восстановления металлов 2.Используется для приготовления газированных напитков 3.Является восстановителем 4.Несолеобразующий оксид __________________________________________________________________[1] Б) Объясните, почему из оксидов углерода наиболее опасен для живых организмов монооксид углерода. ______________________________________________________________________________________________________________________________________[2] 9.Даны вещества :HCl,NaOH,CaCO3,MgO. А)Составьте уравнения реакции получения углекислого газа в лаборатории.[1] ____________________________________________________________________ Б)С помощью какого раствора можно определить оксид углерода(IV) 1)H2SO4 2)NaOH 3) Ca(OH)2 4)CaCl2 __________________________________________________________________[1] 10.а)Назовите 2 источника загрязнения воды__________________________ __________________________________________________________________[2] Б)Назовите 2 способа очистки воды ______________________________________________[2] 11. Временная жёсткость обусловлена присутствием в воде гидрокарбонатов кальция и магния: А)перечислите способы ее устранения________________________________ _________________________________________________________________[1] Б) Объясните, чем обусловлена постоянная жесткость воды._____________ ________________________________________________________________[1] В)Перечислите способы ее устранения _____________________________________________________________________________________________________________________________________[1] Схема выставления баллов
Скачано с www.znanio.ru |

 )
) a)2HCl+ CaCO3=СaCl2+H2O+CO2
a)2HCl+ CaCO3=СaCl2+H2O+CO2