Коллоквиум 1 по общей фармакологии. Польза и риск при назначении лекарств. Основания для применения лекарств
 Скачать 341.5 Kb. Скачать 341.5 Kb.
|
|
35. Описание кинетики концентрации препарата в плазме крови при его введении в кровяное русло с постоянной скоростью. Оценка времени достижения равновесной стационарной (насыщающей) концентрации (Css). 1) Равновесная стационарная концентрация препарата достигается при скорости введения, равном скорости всасывания. D/время и Css прямо пропорциональны. 2) За каждый последующий период полувыведения концентрация прирастает на половину от оставшейся до достижения Сss. Все ЛС, подчиняющиеся закону элиминации 1-ого порядка, будут достигать Css через 4-5 периодов полуэлиминации. 36. Примерный расчет Сss, достигаемой при непрерывном введении препарата в кровоток с постоянной скоростью, управление уровнем Css. Подходы к управлению уровнем Сss: изменить вводимую дозу ЛС или интервал введения. 37. Описание кинетики концентрации препарата в крови при прерывистом (дискретном) введении лекарств в организм. Css среднее, максимальное и минимальное. Прерывистое введение ЛС – введение определенного количества ЛС через некоторые промежутки времени. Равновесная стационарная концентрация достигается через 4-5 периодов полуэлиминации, время ее достижения не зависит от дозы. Колебания концентрации ЛС пропорциональны Cssmin = Cssmax × (1 – эл. фр.) 38. Примерный расчет средней стационарной концентрации препарата (Css) в плазме крови, достигаемой при дискретном введении лекарств. 39. Ориентировочный расчет границ колебаний концентрации препарата в плазме крови в равновесной стационарной фазе (насыщения) при дискретном введении лекарств. Cssmin = Cssmax × (1 – эл. фр.), где (1-эл.фр.) - это часть дозы, остающаяся в организме перед очередным введением. 40. Управление уровнем Css и размахом колебаний концентрации лекарственного вещества в плазме крови путем изменения дозы и интервала введения препарата. 1. Изменить дозу ЛС: введение 0,5D диапазон колебаний концентрации препарата в крови уменьшается в 2 раза, средняя концентрация препарата достигает 0,5D за 5-6 периодов полувыведения. При введении ЛС дозой 2D диапазон колебаний и средняя концентрация увеличиваются в два раза. 2. Изменить интервал введения ЛС: увеличение интервала введения в 2 раза средняя концентрация ЛС в крови будет равна половине концентрации при нормальном интервале введения. 3. Можно одновременно изменить дозу и интервал введения. Для определения адекватного режима введения препарата необходимо рассчитать Cssmax и Cssmin. Диапазон колебаний при этом не должен превысить 2Css. 41. Терапевтический и токсический диапазоны (интервалы) концентраций препарата в крови. Понятие об адекватном режиме введения дискретных доз. Терапевтический диапазон (коридор безопасности, терапевтическое окно) – это интервал концентраций от минимальной терапевтической до вызывающей появление первых признаков побочных действий. Токсический диапазон – интервал концентрации от минимально токсической до смертельной (?). Адекватный режим введения дискретных доз: такой режим введения, при котором флюктуация концентрации препарата в крови укладывается в терапевтический диапазон. 42. Вводная (загрузочная) доза, терапевтический смысл. Примерный расчет загрузочной дозы. Условия и ограничения использования загрузочных доз в фармакотерапии. Вводная (загрузочная) доза – доза, вводимая за один прием и заполняющая весь объем распределения в действующей терапевтической концентрации. ВД=(Css*Vd)/F. [Css]=мг/л, [Vd]=л/кг Загрузочная доза может быть введена за один раз лишь тогда, когда игнорируется процесс распределения вещества (кинетика двухкамерной модели). Если распределение препарата происходит значительно медленнее, чем его поступление в кровь, введение сразу всей загрузочной дозы (особенно внутривенно) создаст концентрацию значительно выше терапевтической (возникновение токсических эффектов), поэтому введение нагрузочных доз всегда должно быть медленным или дробным. 43. Поддерживающие дозы, терапевтический смысл. Примерный расчет оптимального режима дозирования при систематическом введении препарата. Поддерживающая доза – доза ЛС, вводимая систематически, которая заполняет объем клиренса, т.е. тот фрагмент Vd, который очищается от ЛС за интервал ПД компенсирует потери с клиренсом за интервал между введениями препарата. ПД=(Css*Cl* Расчет режима оптимального дозирования: Пример: быстро купировать приступ БА в/в введением ТФ, поддержать эффект в/в инфузией в течение 6 часов и затем перейти на систематический пероральный прием ЛС. Исходные данные: вес 50 кг, ТС=15 мг/л, CL=2,5 л/ч, Vd=35 л/70 кг. 1. Загрузочная доза ВД в/в: ВД=Css*Vd/F, F=1, Vd=Vd(70)*50/70=25 ВД=15*25=375 мг в капельницу на 90 мл физ. раствора, ввести за 30 мин, 3 мл/мин. 2. Поддерживающая доза в/в ПД: ПД=CL * Css * ПД=2,2 л/ч * 15 мг/л * 6 ч = 225 мг 360 мл (60 мл/ч, 1 мл/мин) 3. Поддерживающая доза per os ПД p.o.= CL*Css* Принимать через 4 ч = 2,5*15 * 4= 150 мг 8 ч = 300 мг 24 ч = 900 мг Расчет амплитуды колебаний: Cmax и Cmin при различных значениях Cmin=Сmax*Остаточная фракция= 17,1*0,65 = 11,1 мг/л Оценка: минимальная амплитуда колебаний около ТС Сmin=24*0,5=12 мг/л Оценка: допустимая амплитуда колебаний около ТС Сmin=40,9*0,12=4,9 мг/л Оценка: неприемлима амплитуда колебаний от токсичной до неэффективной 44. Индивидуальные, возрастные и половые различия фармакокинетики лекарств. Поправки для расчета индивидуальных значений объема распределения. 1. Всасывание ЛС: при увеличении возраста снижается абсорбция ЛС, повышается его метаболизм в ходе пресистемной элиминации, изменяется биодоступность ЛС. 2. Объем распределения Vd а) снижается: - c возрастом - при ожирении (рассчитывается по массе тела, для липофобных ЛС объем распределения должен рассчитываться, исходя из идеальной массы тела для данного роста) б) повышается - при секвестрации жидкостей (отеки, асцит: 1) масса тела – масса избытка накопившейся жидкости = нормальная масса, 2) по нормальной массе определим объем распределения, 3) объем распределения увеличиваем на 1 л на каждый избыточный килограмм) в) может как увеличиваться, так и уменьшаться при нарушении баланса ткань-кровь 3. Период полувыведения – изменяется с возрастом и при ожирении (т.к. уменьшается Vd) 4. Клиренс – требуется поправка на функциональное состояние почек для ЛС, выводимых с мочой. 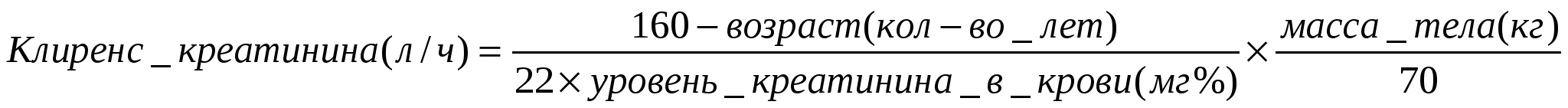 Для женщин значение клиренса креатинина умножается на 0,9 с поправкой на уровень мышечной массы на кг тела. Для женщин значение клиренса креатинина умножается на 0,9 с поправкой на уровень мышечной массы на кг тела.45. Почечный клиренс лекарств, механизмы, качественные характеристики. Почечный клиренс - это мера объема плазмы, которая очищается от лекарственного вещества в единицу времени: Cl (ml/min) = U × V/P, где U - концентрация ЛВ в мл мочи, V - объем мочи, выделяемой в мин, P - концентрация ЛВ в мл плазмы. Механизмы почечного клиренса: 1) фильтрация 2) активная секреция 3) реабсорбция ЛВ, выделяемое только фильтрацией (инсулин) будет иметь клиренс, равный гломерулярной скорости фильтрации (125-130 мл/мин). ЛВ, выделяемое фильтрацией и полной секрецией (парааминогиппуриевая кислота) будет иметь клиренс, равный почечному плазменному клиренсу (650 мл/мин). Значения клиренса между 130 и 650 мл/мин предполагают, что ЛВ фильтруется, выделяется и частично повторно реабсорбируется. Ряд таких показателей как возраст, совместное употребление нескольких лекарственных препаратов, болезни значительно влияют на почечный клиренс: а) почечная недостаточность уменьшение клиренса ЛС высокий уровень ЛС в крови б) гломерулонефрит потеря сывороточного белка, который обычно был доступен и связывал ЛС увеличение уровня свободной фракции ЛС в плазме 46. Факторы, влияющие на почечный клиренс лекарств. Зависимость почечного клиренса от физико-химических свойств лекарственных веществ. Факторы, влияющие на почечный Cl: а) гломерулярная фильтрация (ГФ) б) скорость почечного кровотока (ПК) в) максимальная скорость секреции (Tm) г) объём мочи (UV) д) фракция несвязанная в крови (Fnc) Зависимость почечного клиренса от физико-химических свойств ЛВ: I. Неполярные неионогенные вещества: фильтруются только в несвязанных формах, не секретируются, реабсорбируются Cl поч. = Fnc × UV (Cl мал и зависит от UV). II. Полярные неионогенные вещества: фильтруются в несвязанной форме, не секретируют, не реабсорбируются Cl поч. = Fnc × СГФ (Cl – высокий) III. Ионизированные в моче неполярные в неионной форме: фильтруются, активно секретируются, неполярные реабсорбируются Cl поч. = F неиониз. несвяз. × F ионная в моче × Uv IV. Ионизированные в моче полярные в неионизированном виде: фильтруются, активно секретируются, не реабсорбируются Клиренс определяется ПК, Гф, Tm, Km – Cl высокий 47. Управление почечным клиренсом лекарственных веществ с переменной ионизацией. Следует подкислить или подщелочить мочу (кислые вещества лучше выводяться в щелочной моче, щелочные – в кислой, т.к. они в этих условиях не реабсорбируются) 48. Печеночный клиренс лекарств, детерминанты и ограничения. Энтерогепатический цикл лекарственных средств. Механизмы печеночного клиренса: 1) метаболизм (биотрансформация, химические превращения) Основная стратегия метаболизма ксенобиотиков: неполярные вещества полярные (гидрофильные) метаболиты, выводимые с мочой. 2) выведение нетрансформированных веществ в желчь Только полярные в-ва с молекулярной массой > 250 – активный транспорт в желчь (органические кислоты, основания). Детерминанты печеночного клиренса: а) Скорость кровотока в печени б) Vmax экскреции или метаболических превращений в) Km – константа Михаэлиса г) Несвязанная с белком фракция Ограничения печеночного клиренса: А. 1. Если Vmax/Km велико → Cl печ = скорости кровотока в печени 2. Если Vmax/Km средние величины → Cl = сумма всех факторов 3. Если Vmax/Km мало → Cl печ мал, ограничен Энтерогепатический цикл ЛС - ряд препаратов и продуктов их превращения в значительном количестве выводится с желчью в кишечник, откуда частично выводится с экскрементами, а частично - повторно всасывается в кровь, вновь попадает в печень и выводится в кишечник. Печеночная элиминация препаратов может быть значительно изменена болезнью печени, возрастом, диетой, генетикой, продолжительность назначения лекарственных средств (например, вследствие индукция печеночных ферментов), и других факторов. 49. Факторы, изменяющие клиренс лекарственных средств. 1. Взаимодействия ЛС на уровне: почечной секреции, биохимической трансформации, явлений ферментативной индукции 2. Болезни почек: нарушения кровотока, острые и хронические поражения почек, исходы длительных почечных заболеваний 3. Болезни печени: алкогольный цирроз, первичный цирроз, гепатиты, гепатомы 4. Болезни ЖКТ и эндокринных органов 5. Индивидуальная непереносимость (отсутствие ферментов ацетилирования – непереносимость аспирина) 50. Коррекция лекарственной терапии при заболеваниях печени и почек. Общие подходы. 1. Отменить препараты, которые не являются необходимыми 2. При заболеваниях почек использовать препараты, выделяющиеся с печенью 3. Снизить дозу или увеличить интервал между введениями 4. Тщательный мониторинг за побочными и токсическими эффектами 5. При отсутствии фармакологического эффекта повышать дозу необходимо медленно и под контролем фармакологических и токсических эффектов 6. При возможности определить концентрацию вещества в плазме и корригировать терапию по Сl препарата индивидуально 7. Использовать косвенный способ оценки Cl 51. Коррекция режима дозирования лекарственных средств под контролем остаточной функции почек (по клиренсу креатинина). 52. Коррекция лекарственной терапии при поражениях печени и других патологических состояниях, влияющих на клиренс лекарств. См. вопрос 50. 53. Биотрансформация лекарственных средств, ее биологический смысл, основная направленность метаболических превращений лекарств. Биотрансформация ЛС – химические превращения ЛС в организме. Биологический смысл биотрансформации ЛС: создание субстрата, удобного для последующей утилизации (в качестве энергетического или пластического материала) или в ускорении выведения этих веществ из организма. Основная направленность метаболических превращений ЛС: неполярные ЛС → полярные (гидрофильные) метаболиты, выводимые с мочой. 54. Две фазы метаболических превращений лекарств в организме. Влияние биотрансформации на фармакологическую активность лекарств. Выделяют две фазы метаболических реакций ЛС: 1) метаболическая трансформация (несинтетические реакции (фаза 1) - превращение веществ за счет микросомального и внемикросомального окисления, восстановления и гидролиза 2) конъюгация (синтетические реакции (фаза 2) - биосинтетический процесс, сопровождающийся присоединением к лекарственному веществу или его метаболитам ряда химических группировок или молекул эндогенных соединений: а) образование глюкуронидов б) ацетилирование в) образование эфиров глицерина г) образование сульфоэфиров д) метилирование Влияние биотрансформации на фармакологическую активность ЛС: 1) чаще всего метаболиты биотрансформации не обладают фармакологической активностью или их активность снижена по сравнению с исходным веществом 2) в некоторых случаях метаболиты могут сохранять активность и даже превосходить по активности исходное вещество (кодеин метаболизируется до более фармакологически активного морфина) 3) иногда в ходе биотрансформации образуются токсичные вещества (метаболиты изониазида, лидокаина) 4) иногда в ходе биотрансформации образуются метаболиты с противоположными фармакологическими свойствами (метаболиты неселективных агонистов 2- адренорецепторов обладают свойствами блокаторов этих рецепторов) 5) ряд веществ является пролекарствами, которые исходно не дают фармакологических эффектов, но в ходе биотрансформации преобразуются в БАВ (неактивная L-допа, проникая через ГЭБ, превращается в мозге в активный дофамин, при этом нет системных эффектов дофамина). 55. Клиническое значение биотрансформации лекарств. Влияние пола, возраста, массы тела, экологических факторов, курения, алкоголя на биотрансформацию лекарств. Клиническое значение биотрансформации ЛС: т.к. доза и частота приема, необходимые для достижения эффективной концентрации в крови и тканях, могут варьировать у больных из-за индивидуальных различий в распределении, скорости метаболизма и элиминации ЛС, важен их учет в клинической практике. |
