Концентрация
 Скачать 65.24 Kb. Скачать 65.24 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей химии ОТЧЁТ по лабораторной работе №5 «Концентрация» Выполнил: студент группы ТОП-22 __________ / Багиров.Т.Р./ (группа) (подпись) (Ф.И.О.) Дата: Проверил: ____________ / / (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2022 Цель работы Приготовление раствора и определение его концентрации Общие теоретические сведения Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определённых пределах. Растворы по агрегатному состоянию делятся на газообразные, жидкие и твёрдые. Растворитель - компонент, образующий непрерывную среду. Растворённые вещества – компоненты, которые распределены в растворе в виде дискретных частиц. Способы выражения концентрации раствора - Массовая доля, или процентное содержание 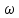 – соотношение масс растворённого – соотношение масс растворённого 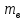 вещества и раствора вещества и раствора 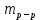 , выраженное в долях или процентах , выраженное в долях или процентах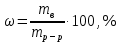 Концентрация, выраженная в граммах на литр, 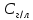 – показывает, какая масса растворённого вещества – показывает, какая масса растворённого вещества 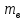 , выраженная в граммах, содержится в единице объема раствора , выраженная в граммах, содержится в единице объема раствора 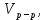 (г/л): (г/л):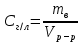 Молярная концентрация, или молярность, 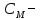 число молей растворённого вещества число молей растворённого вещества 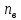 в одном кубическом дециметре(литре) раствора, (моль/л): в одном кубическом дециметре(литре) раствора, (моль/л):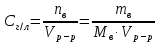 - Молярная концентрация, или молярность , 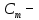 число молей растворённого вещества число молей растворённого вещества 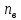 приходящееся на 1 кг растворителя (моль/кг): приходящееся на 1 кг растворителя (моль/кг):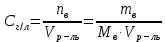 - Мольная доля, или мольные проценты 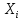 - число молей компонента (растворителя или растворённого вещества), содержащееся в одном моле раствора: - число молей компонента (растворителя или растворённого вещества), содержащееся в одном моле раствора: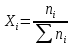 - Нормальная концентрация, или нормальность, 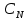 – количество эквивалентов растворённого вещества – количество эквивалентов растворённого вещества 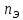 , содержащееся в одном литре раствора, (экв/л): , содержащееся в одном литре раствора, (экв/л):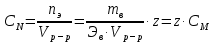 , ,где z- количество обменных эквивалентов растворённого вещества, содержащееся в одном моле. Титрование – приём количественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации (аликвотное количество раствора), называется титрованием. Протокол лабораторной работы: Заданная преподавателем концентрация соляной кислоты: 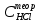 =10% =10%Плотность раствора соляной кислоты, измеренная ареометром: 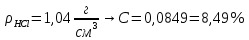 70 мл - 0,089 (На 100 мл) 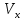 - 0,1(заданная конц.) - 0,1(заданная конц.)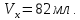 Объём аликвоты соляной кислоты, взятой для титрования, 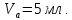 4) Концентрация раствора щёлочи 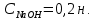 Объем щелочи, пошедший на титрование пробы соляной кислоты: 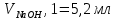 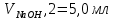 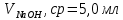 Обработка результатов эксперимента Расчёт концентрации соляной кислоты по результатам титрования: 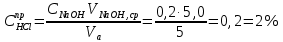 Отклонение определённой концентрации раствора соляной кислоты от заданного значения: 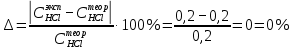 Погрешность по результатам эксперимента составляет всего 0%, а это значит, что искомая концентрация раствора соляной кислоты достигнута очень точно. Вывод: В ходе лабораторной работы был приготовлен раствор соляной кислоты, а также с учётом погрешности измерений была достигнута требуемая концентрация этого раствора (10, 6%). Отклонение от теоретического значения незначительно и составило 0%. |
