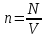опорный конспект № 1 по молекулярной физике. Конспект м олекулярная раздел физики, изучающий внутреннее строение тел, а
 Скачать 33.12 Kb. Скачать 33.12 Kb.
|
|
О Тепловые явления. Молекулярная физика. порный конспект М   олекулярная раздел физики, изучающий внутреннее строение тел, а олекулярная раздел физики, изучающий внутреннее строение тел, а физика также тепловые процессы, происходящие внутри вещества. М   олекула наименьшая устойчивая частица вещества, обладающая его (с греч-«массочка») химическими свойствами. Молекулы образуются из атомов. олекула наименьшая устойчивая частица вещества, обладающая его (с греч-«массочка») химическими свойствами. Молекулы образуются из атомов. А   том наименьшая частица химического элемента, носитель его свойств. том наименьшая частица химического элемента, носитель его свойств.(с греч- «неделимый»)
Размер атомов r ≈ 10-8см = 10-10м
Урок – 1. Тема урока: «Основные понятия молекулярной физики». Задачи урока: формирование представления о структуре и содержании новой физической теории, объяснить отличие теплового и механического движений, повторить и обобщить понятия об атомах и молекулах, развивать умение анализировать факты при наблюдении явлений, при работе с текстом учебника. Форма урока: лекция с элементами беседы, с использованием технологии интенсивного обучения на основе схемных и знаковых моделей , здоровьесберегающих технологий. Ход урока. Организационный момент. Сообщение темы, задач урока. 3)Изучение нового материала: Введение: объект и предмет молекулярной физики. Рассказ с использованием таблицы.
Основные положения МКТ: Вещество состоит из частиц. 2. Эти частицы беспорядочно движутся. 3. Частицы взаимодействуют друг с другом. 3.3. Характеристики частиц (атомов и молекул). Опорный конспект на листах. 4).Отработка изученного материала. 4.1. работа с таблицей Менделеева; 4.2. заполнить таблицу. Основные формулы МКТ
5) Домашнее задание. Читать п.53, ответить устно на вопросы стр179, особо – запомни. Урок – 2. Тема урока: «Характеристики молекул. Решение задач». Задачи урока: продолжить ознакомление с физическими величинами, характеризующими молекулы; сформировать умения рассчитывать параметры молекул; способствовать формированию умения самостоятельно приобретать знания. Форма урока: комбинированный, с использованием технологии личностно- ориентированного обучения, здоровьесберегающих технологий Ход урока. Сообщение темы, задач урока. Проверка домашнего задания. 2.1. озвучение опорного конспекта (устно); 2.2. проверка в тетрадях и у доски заполненной таблицы «»Основные формулы МКТ»; 2.3. заслушать ответы на вопросы стр 179. 3) Примеры решения задач по теме «Характеристики молекул». 3.1. решение типичных задач учителем у доски: 1. Из блюдца испаряется вода массой 50г за 4 сут. Определите среднюю скорость испарения - число молекул воды, вылетающих из блюдца за 1с. 2. Определите толщину серебряного покрытия пластинки площадью 1см2, если оно содержит серебро в количестве 0,02 моль. Плотность серебра равна 1,05 кг/м3. 3.2. решение задач учащимися у доски: 3. Определите молярную массу воды и затем массу одной молекулы воды. 4. Определите количества вещества и число молекул, содержащихся в углекислом газе массой 1кг. 4) Самостоятельная работа учащихся. 1.Определите число атомов в меди объёмом 1м3. Молярная масса меди равна 63,5 10-3кг/моль, её плотность 9000кг/м3. Какую площадь может занять капля оливкового масла объёмом 0,02см3 при расплывании её на поверхности воды? 5) Домашнее задание. Решить задачи №2,3,4 -для 1 варианта; №7, 8 - для 2 варианта Индивидуально: оценить число молекул кислорода в одной из ваших комнат. Урок – 3. Тема урока: «Характеристики движения и взаимодействия молекул Строение газообразных, жидких и твёрдых тел». Задачи урока: формирование интеллектуальных и практических умений понимать (знать содержание, аргументировать истинность примерами) основные положения МКТ, применять МКТ для объяснения существования агрегатных состояний вещества. Тип урока: комбинированный, с использованием технологии интенсивного обучения на основе схемных и знаковых моделей, фронтального эксперимента Ход урока. Сообщение темы, задач урока. Проверка домашнего задания. Решение задач в тетрадях. Изучение нового материала. Рассказ учителя с использованием опорного конспекта «Основные положения молекулярно - кинетической теории», учебного физического эксперимента. Отработка изученного материала. Работа с учебником: запомни, важно, интересно - стр 182 - 187 Домашнее задание. Читать п 55, 56, ответить на вопросы устно стр 184, 187; решить на стр184 - задания егэ Основные положения молекулярно – кинетической теории (МКТ) 1 Все тела состоят из частиц (молекул, атомов, ионов…), между которыми есть промежутки. положение 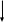 Опытные обоснования: -дробление вещества; -испарение жидкостей; -смешивание жидкостей; -фотографии туннельного микроскопа Частицы находятся в постоянном, беспорядочном (хаотичном) движении (тепловое движение) 2 положение  Опытные обоснования: Испарение (вылет частиц с поверхности вещества) Диффузия - самопроизвольное проникновение частиц одного вещества в промежутки между частицами другого вещества (чем больше температура, тем быстрее проходит диффузия) В газах - проходит быстро (мин) - распространение запаха; В жидкостях - проходит медленно (мин – часы) - растворение краски в воде; В твёрдых телах - очень медленно (годы) - слипание отшлифованных платин металла. Броуновское движение - хаотическое движение взвешанных в жидкости или газе частиц под действием ударов молекул жидкости или газа. Броун - ботаник -1827г- открыл, Эйнштейн – физик - 1905г - объяснил 3 Между частицами существует межмолекулярное взаимодействие (притяжение и отталкивание) Опытное обоснование: 1) сохранение формы твёрдых тел (Fпр) 2) наличие промежутков между частицами (Fот)) 3) упругость тел(Fпр и Fот)  положение положение ОК. Идеальный газ. Основное уравнение мкт. Идеальный газ - физическая модель реального газа, в которой не учитываются взаимодействия между молекулами (Fот = 0, Fпр =0). 2 Основные положения МКТ идеального газа Молекулы - материальные точки (абсолютно упругие шарики); Движение молекул подчиняется законам Ньютона; Нет взаимодействия между молекулами (Еп = 0, Ек = 0); Молекулы движутся хаотично; Даже в самом маленьком объёме содержится большое количество частиц (молекул), сравнимое с числом Авогадро. 3 Следствия из хаотичного движения молекул все молекулы двигаются с разными скоростями, поэтому вводим понятие средней скорости V, все направления равноправны Vx = Vy = Vz , молекулы распределяются по объёму равномерно, среднее значение квадрата скорости Vх = ⅓ V ) Основное уравнение МКТ Давление газа - сумма сил ударов молекул на единицу площади P 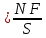 . N- число ударивших молекул. . N- число ударивших молекул. F1 - сила удара одной молекулы. P =⅓n m V2 P = ⅓ р V2 P = ⅔ n Eк (связь между р - плотность газа Ек - средняя макроскопическими и кинетическая микроскопическими энергия молекулы. мирами) 4) Урок 4. Идеальный газ в молекулярно-кинетической теории. Основное уравнение молекулярно – кинетической теории. Задачи урока: ввести понятие модели «идеальный газ», вывести основное уравнение МКТ идеального газа, ракрыть статистический характер. Ход урока. Проверка домашнего задания. Решение задач в тетрадях - стр 181 - ЕГЭ - с1, с2, с3. Постановка учебной проблемы. Задача изучения поведения газов - надо сначала построить их модели. Для газа у нас введена модель «идеальный газ». Сообщение темы, задач урока. Изучение нового материала. Опорный конспект «Идеальный газ в МКТ. Основное уравнение МКТ» - рассказ учителя, беседа, фронтальные вопросы. Работа с учебником: стр 188 - 192: запомни, важно. Запись в тетради - ок. Отработка знаний. Устно ответы на вопросы 1 - 6 на стр 192. Решение задач ЕГЭ на стр192 - А1. Домашнее задание. Читать п.57, ответить устно на вопросы стр192, озвучить опорный конспект. Урок 5. Лабораторная работа «Опытная проверка закона Гей – Люссака». Задачи урока: формирование умений выделять и описывать изобарный процесс, доказать справедливость газового закона экспериментом, продолжить формирование практических умений при работе с оборудованием, соблюдение основ безопасности, а также умение планировать свою работу и вести запись. Форма урока: использование технологии исследовательского обучения. Оборудование урока: стеклянная трубка, запаянная с одного конца, длиной 600мм, и диаметром 10мм, цилиндрический сосуд длиной 600мм и диаметром50мм, сосуд с горячей водой (600С), стакан с водой комнатной температуры, пластилин. Ход урока. Организация класса. - работа в группах; - инструктаж по безопасности жизнедеятельности; 2. Порядок выполнения работы и оформление работы. -В отчёте должно быть отражено: название работы, оборудование, краткая теория (какое явление изучается, какова рабочая формула), результаты измерений и вычислений, расчёт погрешности измерений, вывод. Знакомство с инструкцией для лабораторной работы «Экспериментальная проверка закона Гей – Люссака» на странице 400 – 401 учебника. Выполнение лабораторной работы. Задание 1. Подготовить сосуд с горячей водой. Измерить температуру воды. Поместить стеклянную трубку в сосуд и нагреть воздушный столб, предварительно измерить его длину. Задание 2. Получить второе состояние воздушного столба, перенеся стеклянную трубку в сосуд с водой комнатной температуры. Измерить его температуру и длину. Задание3. Подготовить таблицу для записи результатов. Задание4. Вычислить отношения длин воздушного столба и температур. Сравнить эти отношения. Задание5. Вычислить относительные и абсолютные погрешности измерений по формулам. Задание6. Сделать вывод о справедливости закона Гей – Люссака. Обсуждение результатов лабораторной работы Домашнее задание. Повторить материал по плану стр 224 | |||||||||||||||||||||||||||||||||||||||||||||||