Контрольна 1. Контрольна робота з біохімії
 Скачать 125.33 Kb. Скачать 125.33 Kb.
|
|
Контрольна робота з біохімії 1. Напишіть структурні формули амінокислот: а) амінооцтової (гліцину); б) -амінопропіонової (аланіну); в) -аміно--оксипропіонової (серину); г) -амінокапронової (4-аміногексанової); д) ,δ-діаміновалеріа-нової (2,5-діамінопентанової). 2. Назвіть сполуки: a) CH3CH(NH2)CH2CH2COOH; б) НОСН2— CH2-CH(NH2)COOH; в) (CH3)2CHCH(CH3)CH(NH2)COOH; г) H2NCH2CH2--CH2CN; д) CH3NH-CH2COOC2H5. 3.Наведіть структурні формули кислот: а) амінооцтової (гліцину); б) 2-аміно-З-метилбутанової (валіну); в) 2-аміно-4-метилпентанової (лейцину); г) 2-аміно-З-фенілпропанової (фенілаланіну); д) 2-аміно-3-меркаптопропанової (цистеїну). 4.Назвітьсполуки за міжнародною і тривіальною номенклатурами: 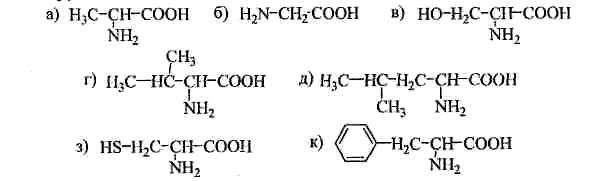 5. Які амінокислоти містяться в складі білків постійно (А), рідко (Б): а) гліцин; б) гідроксилізин; в) валін; г) лейцин; д) ізолейцин; є) гідроксипролін; є) цистеїн; ж) фенілаланін; з) -аміноізомасляна кислота? Напишіть формули цих амінокислот. 6. Які амінокислоти у водному розчині мають кислу реакцію: а) аланін; б) валін; в) глутамінова кислота; г) лейцин; д) ас парагінова кислота? Чому? Напишіть формули цих амінокислот. 7. Які амінокислоти мають основні властивості: а) лейцин; б) треонін; в) гістидин; г) лізин; д) метіонін; є) гідроксилізин; є) аргінін? Чому? Напишіть їх формули. 8. Які амінокислоти є похідними ароматичних (гомоциклічних) кислот: а) фенілаланін; б) аланін; в) триптофан; г) тирозин; д) метіонін? Напишіть їх формули. 9. Які амінокислоти належать до гетероциклічних: а) гліцин; б) лейцин; в) гістидин; г) аланін; д) триптофан; є) оксилізин? Напишіть їх формули. 10 . До складу яких амінокислот входить гідроксильна група: а) аланін; б) тирозин; в) треонін; г) метіонін; д) серин; є) гід роксилізин; є) гідроксипролін? Напишіть їх формули. 11. . Які амінокислоти є сірковмісними: а) гліцин; б) метіонін; в) аланін; г) цистеїн; д) лейцин; є) цистин? Напишіть формули. 12. У яких амінокислотах міститься метильна група: а) гліцин; б) аргінін; в) лізин; г) метіонін? Напишіть формули. 13. Напишіть схему дисоціації амінокислот: а) в кислому се редовищі; б) у лужному середовищі. 14. Наведіть структурні формули наступних незамінних амінокислот: а) (+)-валіну; б) (-)-лейцину; в) (+)-ізолейцину; г) (+)-лізину; д) (-)-треоніну; є) (-)-метионіну; є) (-)-фенілаланіну; ж) (-)-триптофану. До якогостереохімічного ряду L чи D належать ціприродніамінокислоти? 15. Із залишків яких амінокислот складаються такі петиди:  16.Наведіть будову пептидів: а) гліцилгліцину; б) гліцилаланіну; в) аланілгліцину; г) гліцилаланілфенілаланіну; д) аланілсерилгліцилваліну. У кожному пептиді назвіть N- і С-кінцеві амінокислоти. 17. Напишіть формули: а) ізомерних дипептидів, складених із гліцину і аланіну; б) ізомерних трипептидів, складених із гліцину, аланіну і серину. Назвіть їх. 18. Дією яких реагентів можна здійснити такі перетворення:  19.Напишіть структурні формули ди- і трипептидів, які утворюються при поліконденсації амінооцтової кислоти. Назвіть ці пептиди. Дайте визначення пептидного зв'язку. Поясніть, чому його довжина (0,132 нм) менше довжини зв'язку C-N в амінах (0,147 нм). 20. Які амінокислоти можна одержати при повному гідролізі ізомерних трипептидів: а) гліцилвалілфенілаланіну і б) валілфенілаланілгліцину? Утворення яких дипептидів можна чекати при частковому гідролізі тих же трипептидів. Чи можна за допомогою часткового гідролізу розрізнити ізомерні (а) і (б) трипептиди? 21. Напишіть структурну формулу трипептиду, при повному гідролізі якого утворюється гліцин, аланін і цистеїн, а при частковому гідролізі - аланілгліцин і гліцилцистеїн. 22. Напишіть структурну формулу трипептиду, при повному гідролізі якого утворюється валін, лейцин і фенілаланін, а при частковому гідролізі - лейцилвалін і валілфенілаланін. 23. Напишіть п'ять різних формул тетрапептиду, який складається із аланіну, серину, гліцину і валіну. Вкажіть N- і С-кінцеві амінокислоти у кожному тетрапептиді. 24. Напишіть п'ять різних формул тетрапептиду, який складається із цистеїну, тирозину, гліцину і лізину. Вкажіть N- і С-кінцеві амінокислоти у кожному тетрапептиді. 25. Напишіть п'ять різних формул тетрапептиду, який складається із аланіну, аргініну, ізолейцину і фенілаланіну. Вкажіть N- і С-кінцеві амінокислоти у кожному тетрапептиді. 26. Напишіть п'ять різних формул тетрапептиду, який складається із аспарагінової кислоти, метіоніну, аланіну і треоніну. Вкажіть N- і С-кінцеві амінокислоти у кожному тетрапептиді. 27. Напишіть структурну формулу трипептиду, при повному гідролізі якого утворюється триптофан, аланін і лейцин, а при частковому гідролізі - аланілтриптофан і триптофіллейцин. 28. Напишіть структурну формулу трипептиду, при повному гідролізі якого утворюється гліцин, лізин і ізолейцин, а при частковому гідролізі - ізолейциллізин і лізилгліцин. 29. Напишіть структурну формулу трипептиду, при повному гідролізі якого утворюється гліцин, аланін і цистеїн, а при частковому гідролізі - гліцилаланін і аланілцистеїн. 30. Напишіть структурні формули дипептидів, які можуть бути одержані із таких амінокислот: а) гліцину і валіну; б) аланіну і валіну; в) гліцину і лейцину; г) аланіну і лейцину. Дипептиди назвіть. . 31.Назвіть сполуки:  32.Напишіть структурні формули таких сполук: а) аланіну; б) 2-амінобутанової кислоти; в) 3-аміно-2-метилпропанової кислоти; г) 3-аміно-3-метилбутанової кислоти; д) 2-аміно-3-метилпентанової кислоти; є) 2-амінобутанаміду;. 33.Напишіть структурні формули амінокислот складу C4H9O2N і назвіть їх. 34. Напишіть формули гліцину, аланіну, валіну і лейцину у вигляді внутрішніх солей. 35. Наведіть по три приклади діаміномонокарбонових кислот. Назвіть їх за систематичною номенклатурою. 36. Наведіть по три приклади моноамінодикарбонових кислот. Назвіть їх за систематичною номенклатурою. 37. Напишіть структурні формули сполук: а) -метил--аміно- валеріанова кислота (ізолейцин); б) -окси--амінопропіонова кислота (серии); в) аміноянтарна кислота (аспарагінова кислота); г) -аміноглутарова кислота (глутамінова кислота); д) ,-диметил--аміномаслянакислота; є) -аміно--оксимаслянакислота. 38. Напишіть структурні формули сполук: а) -аміномасляна кислота; б) έ-амінокапронова кислота; в) 3-аміно-1-бутанова кислота; г) 4-окси-2-амінобутанова кислота; д) гідрохлорид етилового естеру гліцину; є) N-ацетилаланін. 39. Які сполуки називають білками? Що мають на увазі, коли йдеться про первину і вторинну структури білка? 40. Що називають третинною і четвертинною структурою білка? Як визначають первинну структуру білка? 41. Вкажіть найбільш характерні властивості молекул білка. 42. Наведіть класифікацію простих білків. 43. Наведіть класифікацію складних білків? 44. Використання денатурації у виробництві харчових продуктів. 45. Функції білків. 46. Класифікація амінокислот. 47. Біологічна цінність білків. 48. Білки мяса. 49. Білки молока. 50. Поняття про ізоелектричну точку білків. 51. Розчинність білків та методи виділення білків із біологічного матеріалу. 52. Типи хімічних зв’язків у білковій молекулі. 53. Скільки структурних ізомерів може мати сполука загальної формули C3H7NO2, що належать до класу амінокислот? Напишіть ці ізомери і назвіть їх. 54. Яку реакцію середовища буде мати розчин етилового естеруглутаміну? Напишіть відповідну формулу і дайте пояснення. 55. Які сполуки утворює -амінопропіонова кислота при дії таких речовин: a) NaOHв Н2О; б) НС1; в) Н20, СН3ОН, НС1 (г); г) РС15 (етер, t); д) (СН3СО)2О, t; є) СН3СН2І (спирт, t); є) NaNО2, HCl (0° С). Напишіть схеми реакцій. 56. Розгляньте відношення до нагрівання найпростіших а-, - і -амінокислот. Назвіть сполуки, що утворюються і охарактеризуйте їх хімічні властивості. 57. Напишіть структурні формули проміжних і кінцевого продуктів у наступній схемі: 58. Напишіть структурні формули проміжних і кінцевого продуктів у такій схемі:  59. Для ізомасляної кислоти напишіть реакцію з бромом, а для одержаної сполуки - з надлишком аміаку. Назвіть продукти цих реакцій. 60. Дією аміаку на галогензаміщені кислоти отримайте такі амінокислоти: а) 2-аміно-3-метилбутанову; б) 2-аміно-2-метилбутанову; в) амінобутандіову; г) 2-аміно-5-метилгексанову. 61. Напишіть структурні формули проміжних і кінцевого продуктів у наступній схемі: 62. Для -аміномасляної кислоти напишіть реакції: а)алкілювання; б) ацилювання; в) етерифікації, 63. Використовуючи як вихідну речовину ацетилен, запропонуйте схеми одержання гліцилгліцину. 64. Напишіть структурні формули проміжних і кінцевого продуктів у схемі: 65. Використовуючи як вихідну речовину ацетилен, запропонуйте схеми одержання гліцилаланіну. 66. Які сполуки утворюються при взаємодії нітритної кислоти із такими амінокислотами: а) аланіном; б) -аміномасляною кислотою; в) валіном; г) лейцином; д) -аміно--метилвалеріановою кислотою? 67. Яку реакцію використовують для якісного визначення -амікислот? Напишіть схему. 68. Напишіть схему синтезу 2-амінопропанової кислоти з етилового спирту і рівняння взаємодії добутої амінокислоти з НС1 і NaOH. 69. Напишіть реакцію взаємодії амінокислот із формальдегідом. 70. Напишіть реакцію взаємодії з азотистою кислотою таких амінокислот: а) оксилізину; б) тирозину; в) гліцину. 71. Напишіть реакцію взаємодії гліцину: а) зхлоридною кислотою; б) з гідроксидом натрію. 72. Які амінокислоти мають полярні, але незаряджені R-групи: а) глутамінова кислота; б) серин; в) треонін; г) гліцин;и)аспарагін; є) глутамін; є) цистеїн; ж) аланін? Напишіть формули. 73. Які амінокислоти мають неполярні (гідрофобні) R-групиа) аланін; б) лізин; в) лейцин; г) ізолейцин; д) серин; є) валін; ж) пролін? Напишіть формули. 74.Які амінокислоти мають негативнозаряджені (кислі) R-групи: а) гліцин; б) аспарагінова кислота; в) глутамін; г) глутамінова кислота; д) аргінін? Напишіть формули. 75.Які амінокислоти мають позитивно заряджені (основні) R-групи: а) валін; б) лізин; в) метіонін; г) аргінін; д) гліцин;: є)гістидин? Напишіть формули. 76.Які сполуки є амінокислотами: а) креатин; б) серин; І) гліцин; г) карнозин; д) етаноламін; є) ізолейцин? Напишіть формули. 77. Яка амінокислота має дисульфідний зв'язок: а) цистеїн; її) метіонін; в) цистин; г) серин? Напишіть формулу. 78. Яка амінокислота оптично неактивна: а) лейцин; б) аланін, г) гліцин; в) цистеїн; г) аргінін? 79. Яким чином буде переміщуватися білок під час електро- форезу за умов, коли рН розчину нижча ізоелектричної точки: а) до аноду; б) до катоду; в) залишається на лінії старту. 80. Який білок містить йод: а) міозин; б) колаген; в) тиреоглобулін. 81. Які властивості характерні для білків: а) амфотерні; о) відсутність специфічної молекулярної конфігурації; в) здатність зберігати будову молекули під час нагрівання; г) термолабільність? 82. Для яких білків характерна -структура поліпептидного ланцюга: а) гемоглобін; б) фіброїн шовку; в) міоглобін; г) альбумін? 83. Які зв'язки беруть участь в утворенні конформації поліпептидного ланцюга: а) координаційні; б) водневі; в) йонні; і ) ковалентні; д) гідрофобні? 84. Які білки мають найбільший ступінь -спіралізації поліпептидного ланцюга: а) трипсин; б) рибонуклеаза; в) міоглобін; і ) пепсин; д) гемоглобін? 85. Які методи використовують для визначення молекулярної маси білків: а) кріоскопічний; б) гельфільтрацію; в) електрофорез у градієнті концентрації поліакриламідного гелю; г) ультрацентрифугування? 86. Який метод обмежено використовують під час виділення та очищення білків: а) кристалізацію; б) осадження органічними розчинниками; в) препаративний електрофорез; г) висолювання? 87. З якими сполуками нінгідриновий реактив дає кольорову реакцію: а) полісахариди; б) моносахариди; в) нуклеїнові кислоти; г) -амінокислоти; д) ліпіди; є) білкиж)-амінокислоти? 88.Які сполуки дають біуретову реакцію: а) вільні амінокислоти; б) глутатіон(L-γ-глутаміл-L-цистеїніл-гліцин); в) дипептиди; г) трипептиди та білки 89.Які властивості характерні для нативної молекули білків: :а) наявність великої кількості водневих зв'язків у молекулі; б) незначна кількість вільних -аміногруп (внаслідок гідролізу їх стає значно більше); в) у результаті кислотного гідролізу вивільняється велика кількість аміаку; г) при селективному гідролізі білків утворюються пептиди та вільні амінокислоти? 90.Які властивості характерні для денатурованих білків: а) наявність водневих та іонних зв'язків; б) наявність пептидних зв'язків; в) вторинна та третинна будова; г) добра розчинність у воді? 91.Які властивості характерні для нативних білків: а) колоїдні; б) незалежність від змін рН і підвищення температури; в) наявність вільних аміногруп, які містяться в έ-аміногрупах лізину, та вільних карбоксильних груп, що входять до складу залишків аспартату та глутамату; г) в основному гідрофобні властивості; д) стандартний характер розміщення амінокислот у поліпептидних ланцюгах; є) висока специфічність первинної структури; є) незначна кількість у білкових молекулах інших ковалентних зв'язків, крім пептидних? 92. Які властивості характерні для гемоглобіну: а) наявність однієї групи гема; б) молекулярна маса, що в чотири рази перевищує масу міоглобіну; в) із чотирьох поліпептидних ланцюгів гемоглобіну два є однаковими; г) кожна субодиниця молекули гемоглобіну нагадує за своєю третинною будовою молекулу міоглобіну? 93. Яку роль відіграють ковалентні зв'язки в білках: а) сполучають білковий і небілковий компоненти в молекулах ліпопротеїдів; б) підтримують -спіральну конформацію поліпептидного ланцюга; в) використовуються під час з'єднання амінокислот у білковій молекулі? 94. Від чого залежить швидкість седиментації білків: а) від кількості розчинених молекул; б) від молекулярної маси білка 95. Які властивості білка визначають його розчинність: а) молекулярна маса; б) значення рН та йонної сили розчину; в) наявність у структурі гідрофільних амінокислот? 96. Від яких факторів залежить осмотичний тиск білкових розчинів: а) від молекулярної маси білка; б) від числа розчинених молекул? |
