Эссе по философии, может ли машина мыслить. Контрольная работа 1 По учебной дисциплине Химия и инженерная экология
 Скачать 340.92 Kb. Скачать 340.92 Kb.
|
По кратности (по числу связывающих электронных пар):Ординарная(простая)σ - атомы связаны одной общей электронной парой.  H H Cl Cl H H Cl Cl Двойная1σи1π - атомы связаны двумя общими электронными парами. H2C CH2 Двойная1σи1π - атомы связаны двумя общими электронными парами. H2C CH2 Тройная1σи2π - атомы связаны тремя общими электронными парами. N N Тройная1σи2π - атомы связаны тремя общими электронными парами. N NСпособы образования ковалентной химической связи.Обменныймеханизмобразования: образование ковалентной связи путем обобществления неспаренных электронов двух атомов. Связь возникает благодаря образованию общей электронной пары s- электронами атомов водорода (перекрыванию s-орбиталей): HCl — хлороводород: Связь возникает за счет образования общей электронной пары из s− и p−электронов (перекрывания s−p−орбиталей): Cl2: в молекуле хлора ковалентная связь образуется за счет непарных p−электронов (перекрывание p−p−орбиталей): N2: в молекуле азота между атомами образуются три общие электронные пары: Донорно-акцепторныймеханизм образования: при взаимодействии одного атома или иона с заполненной АО с другим атомом или ионом с вакантной (свободной) АО. 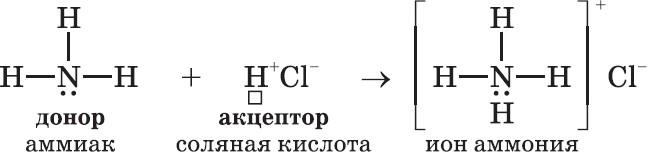 Донор – атом или ион, поставляющий пару электронов. Акцептор – атом или ион, к которому эта пара электронов перемещается. Например, взаимодействие молекулы аммиака с ионом водорода. Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона. В молекуле аммиака неспаренные р-электроны образуют три электронные пары с атомами водорода. Остается одна неподеленная пара электронов. У иона водорода нет электронов (свободная орбиталь). При их взаимодействии образуется ковалентная связь по донорно-акцепторному механизму. Атомы, внешняя электронная оболочка которых состоит только из s- и р- орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается адаптивный механизм образования связи. Примером проявления адаптивного механизма при образовании связи служит взаимодействие двух атомов хлора. Два атома хлора в молекуле Cl2 образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, происходит перекрывание 3р-орбитали атом Cl-1, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-2, а также перекрывание 3р-орбитали атом Cl-2, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-1. Действие дативного механизма приводит к увеличению прочности связи. Поэтому молекула Cl2 является более прочной, чем молекула F2, в которой ковалентная связь образуются только по обменному механизму:
|
