Эссе по философии, может ли машина мыслить. Контрольная работа 1 По учебной дисциплине Химия и инженерная экология
 Скачать 340.92 Kb. Скачать 340.92 Kb.
|
Особенности ковалентной связиНасыщаемость. В химическом взаимодействии участвуют только электроны внешних энергетических уровней (т.е. ограниченное число электронов). Направленность. Так как электронные облака атомов имеют определенную пространственную ориентацию, то область перекрывания электронных облаков находится в определенном направлении по отношению к взаимодействующим атомам. В зависимости от направления перекрывания АО различают σ-, π-, δ-связи. σ-связь (сигмасвязь) возникает при перекрывании АО вдоль оси, соединяющей ядра атомов. π-связь (писвязь) возникает при перекрывании АО по обе стороны оси, соединяющей ядра атомов. δсвязь (дельта-связь) возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях. Кратность связи. π- и δ-связи налагаются на σ-связи, в результате чего образуются кратные (двойные и тройные) связи (в молекулах СО2, N2). Гибридизация атомных орбиталей. Согласно теории гибридизации Атомных Орбиталей, при образовании молекул происходит изменение энергии и формы Атомных Орбиталей. Вместо неравноценных s- и р- орбиталей, образуются гибридные орбитали, которые имеют одинаковую энергию и форму, т.е. происходит гибридизация (смешение) АО. При этом образуются более устойчивые молекулы, т.к. энергия связи становится больше. 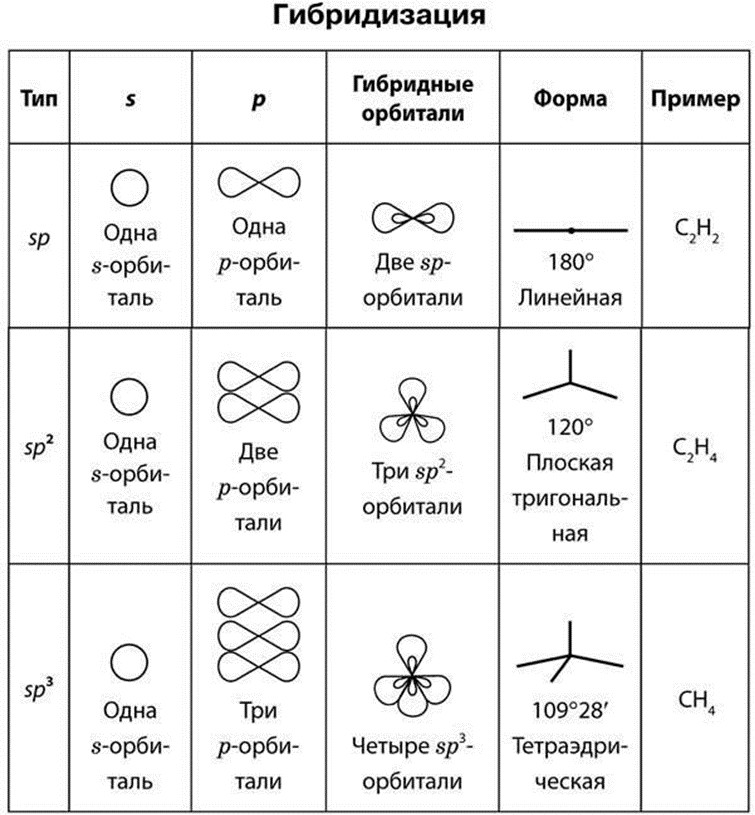 Рис. Типы гибридизации. Классификация ковалентной связи:По степени Полярности: Ковалентная неполярнаяхимическая связь образуется в молекулах, содержащих ядра атомов одного и того же элемента. При этом пара электронов в равной мере принадлежит обоим атомам, т.е. каждое ядро с одинаковой силой притягивает эту пару электронов. Например, молекулы H2, N2, Cl2, O2, Br2, F2 Ковалентная полярнаяхимическаясвязь образуется в молекулах, содержащих ядра атомов разных элементов с разной электроотрицательностью (ЭО) (обычно двух неметаллов). (Согласно Л. Полингу, ЭО – это сила притяжения электрона к атому в ковалентной связи.) При этом пара электронов смещается в сторону более электроотрицательного атома. Например, ЭО фтора (4,0) больше ЭО водорода (2,1), поэтому общая пара электронов, образующая химическую связь, смещена в сторону фтора. Один из атомов приобретает избыточный отрицательный заряд, другой избыточный положительный заряд (эффективные заряды атомов в молекуле). Возникает в сложных веществах, образованных атомами неметаллов: NH3, HCl, H2O, CO2, HF. d+ d- H По способу перекрывания АО:σ(сигма)связь – область перекрывания АО находится на линии, соединяющей центры взаимодействующих атомов.  π(пи)связь – две области перекрывания АО находится по обе стороны от линии, соединяющей центры взаимодействующих атомов. π связь всегда дополняет σ в двойной и тройной связи. 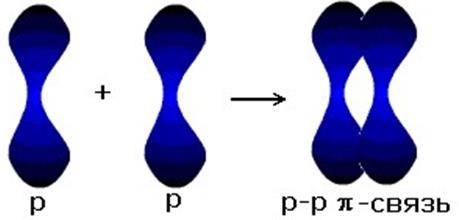 |
