Эссе по философии, может ли машина мыслить. Контрольная работа 1 По учебной дисциплине Химия и инженерная экология
 Скачать 340.92 Kb. Скачать 340.92 Kb.
|
Ионная химическая связь определение.Ионная связь – вид химической связи за счет электростатического притяжения между ионами. Эта связь между атомами с большой разницей электроотрицательности. Na +Cl-, CaO, Na OH ОЭО металлов значительно меньше, чем ОЭО неметаллов. Ионная связь имеет место в солях, основных оксидах, основаниях. Ионная ХС возникает при электростатическом взаимодействии противоположно заряженных ионов. Идея выдвинута В. Косселем (1916): один из атомов отдает электроны, а другой – их принимает. Ионная ХС возникает лишь при больших различиях в ЭО атомов. Например, между цезием и фтором разница ЭО более 3 единиц. Типичные соединения с ионной связью – галогениды щелочных металлов (CsF, CsCl, NaCl). Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным. Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне. Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами. Химическая связь, возникающая между ионами, называется ионной. Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль): Процесс превращения атомов в ионы изображен на схеме: 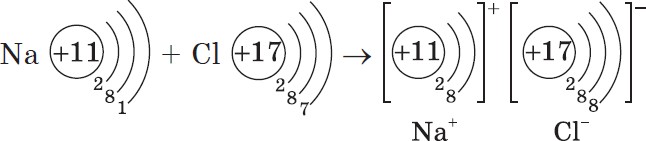 Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов. Рассмотрим алгоритм (последовательность) рассуждений при записи образования ионной связи, например между атомами кальция и хлора: Кальций — это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть: 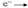 Ca0 – 2 Ca2+ Ca0 – 2 Ca2+Атом Ион Хлор — это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:  Cl0 + 1 Cl- Cl0 + 1 Cl-Атом Ион Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2·1). Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, т.е. надо взять один атом Са, и сколько атомов хлора надо взять, чтобы они могли принять два электрона, т.е. нужно взять два атома Cl. Схематично образование ионной связи между атомами кальция и хлора можно записать так: 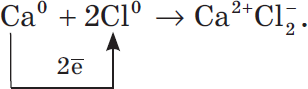 |
