Кр1 81-1. Контрольная работа 1 в какой массе Naoh содержится то же количество эквивалентов, что и в 140 г koh
 Скачать 137.5 Kb. Скачать 137.5 Kb.
|
|
Контрольная работа №1 2. В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г KOH. Решение: Молярная масса гидроксида калия равна Поскольку гидроксид калия – однокислотное основание, то его молярная масса и молярная масса его эквивалентов численно равны Находим количество эквивалентов гидроксида калия в 140 г По условию Молярная масса гидроксида натрия равна Поскольку гидроксид натрия – однокислотное основание, то его молярная масса и молярная масса его эквивалентов численно равны Находим массу гидроксида натрия, содержащую 2,5 моль эквивалентов Ответ: 100 г. 20. В тонне морской воды содержится около 50 миллиардов атомов золота. Приняв, что 30 капель воды имеют массу 1 г, вычислите массу золота в 1 г морской воды. Решение: 1 т – 106 г Составляем пропорцию 106 г воды содержат 50∙109 атомов золота 1 г воды содержит N атомов золота Находим число атомов золота в 1 г морской воды Согласно закону Авогадро, 1 моль любого вещества содержит 6,022∙1023 структурных единиц. Количество вещества равно отношению числа структурных единиц к числу Авогадро Молярная масса золота равна Находим массу 50000 атомов золота 54. В атомах каких элементов IV периода наибольшее число непарных d-электронов? Представьте структуру d-подуровней атомов этих элементов. Решение: В 4 периоде наибольшее количество непарных d-электронов (по 5) в атомах имеют хром Cr и марганец Mn. Структура d-подуровней атомов этих элементов
d 75. У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой их этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена. Решение: С позиций теории строения атома легко объясняется возрастание металлических свойств элементов в каждой группе с ростом заряда ядра атома. Сравнивая, распределение электронов по уровням в атомах и Внешние электроны в атоме селена находятся дальше от ядра и поэтому слабее удерживаются. По этой причине атомы селена могут отдавать электроны или, иными словами, проявлять сильнее металлические свойства, чем хром. С водородом хром непосредственно не взаимодействует. Водород непосредственно реагирует с селеном при температурах ниже 250 °С; с максимальным выходом реакция протекает при 575 °С. Выше этой температуры реакция становится обратимой. Образующийся селенистый водород 112.Что называют электрическим моментом диполя? Какая из молекул HCl, HBr, HI имеет наибольший момент диполя? Почему? Решение: Дипольный момент – это характеристика, отражающая несимметричное рас-пределение электронной плотности в молекуле, выражающаяся в Кл·м. Величина дипольного момента – разница электроотрицательностей элемен-тов (ОЭО) по шкале Полинга ∆ОЭО (HCl) = 3,0 – 2,1 = 0,9 ∆ОЭО (HBr) = 3,0 – 2,5 = 0,5 ∆ОЭО (HI) = 2,5 – 2,1 = 0,4 Все молекулы несимметричны и наибольший дипольный момент имеет молекула хлороводорода. 126. Произведите приблизительную оценку длины связей в молекулах NO и SO, если межъядерные расстояния в молекулах N2, O2 и S2 соответственно равны: 1,09·10-10 м, 1,20·10-10 м и 1,92·10-10 м. Решение: Находим длину связи N – O в молекуле NO Находим длину связи S – O в молекуле SO 156. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2 (г) + СО2(г) = СО(г) + Н2О(ж); ∆Н = -2,85 кДж. Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ∆G0298 этой реакции. Решение: Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Самопроизвольно протекающие процессы идут в сторону уменьшения изменения энергии Гиббса ( Энтропия ( Находим изменение энтропии реакции при стандартных условиях, используя табличные значения абсолютных энтропий веществ. Находим изменение энергии Гиббса при стандартных условиях Поскольку Ответ: +19,91 кДж. 175. Найдите изменение внутренней энергии при испарении 75 г этилового спирта при температуре кипения, если удельная теплота его испарения равна 857,7 Дж/г, а удельный объем пара при температуре кипения равен 607 см3/г. Объемом жидкости пренебречь. Решение: Согласно 1 закону термодинамики где: С учетом массы 201. Дана реакция CH4(г) + H2O(г) ↔ CO(г) + 3H2(г), ΔH = -206 кДж. Как повлияют на эту реакцию: а) понижение температуры; б) понижение давления; в) разбавление компонентов реакции инертным газом? Решение: В соответствии с принципом Ле Шателье, если на систему, находящуюся в состоянии динамического равновесия, оказать воздействие, то равновесие сместится в том направлении, которое позволит уменьшить оказываемое воздействие. а) Отрицательное значение б) Прямая реакция протекает с увеличением числа газообразных частиц в системе. Из 2 моль исходных газообразных реагентов образуется 4 моль газообразных продуктов реакции. Таким образом, в ходе протекания реакции давление в системе самопроизвольно увеличивается. В соответствии с принципом Ле Шателье принудительное понижение давления будет способствовать смещению равновесия сторону прямой реакции. в) Разбавление смеси инертным газом равноценно уменьшению концентраций газообразных веществ (уменьшению давления). В данном случае разбавление смеси инертным газом будет способствовать смещению равновесия в сторону прямой реакции. 210. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60°С, если температурный коэффициент скорости данной реакции 2 ? Решение: Дано: Решение: t  2 – t1 = 60 ºC Зависимость скорости химической реакции от температуры 2 – t1 = 60 ºC Зависимость скорости химической реакции от температуры γ = 2 определяется эмпирическим правилом Вант-Гоффа по  формуле формулеНайти где: Подставляем числовые значения в формулу Находим отношение скоростей реакций реакции 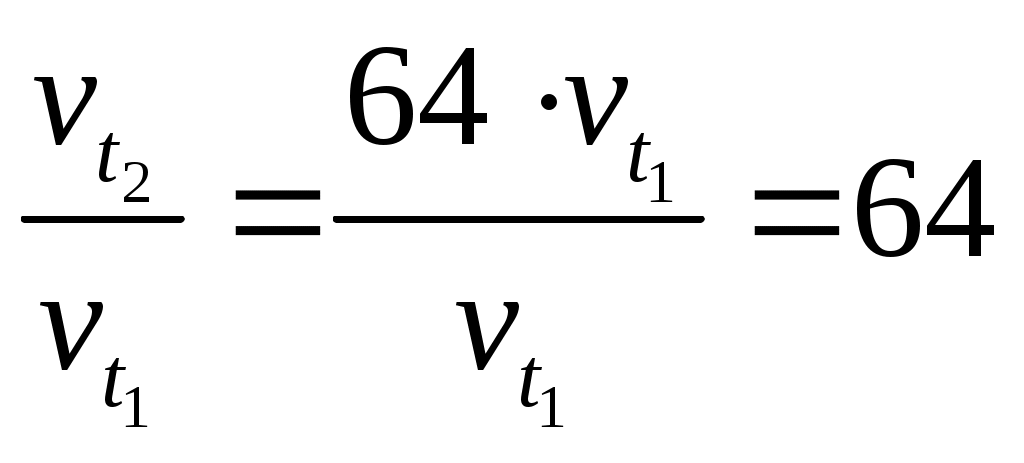 В случае данной химической реакции при повышении температуры на 60 ºС скорость реакции увеличится в 64 раза. Ответ: увеличится в 64 раза. |
