Контрольная по биотехнологии. биотехнология. Контрольная работа по дисциплине Биотехнология
 Скачать 499.4 Kb. Скачать 499.4 Kb.
|
|
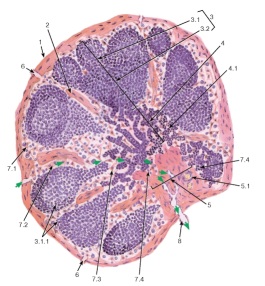
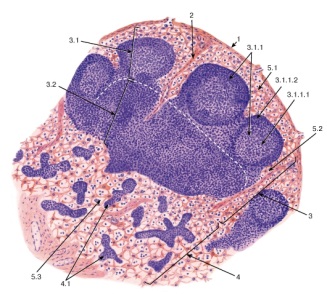
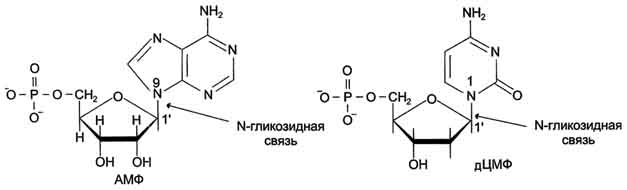
МИНЕСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДИРАЦИИ Федеральное государственное бюджетное образовательное Учреждение высшего образования «АЛТАЙСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ» Кафедра микробиологии, эпизоотологии, паразитологии и ветеринарно-санитарной экспертизы КОНТРОЛЬНАЯ РАБОТА по дисциплине «Биотехнология» Выполнила студентка 3 курса направления 111900 – «Ветеринарно-санитарная экспертиза» заочной формы обучения Грудий Юлия Алексеевна Подпись Дата сдачи контрольной работы «10» октября 2017 года. Номер зачетной книжки Проверила Оценка ________________________________________ Подпись преподавателя __________________________ Дата проверки контрольной работы «____» октября 2017 года. Барнаул 2017г. ОглавлениеГенная инженерия. 4 Иммунитет, 10 Получение соматропина с помощью генной инженерии 14 Список литературы 16 Генная инженерия.Структурные элементы нуклеиновых кислот. Первичная структура нуклеиновой кислоты. Вторичная структура ДНК, вторичная структура РНК, биосинтез НК и белков, матричный биосинтез. Методы генной инженерии, повышение эффективности биотехнологии методами генной инженерии, получение новых препаратов методами генной инженерии. При оптимизации любого биотехнологического процесса, протекающего с участием живых организмов, основные усилия обычно направлены на улучшение их генетических свойств. В настоящее время разрабатываются и применяются принципиально новые методы, основанные на технологии рекомбинантных ДНК. Модификация генетического материала осуществляется разными методами: в живом организме (in vivo) и вне его (in vitro), соответственно, это два направления - клеточная инженерия и генетическая инженерия. На базе молекулярной биологии и генетики микроорганизмов к началу 60-х гг. сформировалась молекулярная генетика. Г. Гамов в 1954 г. выдвинул гипотезу о том, что каждый кодон (последовательность нуклеотидов, кодирующая одну аминокислоту) должен состоять из трех нуклеотидов. В 1961 г. было подтверждено экспериментально, что первичная структура белка закодирована в ДНК в виде последовательности нуклеотидных триплетов (кодонов), каждая из которых соответствует одной из 20 аминокислот. К 1966 г. удалось получить данные о строении генетического кода. От изучения закономерностей функционирования генетического материала в клетке вскоре исследователи перешли к генетическим манипуляциям. Возникла новая экспериментальная технология, заключающаяся в введении в клетки чужеродных генов. Названия «генетическая (или генная) инженерия» или «работа с рекомбинантными ДНК» эквивалентны. Суть этой технологии заключается в воссоединении фрагментов ДНК in vitro с последующим введением новых («рекомбинантных») генетических структур в живую клетку. В 1972 г. Берг с сотрудниками создали первую рекомбинантную молекулу ДНК, состоящую из фрагмента ДНК вируса ОВ40 и бактериофага X dvgal с галактозным опероном Е. coli. Инструментом для генетического конструирования стали две группы ферментов - рестриктирующие эндонуклеазы (рестриктазы) и лигазы. Первые необходимы для получения однородных фрагментов ДНК, вторые - для их соединения. Рестриктазы и лигазы в совокупности с другими ферментами (нуклеазами, обратной транскриптазой, ДНК-полимеразой и др.) обеспечивают проведение всех генноинженерных манипуляций. Строение нуклеотидов Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. В зависимости от числа имеющихся в молекуле остатков фосфорной кислоты различают нуклеозидмонофосфаты (НМФ), нуклеозиддифосфаты (НДФ), нуклеозидтрифосфаты (НТФ) В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые –аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Пентозы в нуклеотидах представлены либо рибозой (в составе РНК), либо дезоксирибозой (в составе ДНК). Пентозу соединяет с основанием N-гликозидная связь, образованная С1-атомом пентозы (рибозы или дезоксирибозы) и N1 -атомом пиримидина или N9-aтомом пурина. Нуклеотиды, в которых пентоза представлена рибозой, называют рибонуклеотидами, а нуклеиновые кислоты, построенные из рибонуклеотидов, - рибонуклеиновыми кислотами, или РНК. Нуклеиновые кислоты, в мономеры которых входит дезоксирибоза, называют дезоксири-бонуклеиновыми кислотами, или ДНК. Нуклеиновые кислоты по своему строению относят к классу линейных полимеров. Остов нуклеиновой кислоты имеет одинаковое строение по всей длине молекулы и состоит из чередующихся групп - пентоза-фосфат-пентоза- (рис. 4-5). Вариабельными группами в полинуклеотидных цепях служат азотистые основания - пурины и пиримидины. В молекулы РНК входят аденин (А), урацил (U), гуанин (G) и цитозин (С), в ДНК - аденин (А), тимин (Т), гуанин (G) и цитозин (С). Уникальность структуры и функциональная индивидуальность молекул ДНК и РНК определяются их первичной структурой - последовательностью азотистых оснований в полинуклеотидной цепи. 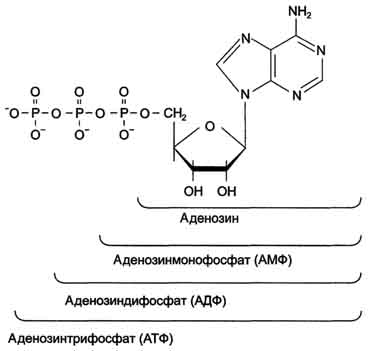 Нуклеозидмоно-, ди- и трифосфаты аденозина. Нуклеотиды - фосфорные эфиры нуклеозидов. Остаток фосфорной кислоты присоединён к 5'-углеродному атому пентозы (5'-фосфоэфирная связь). 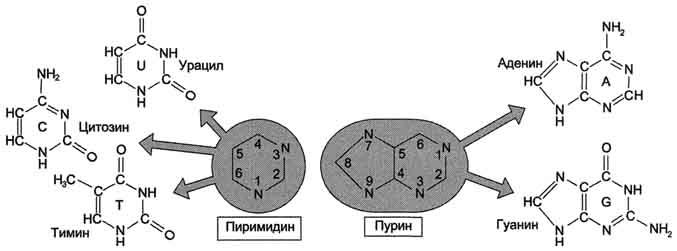 Пуриновые и пиримидиновые основания. Номенклатура нуклеотидов
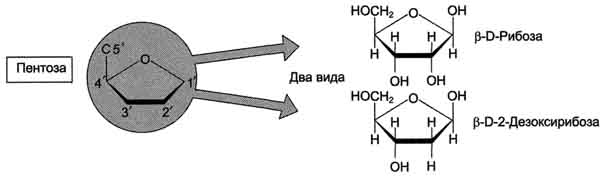  Пентозы. Присутствуют 2 вида – β-D-рибоза в составе нуклеотидов РНК и Пуриновый и пиримидиновый нуклеотиды β-D-2-дезоксирибоза в составе нуклеотидов ДНК. Структура ДНК и РНК - способ "записи информации", обеспечивающий формирование в организме двух информационных потоков. Один из потоков осуществляет воспроизведение информации, заключённой в молекулах ДНК. Удвоение молекул ДНК называют "репликация". В результате этого процесса и последующего деления дочерние клетки наследуют геном родительской клетки, в котором содержится полный набор генов, или "инструкций" о строении РНК и всех белков организма. Второй поток информации реализуется в процессе жизнедеятельности клетки. В этом случае происходит "считывание", или транскрипция, генов в форме полинуклеотидных последовательностей мРНК и использование их в качестве матриц для синтеза соответствующих белков. В последнем случае осуществляется "перевод" (трансляция) информации, заключённой в мРНК, на "язык" аминокислот. Этот поток информации от ДНК через РНК на белок получил название "центральная догма биологии". Он характерен для всех живых организмов, за исключением некоторых РНК-содержащих вирусов. Матричная природа синтеза нуклеиновых кислот и белков обеспечивает высокую точность воспроизведения информации. Так, в ходе репликации дочерние молекулы ДНК синтезируются на нитях материнской ДНК. При образовании всех видов РНК, необходимых для синтеза белков, информация об их структуре "считывается" с определённых генов в молекулах ДНК. В синтезе новых молекул белков матрицей, содержащей информацию об их строении, являются мРНК. Исправление ошибок, возникающих в структуре ДНК под воздействием факторов внешней и внутренней среды, осуществляет ещё один матричный синтез - репарация. Он является вариантом ограниченной репликации и восстанавливает первоначальную структуру ДНК, используя в качестве матрицы участок неповреждённой нити ДНК. При размножении РНК-содержащих вирусов в клетках эукариотических организмов новые молекулы ДНК могут синтезироваться с помощью процесса, в ходе которого РНК служит матрицей для синтеза комплементарной ДНК, которая может включаться в геном высших организмов (обратная транскрипция). Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи. Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной. Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Линейная последовательность дезоксирибонуклеотидов в полимерной цепи ДНК обычно сокращённо записывают с помощью однобуквенного кода, например -A-G-C-T-T-A-C-A- от 5'- к 3'-концу. В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи. Вторичная структура ДНК. В 1953 г. Дж. Уотсоном и Ф. Криком была предложена модель пространственной структуры ДНК. Согласно этой модели, молекула ДНК имеет форму спирали, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидньхе цепи в ней антипараллельны, т.е. если одна из них ориентирована в направлении 3'→5', то вторая - в направлении 5'→3'. Поэтому на каждом из концов молекулы ДНК расположены 5'-конец одной цепи и 3'-конец другой цепи. 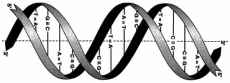 Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи). При таком сочетании каждая пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эрвин Чаргафф в 1951 г. установил закономерности в соотношении пуриновых и пиримидиновых оснований в молекуле ДНК), число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С). Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникаютт гидрофобные взаимодействия, стабилизирующие двойную спираль. Такая структура исключает контакт азотистых остатков с водой, но стопка оснований не может быть абсолютно вертикальной. Пары оснований слегка смещены относительно друг друга. В образованной структуре различают две бороздки - большую, шириной 2,2 нм, и малую, шириной 1,2 нм. Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина. Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов - снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А и Т (две связи) и между G и С (три связи). При таком сочетании каждая пара содержит по три кольца, поэтому общий размер этих пар оснований одинаков по всей длине молекулы. Водородные связи при других сочетаниях оснований в паре возможны, но они значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи. Поэтому, согласно правилу Чаргаффа (Эрвин Чаргафф в 1951 г. установил закономерности в соотношении пуриновых и пиримидиновых оснований в молекуле ДНК), число пуриновых оснований (А + G) равно числу пиримидиновых оснований (Т + С). Комплементарые основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникаютт гидрофобные взаимодействия, стабилизирующие двойную спираль. Такая структура исключает контакт азотистых остатков с водой, но стопка оснований не может быть абсолютно вертикальной. Пары оснований слегка смещены относительно друг друга. В образованной структуре различают две бороздки - большую, шириной 2,2 нм, и малую, шириной 1,2 нм. Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина.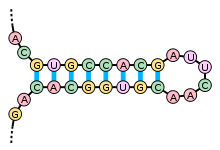 Двойная спираль ДНК. Молекулы ДНК состоят из двух антипараллельных цепей с комплементарной последовательностью нукпеотидов. Цепи закручены относительно друг друга в правозакрученную спираль так, что на один виток приходится примерно 10 пар нуклеотидов. Двойная спираль ДНК. Молекулы ДНК состоят из двух антипараллельных цепей с комплементарной последовательностью нукпеотидов. Цепи закручены относительно друг друга в правозакрученную спираль так, что на один виток приходится примерно 10 пар нуклеотидов.Вторичная структура РНК Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписьюающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК. Наиболее распространенным методом генной инженерии является метод получения рекомбинантных, т.е. содержащих чужой ген, плазмид. Технология рекомбинантных ДНК использует следующие методы: специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее выделение и манипуляции с отдельными генами; быстрое секвенирование всех нуклеотидов очищенном фрагменте ДНК, что позволяет определить границы гена и аминокислотную последовательность, кодируемую им; конструирование рекомбинантной ДНК; гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью, основанную на их способности связывать комплементарные последовательности нуклеиновых кислот; клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий; введение рекомбинантной ДНК в клетки или организмы. Плазмиды представляют собой кольцевые двухцепочечные молекулы ДНК, состоящие из нескольких пар нуклеотидов. Плазмиды являются автономными генетическими элементами, реплицирующимися (т.е. размножающимися) в бактериальной клетке не в то же время, что основная молекула ДНК. Хотя на долю плазмид приходится лишь небольшая часть клеточной ДНК, именно они несут такие жизненно важные для бактерии гены, как гены лекарственной устойчивости. Разные плазмиды содержат разные гены устойчивости к антибактериальным препаратам. Мощным инструментом генной инженерии являются ферменты – рестрикционные эндонуклеазы, или рестриктазы. Рестрикция буквально означает «ограничение». Бактериальные клетки вырабатывают рестриктазы для разрушения инородной, в первую очередь фаговой ДНК, что необходимо для ограничения вирусной инфекции. Клонированием, состоит из последовательных стадий: 1. Рестрикция – разрезание ДНК человека рестриктазой на множество различных фрагментов, но с одинаковыми «липкими» концами. Такие же концы получают при разрезании плазмидной ДНК той же рестриктазой. Система рестрикции-модификации — ферментативная система бактерий, разрушающая попавшую в клетку чужеродную ДНК. Основная её функция — защита клетки от чужеродного генетического материала, например, бактериофагов и плазмид. Для компонентов системы характерны два типа активности — метилтрансферазная (метилазная) и эндонуклеазная. За каждую из них могут отвечать как отдельные белки, так и один белок, сочетающий в себе обе функции. 2. Лигитирование – включение фрагментов ДНК человека в плазмиды благодаря «сшиванию липких концов» ферментом лигазой. Этот метод является самым распространенным и популярным. Впервые этим способом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Некоторые рестриктазы, например Pst I, внося в цепи ДНК симметричные, расположенные наискось друг от друга разрывы на равных расстояниях от центра сайта узнавания и образующие "ступеньку". Эти комплементарные друг другу участки имеют тенденцию к ассоциации за счет спаривания оснований, и поэтому их называют комплементарными или липкими концами. Спаривание оснований происходит только между комплементарными последовательностями, поэтому ААТТ-концы, образуемые Eco RI, не будут спариваться, например, с АГЦТ-концами, образуемыми Hind III. Но любые два фрагмента (независимо от их происхождения), образовавшиеся под действием одной и той же рестриктазы, могут слипаться за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов. 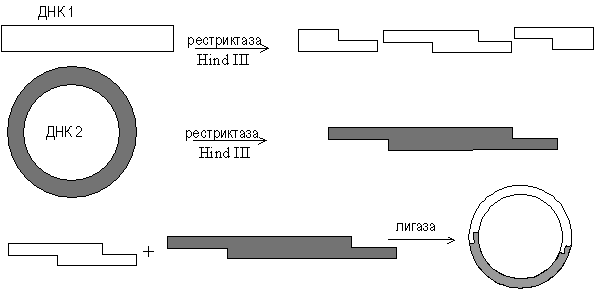 Схема рестриктазно - лигазного метода Схема рестриктазно - лигазного методаОднако после такого спаривания полной целостности двойной спирали не восстановится, поскольку останется два разрыва в фосфодиэфирном остове. Для его восстановления, то есть сшивания, или лигирования нитей используют фермент ДНК-лигазу. Этот фермент в живой клетке выполняет ту же функцию - сшивание фрагментов ДНК, синтезирующихся при репликации. 3. Трансформация – введение рекомбинантных плазмид в бактериальные клетки, обработанные специальным образом – так, чтобы они на короткое время стали проницаемыми для макромолекул. Трансформированные бактерии вместе с плазмидой приобретают устойчивость к определенному антибиотику. Это позволяет их отделить от нетрансформированных бактерий, погибающих на среде, содержащей этот антибиотик. Каждая из трансформированных бактерий размножается и образует колонию из многих тысяч потомков – клон. 4. Скрининг – отбор среди клонов тех бактерий, которые несут нужный ген человека. Для этого все бактериальные колонии накрывают специальным фильтром. Когда его снимают, на нем остается отпечаток колоний, так как часть клеток из каждого клона прилипает к фильтру. Затем проводят молекулярную гибридизацию. Фильтры погружают в раствор с радиоактивно меченым зондом. Зонд – это полинуклеотид комплементарной части искомого гена. Он гибридизуется лишь с теми рекомбинантными плазмидами, которые содержат нужный ген. После гибридизации на фильтр в темноте накладывают рентгеновскую фотопленку и через несколько часов ее проявляют. Положение засвеченных участков на пленке позволяет найти среди множества клонов трансформированных бактерий те, которые имеют плазмиды с нужным геном. Не всегда удается вырезать нужный ген с помощью рестриктаз. Поэтому в ряде случаев процесс клонирования начинают с целенаправленного получения нужного гена. Для этого из клеток человека выделяют и-РНК, являющуюся транскрипционной копией этого гена, и с помощью фермента – обратной транскриптазы синтезируют комплементарную ей цепь ДНК. Затем и-РНК, служившая матрицей при синтезе ДНК, уничтожается специальным ферментом, способным гидролизовать цепь РНК, спаренную с цепью ДНК. Оставшаяся цепь ДНК служит матрицей для синтеза обратной транскриптазой, комплетентарной второй цепи ДНК. Получившаяся двойная спираль ДНК носит название к-ДНК (комплементарная ДНК). Она соответствует гену, с которого была считана и-РНК, запущенная в систему с обратной транскриптазой. Такая к-ДНК встраивается в плазмиду, которой трансформируют бактерии и получают клоны, содержащие только выбранные гены человека. Чтобы осуществить перенос генов, необходимо выполнить следующие операции: · Выделение из клеток бактерий, животных или растений тех генов, которые намечены для переноса. · Создание специальных генетических конструкций, в составе которых намеченные гены будут внедряться в геном другого вида. · Внедрение генетических конструкций сначала в клетку, а затем в геном другого вида и выращивание измененных клеток в целые организмы. Из многих сотен препаратов, полученных методом генетической инженерии, в практику внедрена только часть: интерфероны, ин-терлейкины, фактор VIII, инсулин, гормон роста, тканевый активатор плазминогена, вакцина против гепатита В, моноклональ-ные антитела для предупреждения отторжения при пересадках почки, диагностические препараты для выявления ВИЧ и др Медицинские препараты, разрабатываемые методами современной биотехнологии Антикоагулянты и тромбо-тканевый активатор плазминогена, факлитикиторы VIII и IX. Колониестимулирующие Соматомедин С, гранулоцитный КСФ, факторы (КСФ)макрофагальный КСФ. Иммуноцитокины Интерфероны, интерлейкины, фактор некроза опухолей, миелопептиды, пептиды вилочковой железы. Гормоны Гормон роста, инсулин, эритропоэтин. Ферменты Липазы, протеазы. Вакцины Против ВИЧ-инфекции, гепатита В, малярии и др. Диагностикумы Для выявления ВИЧ-инфекции, гепатита В, сифилиса и др. РецепторыТ-4 лимфоцитов (белок СД-4) и др. Моноклональные антитела. Прочие Триптофан, белок А, альбумин, поведенческие пептиды и др. Однако метод генетической инженерии относится к числу перспективнейших при получении многих белковых биологических веществ, представляющих ценность для медицины. В области создания биологически активных веществ медицинского назначения с помощью метода генетической инженерии исследования продолжаются на следующем этапе . создаются препараты второго поколения, т. е. аналоги природных веществ, обладающих большей эффективностью действия. При определении целесообразности и экономичности методов генетической инженерии для получения медицинских или других препаратов по сравнению с традиционными способами учитываются многие обстоятельства, в первую очередь доступность этого метода, экономичность его, качество получаемого препарата, новизна, безопасность проведения работ и др. Метод генетической инженерии является единственным при получении препаратов, если природный микроорганизм или животные и растительные клетки не культивируются в промышленных условиях. Например, возбудитель сифилиса или малярийный плазмодий практически не растет на искусственных питательных средах. Поэтому для получения диагностических препаратов или вакцин прибегают к клонированию или синтезу генов протективных антигенов, их встраиванию в легко культивируемые бактерии. При выращивании этих рекомбинантных бактерий-реципиентов получают нужные антигены, на основе которых создают диагностический препарат или вакцину. Таким образом, уже производится вакцина против гепатита В. Ген HBs-антигена вируса гепатита встроен в дрожжевую клетку; при выращивании дрожжей образуется HBs-антиген, из которого готовят вакцину. Метод генетической инженерии предпочтительнее также в том случае, когда микроорганизм высоко патогенен и опасен при промышленном производстве. Например, для получения из ВИЧ диагностических препаратов и вакцин предпочитают не выращивать вирус в больших количествах, а необходимые антигены получают методом генетической инженерии. К настоящему времени практически все основные антигены ВИЧ (р24, gp41, gp20 и др.) получены путем выращивания рекомбинантных штаммов Е. coli или дрожжей, способных продуцировать эти антигены. На основе рекомбинантных белков уже созданы диагностические препараты для обнаружения СПИДа. Получение природного инсулина . гормона для лечения диабета, основанное на извлечении его из поджелудочных желез крупного рогатого скота и свиней, сдерживается дефицитом сырья. Кроме того, гормон имеет животное происхождение. Разработанный генетической инженерией метод получения человеческого инсулина путем выращивания рекомбинантного штамма Е. coli решил проблему обеспечения больных этим жизненно важным препаратом. Такая же ситуация наблюдается и в отношении гормона роста человека, получаемого из гипофиза умерших людей. Этого гормона не хватало для лечения карликовости, быстрейшего заживления ран и т.д. Генетическая инженерия решила эту проблему: достаточно 1000 л культуры рекомбинантного штамма Е. coli, чтобы получить количество гормона, достаточное для лечения карликовости, например, в такой большой стране, как США. Большую группу иммуноцитокинов эндогенного происхождения, играющих большую роль в регуляции иммунитета, кооперации иммунокомпетентных клеток и в связи с этим используемых для лечебных и профилактических целей при иммунодефицитах, опухолях, нарушениях работы иммунной системы, получают главным образом методом генетической инженерии, поскольку этот метод эффективнее традиционного. К им-муноцитокинам относят интерлейкины (насчитывают 18 разновидностей: ИЛ-1, ИЛ-2... ИЛ-18), миелопептиды, факторы роста, гормоны вилочковой железы. Все они являются пептидами, вырабатываемыми иммунокомпетентными клетками, и обладают биологическим действием, влияют на пролиферацию, дифференцировку или физиологическую активность иммунокомпетентных и других клеток (Т- и В-лимфоцитов, макрофагов). Иммуноцитокины получают путем культивирования клеток (лимфоцитов, макрофагов и др.) на искусственных питательных средах. Однако процесс этот сложен, продукция иммуноцитокинов незначительна и не имеет практического значения. Поэтому для получения иммуноцитокинов применяют метод генетической инженерии. Уже созданы рекомбинантные штаммы Е. coli и другие штаммы, продуцирующие интерлейкины (ИЛ-1, 2, 6 и др.), фактор некроза опухолей, фактор роста фибробластов и др. Это значительно ускорило процесс внедрения иммуноцитокинов в практику. Метод генетической инженерии используется для получения принципиально новых продуктов и препаратов, не существующих в природе. Например, только с помощью генетической инженерии можно получить рекомбинантные поливалентные живые вакцины, несущие антигены нескольких микроорганизмов. ' Получен рекомбинантный штамм вируса оспенной вакцины, продуцирующий HBs-антиген вируса гепатита В, бешенства, клещевого энцефалита. Такие живые вакцины называют векторными. Метод генетической инженерии позволяет также заменить многие методы, основанные на получении продуктов in vivo, на способы получения этих продуктов in vitro. До последнего времени диагностические, лечебные и профилактические сыворотки получали из крови иммунизированных лошадей или вакцинированных людей-доноров. В настоящее время этот дорогой и , непростой способ вытесняется гибридомной техникой получения антител. Эта техника основана на получении клеток-гибридом путем слияния В-лимфоцитов, взятых от иммунизированных животных и миеломных (раковых) клеток. Образующаяся гибридная клетка (гибридома) обладает способностью миеломной клетки быстро размножаться на искусственных питательных средах и продуцировать при этом антитела (так же, как В-лимфоцит) к антигену, использованному для иммунизации. Гибридомы, продуцирующие антитела, могут выращиваться в больших масштабах в культиваторах или специальных аппаратах. Поскольку образующиеся гибридомой антитела произошли от одной родоначальной клетки (В-лимфоцита), то они называются моноклональными антителами. Моноклональные антитела широко используются для создания диагностических препаратов, а также в некоторых случаях применяются с лечебной целью (в онкологии). Многие фармакологические средства до сих пор получают путем переработки лекарственных трав. Для этого необходимо организовать сбор этих трав или выращивать их на плантации. Биотехнология и генетическая инженерия позволяют получать эти же природные фармакологические вещества путем выращивания в промышленных условиях культур клеток лекарственных растений. В настоящее время налажен выпуск таким способом десятков лекарственных средств, среди них женьшень, строфантин и др. Иммунитет,Понятие иммунитет. Органы иммуногенеза. Специфические и неспецифические факторы иммунитета. Иммунитет– это защита организма от веществ и существ, несущих признаки генетически чужеродной информации. К ним относятся микроорганизмы, вирусы, грибки, простейшие, различные белки, клетки, в том числе и свои собственные – стареющие и модифицированные, злокачественные и пересаженные. Иммунитет связан с оплодотворением, участвует в эмбриональном развитии, защищает человека после родов, осуществляет механизм развития, принимает участие в обмене веществ и т.д. Иммунитет – это невосприимчивость организма к инфекционным заболеваниям, а так же агентам и веществам, обладающим чужеродными для организма, антигенными свойствами. Органы кроветворения и иммуногенеза включают красный костный мозг, тимус, лимфатические узлы, селезенку, миндалины, агрегированные лимфоидные узелки кишки (пейеровы бляшки), лимфоидную ткань червеобразного отростка, а также другие лимфоидные образования пищеварительного тракта, половых, дыхательной и выделительной систем (лимфоидная ткань, ассоциированная со слизистыми оболочками). Помимо структур органного характера, к иммунной системе относятся многочисленные диффузные скопления лимфоидной ткани и рассеянные повсеместно в организме лимфоциты, макрофаги и антиген-представляющие клетки, а также лимфоциты и моноциты крови и лимфы. Функции органов кроветворения и иммуногенеза: участие во взаимосвязанных процессах кроветворения и иммуногенеза, обеспечивающего защиту от микроорганизмов, чужеродных антигенов, иммунный надзор за деятельностью клеток собственного организма. Органы иммунной системы разделяются на центральные и периферические. Центральные (первичные) органы иммунной системы (красный костный мозг, тимус) обеспечивают процессы антиген-независимой пролиферации и дифференцировки лимфоцитов. При этом образуются В- и Т-лимфоциты с огромным репертуаром рецепторов к всевозможным антигенам. Такое разнообразие обусловлено реаранжировкой их генома; антигены на этом этапе не только не нужны, но даже вредны. Из центральных органов иммунной системы лимфоциты мигрируют в периферические органы, распределяясь в зависимости от их типа, по Т- и В-зависимым зонам. Периферические (вторичные) органы иммунной системы (все остальные органы иммунной системы) расположены на путях поступления антигенов через лимфу или кровь. Они обеспечивают контакт лимфоцитов с антигенами и связанные с этим процессы антиген-зависимой пролиферации и дифференцировки лимфоцитов. Красный костный мозг представляет собой центральный орган кроветворения и иммуногенеза, содержащий самоподдерживающуюся популяцию стволовых клеток крови и участвующий в образовании клеток миелоцитарного (эритроциты, тромбоциты, гранулоциты, моноциты) и лимфоцитарного рядов. В нем осуществляется антиген-независимая пролиферация и дифференцировка В-лимфоцитов из их предшественников, происходящих из стволовой клетки крови. Из него в тимус попадают предшественники Т-лимфоцитов (претимоциты). У взрослого красный костный мозг находится в ячейках губчатого вещества костей (в плоских костях и эпифизах трубчатых костей), у детей - также и в диафизах трубчатых костей. В состав красного костного мозга входят три компонента: 1) гемопоэтический, 2) стромальный, 3) сосудистый. Лимфоциты составляют 20% клеток красного костного мозга, из них 3/4 приходятся на развивающиеся и зрелые В-лимфоциты; встречаются также Т- и НК-клетки. В ходе созревания В-лимфоциты контактируют с клетками эндоста, ретикулярными клетками и концентрируются возле синусоидов, в просвет которых они мигрируют по его завершении. При дифференцировке в геноме В-клеток происходит реаранжировка, которая обеспечивает образование на их поверхности иммуноглобулиновых рецепторов к разнообразным антигенам. Созревшие В-клетки покидают костный мозг и заселяют В-зависимые зоны периферических органов иммунной системы. Большая часть (75%) В-лимфоцитов, образовавшихся в костном мозгу, здесь же погибают механизмом апоптоза в процессе отбора, включающего положительную селекцию (выживание клеток с нужными рецепторами) и отрицательную селекцию (гибель клеток с рецепторами к собственным антигенам). Погибшие клетки захватываются макрофагами. Недавно установлено, что красный костный мозг содержит также популяцию эндотелиальных клеток-предшественников, которые мобилизуются из него в кровоток и привлекаются в участки повреждения эндотелия и ишемии тканей, участвуя в регенерации эндотелия и образовании новых сосудов. Точная локализация этих клеток внутри костного мозга не установлена, вероятно, они располагаются в сосудистом компоненте, поскольку в эмбриональном развитии эндотелиальные и кроветворные клетки развиваются из общего источника - кровяных островков в мезенхиме. Тимус - центральный орган иммунной системы, в котором происходит антиген-независимая пролиферация и дифференцировка Т-лимфоцитов из их предшественников, поступающих из красного костного мозга. Наибольшего развития достигает в детстве, после полового созревания подвергается возрастной инволюции, в ходе которой значительная часть его массы замещается жировой тканью. Тимус образован двумя долями, покрытыми снаружи соединительнотканной капсулой, которая продолжается в перегородки, содержащие сосуды и разделяющие каждую долю на связанные друг с другом дольки тимуса. Основу дольки составляют отростчатые ретикулярные эпителиоциты (эпителиальные ретикулярные клетки), образующие трехмерную сеть в корковом и мозговом веществе (корковый и мозговой циторетикулюм). Ретикулярные эпителиоциты создают микроокружение, необходимое для развития лимфоцитов (тимоцитов), лежащих в петлях образуемой ими сети. Корковое вещество (кора) тимуса - более темное вследствие плотного расположения тимоцитов. В него из красного костного мозга поступают предшественники Т-клеток (претимоциты). Пролиферирующие тимоциты располагаются в виде скоплений между эпителиальными клетками в субкортикальной зоне. Созревающие тимоциты, продолжая делиться и смещаясь в более глубокие части коры, становятся иммунокомпетентными клетками. Наиболее зрелые Т-клетки перемещаются в мозговое вещество. Мозговое вещество тимуса - светлее коркового, содержит меньшее количество более зрелых тимоцитов, которые покидают тимус через посткапиллярные венулы в кортико-медуллярной зоне и заселяют Т-зависимые зоны периферических органов иммунной системы. В отдельных участках мозгового вещества эпителиальные клетки уплощаются, ороговевают и накладываются друг на друга концентрическими слоями, образуя слоистые эпителиальные тимусные тельца (Гассаля) Лимфатические узлы - периферические органы иммунной системы, располагающиеся по ходу лимфатических сосудов. Снаружи они покрыты соединительнотканной капсулой; к их выпуклой поверхности подходят приносящие лимфатические сосуды, в области ворот на вогнутой поверхности входят артерии и нервы и выходят выносящий лимфатический сосуд и вены. От соединительнотканной капсулы вглубь органа отходят трабекулы. В каждом узле можно выделить корковое и мозговое вещество.
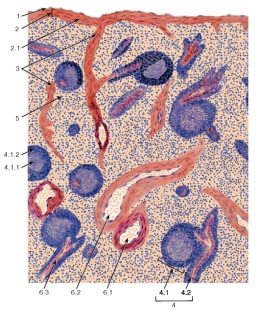
Селезенка - периферический орган иммунной системы, располагающийся по ходу кровеносных сосудов. Помимо участия в формировании гуморального и клеточного иммунитета, она участвует в разрушении старых и поврежденных эритроцитов, а также в депонировании крови. Селезенка покрыта брюшиной (серозной оболочкой) и капсулой из плотной соединительной ткани, содержащей гладкие мышечные клетки, от которой вглубь органа отходят трабекулы, анастомозирующие друг с другом. Строму селезенки образует ретикулярная ткань. В паренхиме (пульпе селезенки) содержатся два отдела с разными функциями: белая пульпа и красная пульпа. Неспецифические факторы иммунитета 1.Тканевые (клеточные) факторы. Среди тканевых факторов важную роль выполняют: a) Иммунологические барьеры, к которым относят защитные свойства кожи, слизистых и лимфоузлов. Кожа и слизистые являются механическим барьером, секрет потовых, сальных желез и секрет слизистых угнетают многие виды патогенных микроорганизмов. Лимфоузлы препятствуют распространению микроорганизмов в макроорганизме, являясь мощным естественным барьером b) Видовая реактивность клеток – отсутствие рецепторов на поверхности клеток делает невозможным адсорбцию и проникновение инфекционного агента или яда в клетку c) Фагоцитоз – процесс активного поглощения клетками макроорганизма попавших в него чужеродных веществ (в т.ч. микроорганизмов) с последующим их перевариваем с помощью внутриклеточных ферментов d) Нормальные киллеры (клетки убийцы) – это цитотоксические лимфоциты, разрушающие клетки-мишени, инфицированные вирусами, и онкогенные клетки под действием лимфотоксинов. 2. Гуморальные факторы неспецифической защиты. Многочисленны, вырабатываются Т-лимфоцитами и макрофагами. К ним относят: a) Комплемент – неспецифическая ферментная система крови, состоящая из 9 различных протеиновых фракций, адсорбирующихся в процессе каскадного присоединения на комплексе антиген + антитело и оказывающих лизирующее действие на связанные антителами клеточные антигены b) Лизоцим – белок, содержащийся в слюне, крови, слезной и тканевой жидкости, активен в отношении грамположительных бактерий, т.к. нарушает синтез муреина в клеточной стенке. c) β-лизины – освобождаются из лейкоцитов и более активны по отношению к грамотрицательным бактериям d) лейкины – протеолитические ферменты, освобождающиеся при разрушении лейкоцитов и нарушающие целостность поверхностных белков микробных клеток e) интерферон – α и β, продуцируются соответственно мононуклеарными фагоцитами и фибробластами и обладают противовирусной активностью f) пропердин – комплекс белков, обладающих противовирусной, антибактериальной активностью в присутствии солей магния, вызывая лизис микроорганизмов и усиливая фагоцитарную реакцию и воспалительный процесс g) эритрин – обладает ингибирующим действием на коринебактерии дифтерии и высвобождается при разрушении эритроцитов h) нормальные антитела – обнаруживаются в крови новорожденных в очень низких титрах, обладают цитофильным действием, уровень их возрастает под действием микроорганизма как пускового сигнала. Образование нормальных антител генетически запрограммировано, они экспрессируются на поверхностных мембранах незрелых В-лимфоцитов в виде рецепторов 3. Факторы саморегуляции: проявляются повышением температуры тела, изменение рН и rН2 пораженных тканей, усилением выделительных функций организма, выведение микроорганизмов и их токсинов с мочой, испражнениями, мокротой и другими экскретами. Специфические факторы иммунитета Специфическая система иммунитета имеет свои центральные (костный мозг, тимус, фабрициева сумка у птиц, печень у млекопитающих) и периферические органы (селезенка, лимфатические узлы, лимфоидные ткани желудочно-кишечного тракта, а также кровь и лимфа, в которые поступают и непрерывно в них циркулируют все иммунокомпетентные клетки). Органом иммунитета является лимфоидная ткань, а его основными исполнителями — макрофаги (а также другие антиген-представляющие клетки), различные популяции и субпопуляции Т- и В-лимфоцитов. К специфическим факторам иммунитета относят. образование антител; иммунный фагоцитоз; киллерная способность лимфоцитов; аллергическая реакция; иммунологическая память; иммунологическая толерантность. Антитела проявляют значимую роль в процессе формирования инфекционного иммунитета и общей защиты организма. Они образуются в организме с помощью стороннего возбудителя путём инфицирования, а также с помощью вакцинации живыми вакцинами. Иммунный фагоцитоз – это поглощение инородных веществ клетками-фагоцитами. Сами по себе они очень подвижны, имеют способность самостоятельно передвигаться по направлению к возбудителю. Этот процесс в медицине носит название хемотаксис. Как правило, процесс фагоцитоза заканчивается тогда, когда клетки «сообщают» организму об окончании захвата и переваривания инородных тел. Специфические факторы защиты организма – это огромное количество взаимосвязанных комплексов, которые направляются на избавление от отдельных антигенов. При проникновении в тело инородный организм начинает процесс размножения и привлекает к себе внимание «родных» клеток иммунной системы. Такие виды клеток известны тем, что они способны распознавать разные виды антигенов и применять методы, которые окажутся наиболее эффективными для борьбы с ними. В целом, весь процесс, который приводит к иммунному ответу, длится от 7 до 14 дней. По истечению этого срока плазмоциты начинают активно вырабатывать антитела. В свою очередь, они проникают в кровь, лимфу, жидкость тканей и продолжают расходиться по организму. Антитела – универсальные виды белков, которые наделены способностью взаимодействовать с определёнными антигенами. Таким образом, все антитела имеют способность уничтожать инородные микроорганизмы и подавлять их деятельность, уничтожать чужеродные клетки и препятствовать действию токсичных веществ. Антитела способны вырабатываться конкретно против того антигена, который проникает в организм. Несмотря на то, что все антитела имеют общую структуру, они способны оказывать разное воздействие на очаги поражения: агглютинины – склеивают антигены; преципитины – оседают на антигенах; лизины – разрушают инородные клетки. Получение соматропина с помощью генной инженерииСоматотропин (гипофизарный гормон роста) впервые был выделен в 1963 г. из трупного материала. Выход гормона из одного гипофиза составлял около 4-6 мг в пересчете на готовый фармацевтический препарат. Для лечения карликовости необходимая доза составляет 6 мг в неделю в течение года. Кроме недостатка по массе, получаемый экстракцией препарат был гетерогенным, против него вырабатывались антитела, которые сводили на нет действие гормона. Более того, и что при получении препарата могло произойти заражение организма медленно развивающими вирусами. Поэтому дети, получавшие данный препарат, нуждались в многолетнем медицинском наблюдении. Генноинженерный препарат имеет несомненные преимущества: доступен в больших количествах, гомогенен, не содержит вирусов. Синтез соматотропина, состоящего из 191 аминокислотного остатка, был осуществлен в США Гедделем с сотрудниками в 1979 г. (компания «Генентек»). Компания "Genentec" в 1980 году разработала технологию производства соматотропина с помощью бактерий, который был лишен перечисленных недостатков. В 1982 году гормон роста человека был получен в культуре E. coli и животных клеток в институте Пастера во Франции, а с 1984 года начато промышленное производство инсулина и в СССР. При производстве интерферона используют как E. coli, S. cerevisae (дрожжи), так и культуру фибробластов или трансформированных лейкоцитов. Аналогичными методами получают также безопасные и дешевые вакцины. При химико-ферментном синтезе ДНК получается ген, кодирующий предшественник соматотропина, поэтому был выбран специальный путь клонирования. На первом этапе клонировали двунитевую ДНК-копию мРНК и расщеплением рестиктазами получали последовательность, кодирующую всю аминокислотную последовательность гормона, кроме первых 23 аминокислот. Далее клонировали синтетический полинуклеотид, соответствующий этим 23 аминокислотам со стартовым ANG кодоном в начале. Два полученных фрагмента соединяли и подстраивали к паре lac- промоторов и участку связывания рибосом. Сконструированный ген трансплантировали в Е. сой. Синтезированный в бактериях гормон обладал требуемой молекулярной массой, не был связан с каким-либо белком; его выход составлял около 100 000 молекул на клетку. Гормон, однако, содержал на N-конце полипептидной цепи дополнительный остаток метионина; при удалении последнего выход гормона был низким. В 1980 г. были получены доказательства того, что генноинженерный соматотропин обладает биологической активностью нативного гормона. Клинические испытания препарата также прошли успешно. В 1982 г. гормон был получен также на основе сконструированной кишечной палочки в Институте Пастера в Париже. Стоимость гормона к 1990 г. снизилась до 5 долларов/ед. В настоящее время его начинают применять в животноводстве для стимулирования роста домашнего скота, удоев и др. Список литературы | ||||||||||||||||||||||||||||||||||||||||||||||||||