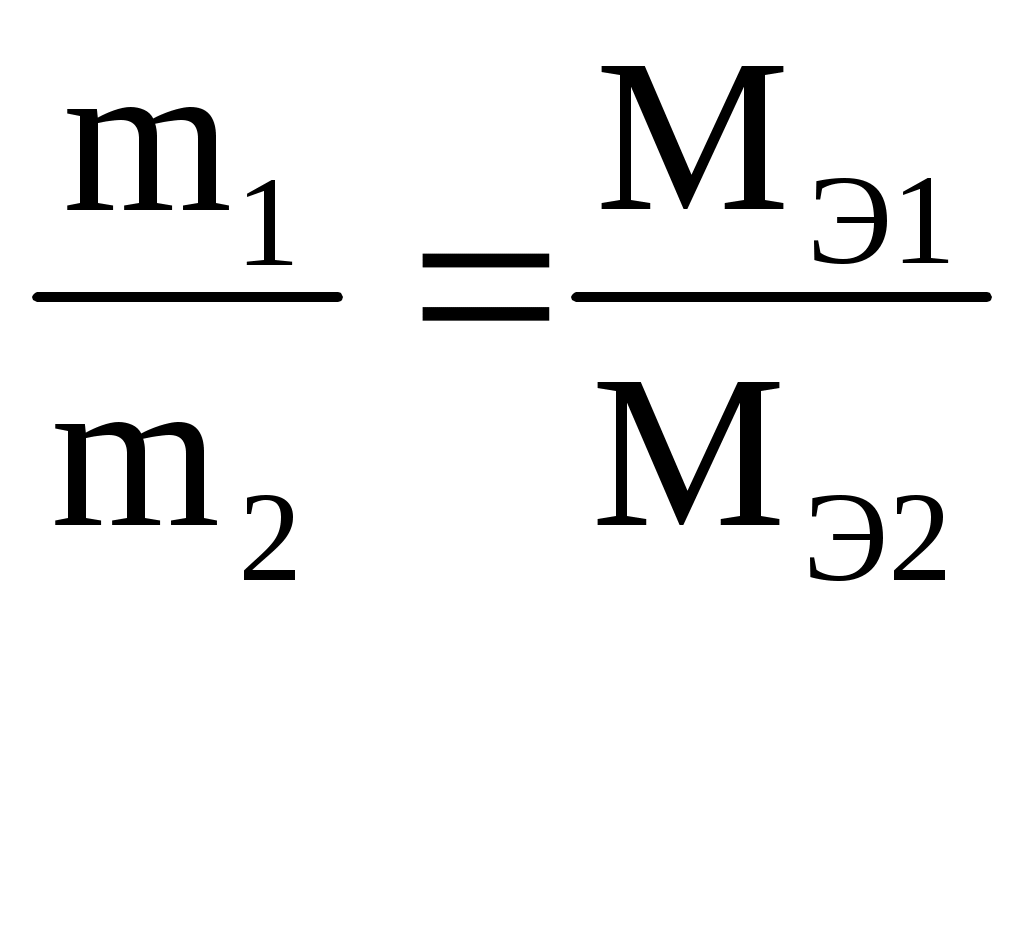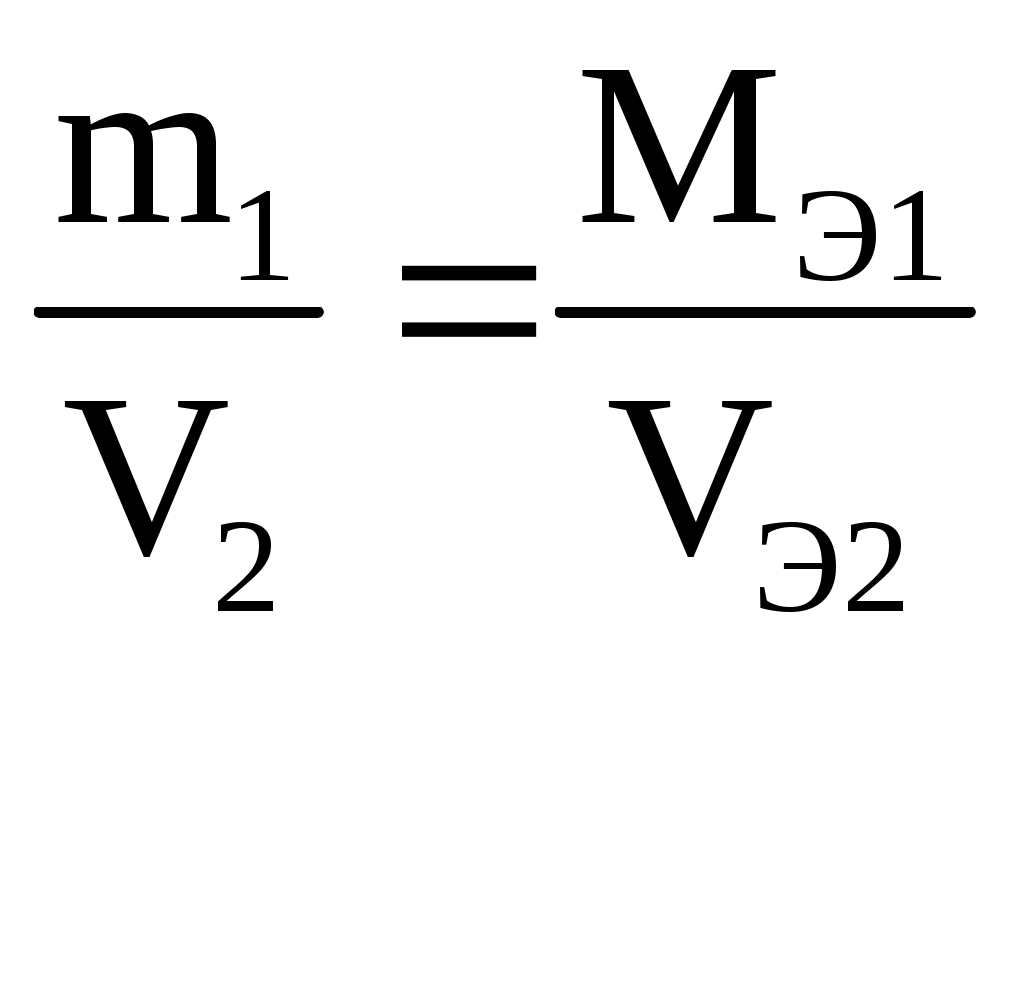|
|
вар 37 ВПИК Контрольная работа по химии. Контрольная работа по дисциплине Химия Вариант 37 Выполнил студент 1 курса Заочного отделения
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА «ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
Контрольная работа по дисциплине «Химия»
Вариант 37
Выполнил студент 1 курса
Заочного отделения
Гр АТЗ-112 сА
____________________
Волгоград 2020
Вариант 37
Тема «Основные понятия и законы химии»
Задание 17
17. При взаимодействии 3,9 г одновалентного металла с водой выделился водород 1,12 л (н.у.). Вычислите эквивалентную массу металла и определите металл.
Решение:
Массы (объемы) реагирующих веществ относятся между собой как их эквивалентные массы (объемы) 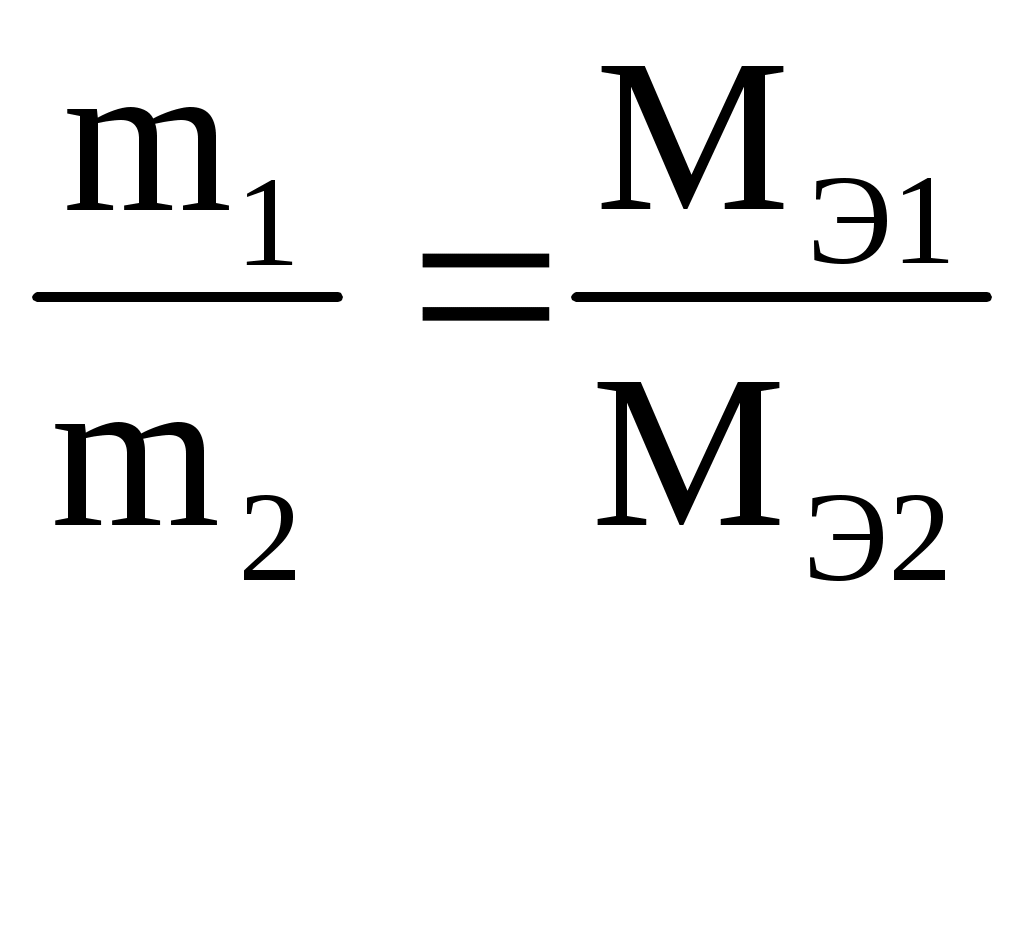 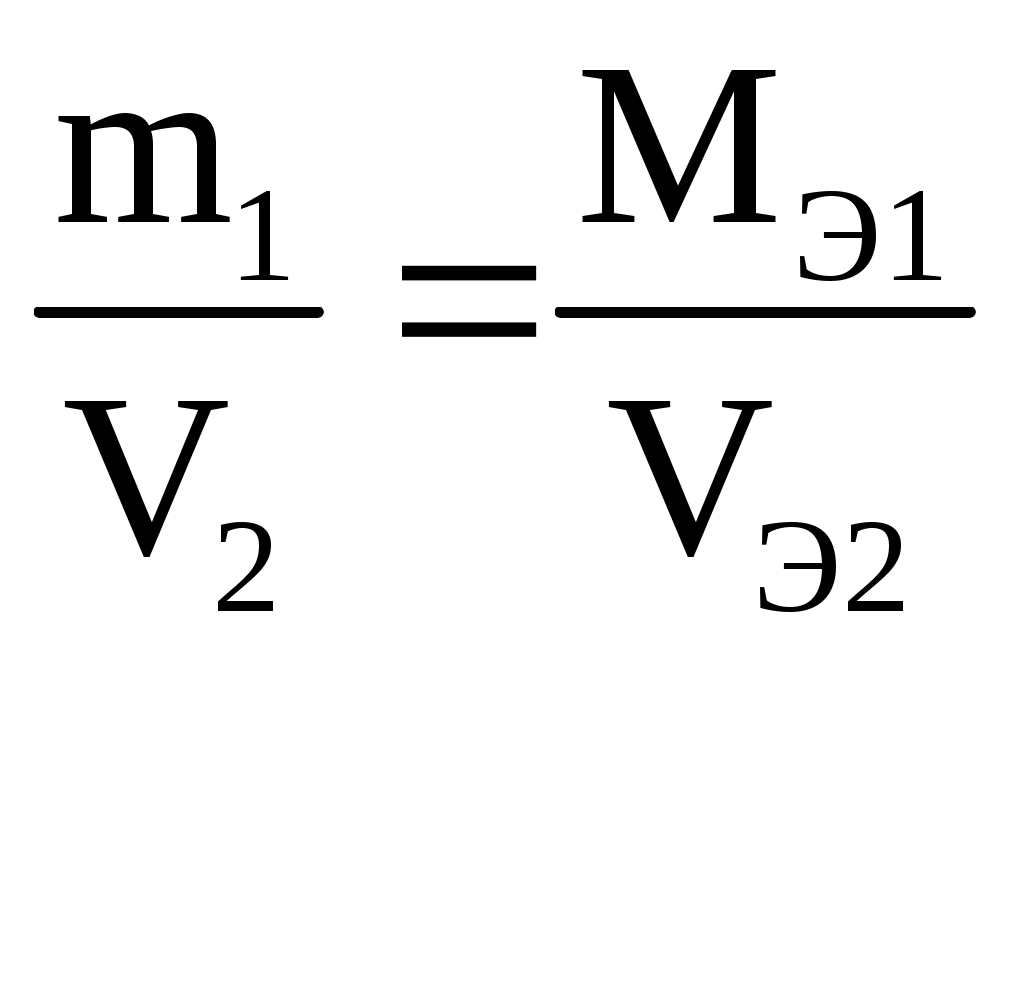
2Me + 2H₂O = 2MeOH + H₂
M(Me) = (3,9 г · 22,4 л/моль) : (1,12 л · 2 моль) = 39 г/моль
Ме - К - калий
2К + 2H₂O = 2КOH + H₂
Ответ: КАЛИЙ, Мэ=39г/моль
Тема 2. Способы выражения количественных соотношений между компонентами системы
Задание 23. В 500 г воды содержится 3,11 моль нитрата лития. Вычислите массовую долю растворенного вещества.
Дано:
m (Н2О) = 500г
n(LiNO3)=3,11моль
Найти: W
Решение: М((LiNO3)=7+14+16·3=69г/моль
m(р-ра LiNO3) = n · М = 3,11 ·69 = 214,6 г
m (р-ра LiNO3) = m(LiNO3)+ m (Н2О) = 214,6+500=714,6г
W(LiNO3) = m(LiNO3) ·100 / m(р-ра LiNO3)=214,6/714,6=0,30 или 30%
Конец формы
Ответ: 30%
3. Водородный показатель среды. Гидролиз
Задание 44. Вычислите концентрацию ионов ОН- и рОН если концентрации ионов Н+ (моль/л) равны: а) 10-8; б) 7•10-2; в) 4,5•10-10.
Дано:
А)[Н+]=10-8 моль/л,
б) [Н+]= 7•10-2;
в) [Н+]=4,5•10-10
Найти: ОН- рОН
Решение: а)pH = -lg[H+] = -lg (10-8) = 8
pOH= 14-8= 6 OH- = 10-рОН=10-6 моль/л
б) pH = -lg[H+] = -lg (7•10-2) = 1,15
pOH= 14-1,15= 12,85 OH- = 10-рОН=10-12,85 =1,4 ·10-13 моль/л
в) pH = -lg[H+] = -lg (4,5•10-10) = 9
pOH= 14-9= 5 OH- = 10-рОН=10-5 =0,00001 моль/л
4. Окислительно-восстановительные реакции
Задание 78.
(NH4)2SO4 + Ca(NO3)2 → CaSO4 + N2 + O2 + H2O
S2Cl2 + NH4Cl → S4N4 + S + HCl
Решение: (N-3H4)2S+6O4-2 + Ca+2 (N+5O3-2)2 → Ca+2S+6O4-2 + N20 + O20+ H2O-2
2N-3- - 6e → N20 | Процесс окисления. Восстановитель
2O-2- 4e → О20| Процесс окисления. Восстановитель
Итого 2 процесса окисления , суммарно 10 электронов участвует
2N+5 + 10e → N20 | 2 | 1 процесс восстановления. Окислитель.
Итого: (NH4)2SO4 + Ca(NO3)2 → CaSO4 +2 N2 + O2 + 4H2O
В реакции азот в степени окисления -3 в ионе аммония и кислород в степени окисления -2 являются восстановителями, а азот в степени окисления +5 является окислителем.
S2+Cl2- + N-3H4+Cl -→ S4-2N4+2 + S0 + H+Cl-
S+ + e- → S0 (восстановле́ние)
S+ + 4 e- → S-2 (восстановле́ние)
N-3 - 6e- → N+2 (окисление)
S2Cl2 является окислителем, S2Cl2 является окислителем, NH4Cl является восстановителем.
6S2Cl2 + 4NH4Cl → S4N4 + 8S + 16HCl
5. Электрохимические процессы
Задание 99. Какие химические процессы протекают на электродах при зарядке и разрядки кадмий-никелевого аккумулятора?
РЕШЕНИЕ: При зарядке аккумулятора:
А(+): Ni(OH)2 + OH- → NiOOH + H2O + e-
К(-): Cd(OH)2 + 2e- → Cd + 2OH-
Суммарная реакция: 2Ni(OH)2 + Cd(OH)2 → 2NiOOH + Cd + 2H2O
При разрядке аккумулятора:
К(+): NiOOH + H2O + e- → Ni(OH)2 + OH-
А(-): Cd + 2OH- → Cd(OH)2 + 2e-
Суммарная реакция: 2NiOOH + Cd + 2H2O → 2Ni(OH)2 + Cd(OH)2
5.2 Электролиз
Задание 120. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 8,4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде?
Дано:
КОН
m=8,4г
τ= 1ч 15мин 20с=3600+900+20=4520с
Найти: I
Решение:
Электролиз раствора КОН
КОН ⟶ К+ + OН-
A(+): 2H2O - 4e ⟶ O2 + 4H+
K(-): 2H2O + 2e ⟶ H2 + 2OH-
Суммарный процесс: 2H2O ⟶ 2H2 + O2
По закону Фарадея
m = K•q =(Э•I•τ)/ F I= (m · F)/(Э· τ)=8,4·96500/8·4520=22,4 А
где I – сила тока (А), τ – время прохождения тока (с), K – электрохимический эквивалент; где F – постоянная Фардея (F ≈ 96500 Кл/ моль)
на катоде выделится водород:
V(H2) = (11,2·22,4·4520)/ 96500= 11,75л
Ответ: I=22,4 А, V(H2) = 11,75л
5.3 Коррозия металлов
Задание 121. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение
Лужёное:
Анод: А: Fe - 2e → Fe+2
Катод: K: 2H2O + O2 + 4e → 4OH-
Суммарно: 2Fe + O2 + 2H2O → 2Fe(OH)2
Дальнейшее окисление: 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3
Оцинкованное:
Анод: Zn0 - 2e → Zn2+
Катод: 2H2O + O2 + 4e → 4OH-
Суммарно: 2Zn + 2H2O + O2 → 2Zn(OH)2
6. Химия элементов
6.1s -Элементы (...ns1-2)
144. Как получают металлический натрий? Составьте электронные уравнения процессов, проходящих на электродах при электролизе расплава NaOH.
Решение:
В основном металлический натрий получают с помощью электролиза расплава едкого натра или хлорида натрия.
Электролиз расплава NaOH:
K(-): Na+ + 1e → Na0 процесс восстановление, окислитель
A(+): 4OH- - 4e → 2H2O + O2 процесс окисление, восстановитель
Суммарный процесс: 4NaOH → 4Na + 2H2O + O2
6.2 р-Элементы (...ns2 np1-6)
р-Элементы III группы
Задание 167. Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия: а) с оловом; б) с гидроксидом свинца (II).
Решение: Олово и свинец, как элементы 4 группы, имеют высшую степень окисления равную номеру группы+4, и промежуточную степень окисления +2, образует оксид олова (II) SnO и оксид олова (IV) SnO2, гидроксид олова (II) Sn(OH)2 и гидроксид олова (IV) Sn(OH)4. Свинец образует оксид свинца (II) PbO и оксид свинца (IV) PbO2, гидроксид свинца (II) Pb(OH)2 и гидроксид свинца (IV) Pb(OH)4. при повышении степени окисления олова и свинца кислотные свойства их оксидов и гидроксидов усиливаются, а основные ослабевают, окислительные свойства усиливаются, а восстановительные ослабевают. Для олова наиболее характерна степень окисления +4, а для свинца +2
а) Sn + 2NaOH + 4H2O ⟶ Na2[Sn(OH)6] + 2H2↑
Sn + 2Na+ + 2OH- + 4H2O ⟶ 2Na+ + [Sn(OH)6]2- + 2H2↑
Sn + 2OH- + 4H2O ⟶ [Sn(OH)6]2- + 2H2↑
б) Pb(OH)2 + 2NaOH ⟶ Na2[Pb(OH)4]
Pb(OH)2 + 2Na+ + 2OH- ⟶ 2Na+ + [Pb(OH)4]2-
Pb(OH)2 + 2OH- ⟶ [Pb(OH)4]2-
6.3 d - Элементы (…(n-1)d1-10 ns0-2)
Задание 207. Ванадий получают алюминотермически или кальций термически восстановлением оксида ванадия (V)V2O5. Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Окислительно-восстановительной реакции уравняйте методом электронного баланса.
Решение:

Задание 228. Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия с фтором. Платина окисляется до степени окисления +4, а осмий — до +8.
Решение:
3Pt + 18HCl + 4HNO3 = 4NO + 8H2O + 3H2[PtCl6]
Pt0 - 4e → Pt+4 4 / 3/ процесс окисления, восстановитель
N+5 + 3e → N+2 3 / 4/ процесс восстановление, окислитель
Os + 4F2 = OsF8
Os0 - 8e → Os+8 8 / 1/ процесс окисления, восстановитель
F20 + 2e → 2F- 2 / 4/ процесс восстановление, окислитель
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
Неорганическая химия. В 3-х томах. под ред. Третьякова Ю.Д. // М.: Академия; Т.1-2004, 240с., Т.2-2004, 368с., Т.3-2007, 352с., Т.4-2007, 400с.
Глинка, Н. Л. Общая химия: учебник для бакалавров / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 19-е изд., перераб. и доп. — М. : Издательство Юрайт, 2015. — 900 с. — Серия : Бакалавр. Базовый курс.
Общая химия, Теория и задачи, Коровин Н.В., Кулешов Н.В., 2014.
Большая книга химических элементов, Путеводитель по периодической таблице // Спектор А.А., 2018
Неорганическая химия, Самоучитель // Френкель Е.Н., 2018.
Электронный ресурс. Студопедия. Доступ: studopedia.ru
|
|
|
 Скачать 102 Kb.
Скачать 102 Kb.