задачи по неорганической химии. неорганическая химия задачи (1). Контрольная работа по дисциплине Общая и неорганическая химия
 Скачать 54.84 Kb. Скачать 54.84 Kb.
|
|
ФГБОУ ВО ОрГМУ Минздрава России Кафедра фармацевтической химии Ганеева Ольга Геннадьевна Группа __14-2___ фип Специальность «Фармация 33.05.01.» Контрольная работа по дисциплине «Общая и неорганическая химия» Модуль 1 - 3 Вариант 6 Оренбург - 2021 Задачи и вопросы к контрольной работе №1 по курсу Общей и неорганической химии 1. Решить задачу. Какую массу кристаллогидрата и воды надо взять для приготовления раствора известной массы с указанной массовой долей в расчете на безводную соль?
Дано: mр-р = 0,5 кг ω% = 10% m (CuCl2) = ? m(H2O )= ? Решение: M (CuCl2 * 5H2O)= (63,546+35,453*2)+ 5*18= 134.452+90=224,452 m вещ-ва = (mр-ра*ω):100% m( CuCl2 * 5H2O)=(500г*10%):100%=50г W( CuCl2 )= M (CuCl2 ) :M (CuCl2 * 5H2O)= 134,452:224,452=0,599 m( CuCl2 )= W( CuCl2 )* m( CuCl2 * 5H2O)=0,599*50г=29,95 m(H2O )= m р-ра( CuCl2 * 5H2O) - m( CuCl2 )= 500-29,95=470,05г ОТВЕТ: m( CuCl2 )= 29,95. m(H2O )= 470,05г 2. Решить задачу. Рассчитать массовую долю вещества в растворе с известной молярной концентрацией (С, моль/л) и известной плотностью (ρ, г/мл)
Дано: С – 1,570 моль/л ρ – 1,075 г/мл ____________________ W(H3PO4 )=? Решение: Так как C=n:V тогда пусть V=100 ml,из этого следует 1.1,570=N:100 N= 0,157 моль 2. Так же, если ρ = m*V ,то m=1,075*100=107,5 г 3. m ( H3PO4 )=N*M=0,157* 97,994 г/моль=15,4г 4. W(H3PO4 )=(m р-ра :m вещ-ва )*100%=(107,5:15,4)*100%=14% ОТВЕТ: W(H3PO4 )= 14% 3. Пользуясь основными законами химии, основываясь на знании способов выражения концентрации растворов, решите задачи: о) Какой объем раствора соляной кислоты с массовой долей 14% (ρ = 1,12 г/мл) необходим для приготовления 100 мл раствора с концентрацией 0,15 моль/л? Дано: W=14% P(po)=1,12 г/мл V2=100мл С2=0,15 моль/л Найти: V1=? Решение: Мы имеем два раствора: раствор 1 и раствор 2. Первый раствор соляной кислоты с массовой долей 14% (ρ = 1,12 г/мл). Второй раствор объемом 100 мл с концентрацией 0,15 моль/л. Для определения принадлежности обозначений буду ставить индекс 1 и 2. C2=n:V2 т.е значения с индексом 2 относятся ко второму раствору Из формулы ρ1 = m1:V1 выразим следующую: ρ1 = (n*M):V1 так как m=n*M здесь аналогично. W(HCl )=(m р-ра :m вещ-ва )*100% Применяя вышеуказанные формулы ,получаем данные выражения: M(HCl)=36,458г/моль n=C:10=0,015 моль ρ1= m1 (n*M)*V1 Выразим объем V1 =1,12 :(0,015*36,458)=2,036 л ОТВЕТ: 2,036 л 4. Пользуясь понятием эквивалент и применяя закон эквивалентов, решить следующие задачи: о) На реакцию с 25 мл раствора калия карбоната с молярной концентрацией эквивалента, равной 0,2 моль/л, израсходовано 50 мл раствора соляной кислоты. Рассчитать С(1/z HСl). Дано: V р-ра = 25мл Сэкв=0,2 моль/литр V (Hcl)=50 мл Найти: С(1/z HСl) =? Решение: Молярная концентрация эквивалента (нормальная концентрация)-количество эквивалентов вещества растворенных в 1 литре раствора. Значит, 0,2 моль на литр . 1 эквивалент -1 моль. 1 грамм эквивалент калия карбоната равен 138,205 . 138,205*0,2= 27,641 г на литр Так как дано 25 мл,то 1000: 25=40. 27,641:40=0,69 г на 25 мл Рассчитаем, сколько моль соляной кислоты нам нужно для протекания реакции: n(K2CO3)=0.69:138,205=0,005 моль Значит соляной кислоты 0,01 моль ,так как количество вещества карбоната калия относится к кол-ву вещ-ва соляной кислоты, как 1:2. Масса кислоты будет равна 36,5*0,01=0,365г V=25ml V=50ml CH-0.2 моль/л K2CO3+2HCl=2KCl+H2O+CO2 Пусть 0,365 г – 50 мл Х г - 1000мл Находим х =(0,365*1000):50=7,3г Находим количество вещества соляной кислоты n= 7,3г:36,5г/моль=0,2 моль Следовательно молярная концентрация эквивалента будет равна 0,2 моль/литр. ОТВЕТ: С(1/z HСl)=0,2 моль/литр 5. Пользуясь следствиями из закона Гесса, вычислить изменения энтальпии, энтропии и энергии Гиббса реакции по известным значениям ∆Нообр, Soобр, ∆Gообр (см. табл.1 в приложении) ф) Fe2 O3 (к) + 3CO(г) = 2Fe(к) + 3CO2(г) Решение: 1.Изменение энтальпии: ∆Нообр Fe2 O3 (к) + 3CO(г) = 2Fe(к) + 3CO2(г) Формула для нахождения изменения энтальпии образования: ∆Нообр =∆Нообр продуктов-∆Нообр реагентов ∆Нообр(Fe2 O3)=-741кДж ∆Нообр (CO)=-110кДж ∆Нообр (Fe)=0 кДж ∆Нообр (CO2 )=393кДж ∆Нообр=393-(-741-110)=1244кДж 2.Изменение энтропии Soобр Формула для нахождения изменения энтропии образования: Soобр = Soобрпродуктов- Soобрреагентов Soобр =(Fe2 O3)=146,2 Soобр = (CO)=197,54 Soобр =(CO2 )=213,68 Soобр = 213,68-(197,54+146,2)=-130,06 3.Изменение энергии Гиббса ∆Gообр Формула для нахождения изменения энергии Гиббса: ∆Gообр=∆Gообрпродуктов-∆Gообрреагентов ∆Gообр =(Fe2 O3)=-1014,2 ∆Gообр = (CO)=-137,14 ∆Gообр =(CO2 )=-394,38 ∆Gообр =-394,38-(-137,14-1014,2)=756,96 6. Решить задачу г. Запишите математическое выражение скоростей реакций, протекающих по уравнениям: 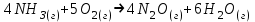 K K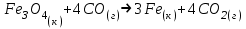 Решение: 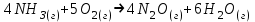 -гомогенная реакция -гомогенная реакцияСкорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. V=KCNH34*CO25 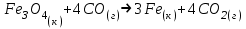 Гетерогенная реакция V=KCFe3O4 * Cco 4 7. Закончить составление молекулярного уравнения окислительно – восстановительной реакции (овр) (т.к. реакции протекают в водных растворах, коэффициенты следует подобрать ионно – электронным методом о)MnO2 + KNO3 + KOH → Решение: 4 Mn +4 O2 + KN +5O3 + 7 KOH → N -3H3 + 4 K2Mn +6O4 + 2 H2O 4 Mn-4 - 8 e- → 4 Mn+6 (окисление)-восстановитель N+5 + 8 e- → N-3 (восстановле́ние)-окислитель 8. Решить задачу о) Осмотическое давление 1% - ного водного раствора (плотность 1 г/см3) сильного электролита АВ3 (Мr =100) при 100оС равно 8,5 ∙105 Па. Определить кажущуюся степень диссоциации АВ3. Дано: π осм = 8,5*105 Па=8,5*102 кПа Mr(AB3) =100 ω(AB3)=1% t=100 оС=373 K ρ=1 г/см3 Найти: ȃ каж = ? Решение: π осм= i CmRT ȃ каж = 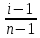 Пусть V р-ра =100мл, тогда m р-ра = V*p=100*1=100г m(AB3)= m р-р* ω= 100*0,01=1 г Cm 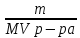 = =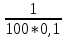 =0,1 моль/л =0,1 моль/лAВ3 → А +3B, следовательно n=4 i= π осм/ CmRT=8,5*102/0,1*8,314*373=2,74 ȃ каж = 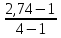 =0,58 =0,58Ответ: ȃ каж = 0,58 9. Написать в молекулярной и ионной формах уравнения реакций (если реакция возможна, если протекание реакции невозможно- пояснить) о) BaCl2 + Na2SO4 → Ca(NO3)2 + Na3PO4 = Решение: BaCl2 + Na2SO4 → BaSO4 ↓ + 2 NaCl Ba 2+ 2Cl- +2 Na + SO4 2- → BaSO4 ↓ + 2 Na + 2Cl – Ba 2+ + SO4 2- → BaSO4 ↓ 3Сa(NO3)2 + 2Na3PO4 = Ca3(PO4)2 ↓ +6 NaNO3 3Ca(+2) + 6NO3(-) + 6Na(+)+ 2PO4(-3) = Ca3(PO4)2 ↓ + 6Na(+) + 6NO3(-) 3Ca(+2) + 2PO4(-3) = Ca3(PO4)2 ↓ 10. Пользуясь понятием растворимость, законом действия масс и уравнением изотермы химической реакции для растворов малорастворимых сильных электролитов, решить задачу о) Концентрация ионов Cl в насыщенном растворе PbCl2 составляет 3,4102 моль/л. Вычислить 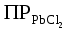 . . Дано: Kw (Cl)=3,4*102 Найти: 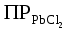 =? =?Решение: Раствор вещества, находящийся при данной температуре в динамическом равновесии с твердым растворяемым веществом (с твердой фазой этого вещества), называется насыщенным. Молярная концентрация вещества в насыщенном растворе называется растворимостью и обозначается s (моль/л). Запишем уравнение процесса диссоциации хлорида свинца: PbCl2↔ Pb2+ + 2Cl- Для получения насыщенного раствора перешло в раствор и продиссоциировало 3,4102 моль/л хлорид иона. 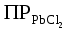 = [Pb2+] *[ Cl- ]2 = [Pb2+] *[ Cl- ]2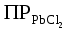 = 1,7102 * 3,4102 =5,78102 = 1,7102 * 3,4102 =5,78102 ОТВЕТ: 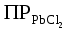 =5,78102 =5,78102 11.Решить задачи о)Вычислить рОН раствора и [ОН] в растворе, если [Н+] 4108 моль/л. Решение: рОН= -lg[OH-] pH+pOH=14 pH=-lg[H+ ]= -lg (4108 )=7,4 рОН=14-7,4=6,6 рОН=-lg[OH-]=6,6=-lg10-6.6 ОТВЕТ: рОН=6,6, [ОН]=- lg10-6.6 12. Выполнить упражнения о) Составьте полные электронные формулы и электронно-структурные диаграммы валентного слоя атомов: P; Ca; Cu. Решение: 15P 1s 22s 22p 63s 23p3
20Ca 1s 22s 22p 63s 23p64s 2 4s2
29Cu 1s 22s 22p 63s 23p64s 13d10 4s1
13. Выполнить упражнения : о) Напишите формулы КС: гидроксид дихлоротетраамминкобальта (III); тетратиоцианатодиаквакадмиат калия. Для анионного КС укажите ц.а.; лиганды, донорные атомы лигандов; координационное число ц.а.; внешнюю и внутреннюю сферы КС. Для катионного КС напишите уравнения первичной и вторичной диссоциации и выражение для общей константы нестойкости Решение: гидроксид дихлоротетраамминкобальта (III ) – [Co(NH3) Cl2 ]OH (катионный) Первичная диссоциация [Co(NH3) Cl2 ] (+) + OH(-) Вторичная диссоциация 1.[Co(NH3) Cl2 ]+ = Co(NH3)Cl+ + Cl- Кр= [Cl-]*[ Co(NH3)Cl+ ] / [[Co(NH3) Cl2 ]+] Кн1=[Cl-]*[ Co(NH3)Cl+ ] / [[Co(NH3) Cl2 ]+] 2.Co(NH3) Cl+ = Co(NH3)2+ + 2Cl- Кр= [Co(NH3)2+]*[2Cl-] / [Co(NH3) Cl+] Кн2= [Co(NH3)2+]*[2Cl-] / [Co(NH3) Cl+] 3. Co(NH3)2+= Со3+ +NH3- Кр= [Со3+ ]*[NH3-]/ [Co(NH3)2+] Кн3=[Со3+ ]*[NH3-]/ [Co(NH3)2+] [Co(NH3) Cl2 ]+=Со3+ +NH3-+2Cl- Кн=[ Со3+ ]*[NH3-]*[2Cl- ]/[ [Co(NH3) Cl2 ]+] тетратиоцианатодиаквакадмиат калия – анионный кс K2[Cd(H2O)2(NCS)4 ] Лиганд-(H2O) Ион внешней сферы- K+ Ион внутренней сферы-[Cd(H2O)2(NCS)4 ]- Координационное число-2 Донорный атом –атом (H2O) |
