вариант 14. Контрольная работа по дисциплине Теория металлургических процессов
 Скачать 59.42 Kb. Скачать 59.42 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования «Сибирский государственный индустриальный университет» КОНТРОЛЬНАЯ РАБОТА по дисциплине «Теория металлургических процессов» Вариант № 14 Выполнил: Агафонов И.А. Группа ЗМ-19 Новокузнецк 2020 ЗАДАНИЕ НА ВЫПОЛНЕНИЕ РАСЧЕТНО-ГРАФИЧЕСКОЙ РАБОТЫ Для заданной системы (№ 14 из таблицы 1) в интервале температур с шагом ее изменения 50 град и при двух различных давлениях рассчитать: Константу равновесия реакции (V). Давление CO. Давление CO2. Давление N2. Стандартное изменение энергии Гиббса реакции (I). Кислородный потенциал газовой фазы. Стандартное изменение энергии Гиббса реакции (II). Изменение энергии Гиббса системы с реакцией (II). Рассчитанные величины внести в таблицу. Сделать заключение о свойстве газовой фазы и поведении в ней металла. Построить график изменения энергии Гиббса системы в зависимости от температуры. Графической (или расчетной) экстраполяцией определить, начиная с какой температуры, металл перестает окисляться. Таблица 1 - Данные к расчету по вариантам
Стандартное изменение энергии Гиббса реакций Таблица 2 - Данные к расчету ∆rG°(T)
РАСЧЕТ Предварительные замечания. Константу равновесия реакции (V) рассчитываем по уравнению стандартного химического сродства (1). Универсальную газовую постоянную принимаем равной 8,314 Дж/моль-1 К-1. С+СО2= 2СО (V)   (1) Gr°(T) = -RTlnK Давление монооксида углерода рассчитываем по равенству (2). 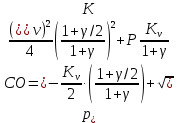 (2) (2)В нашем случае γ = PN2/PО2=62/38=1,632 По заданию система находится при двух давлениях, которые, как было отмечено, должно быть выражено в атмосферах. В рассматриваемом примере они равны 1,0 и 1,382 атм. Давление диоксида углерода определяем по равенству (3): РСО2=Р2СО/ 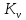 (3) (3)Давление азота определяем по равенству (4): РN2 = Р - РСО - РСО2 (4) Стандартное изменение энергии Гиббса реакции (I) определяем по данным таблицы 2. Кислородный потенциал газовой фазы рассчитываем по равенству (5): 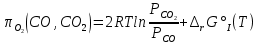 (5) (5)Прежде чем определять стандартное изменение энергии Гиббса реакции варианта 14, ее нужно привести к виду реакции (II): 2Cu + О2 = 2CuО Видно, что количества реагирующих веществ реакции нужно увеличить в 2 раза. Соответственно и величины, определяющие стандартное изменение энергии Гиббса, увеличиваются в 2 раза. Находим стандартное изменение энергии Гиббса преобразованной реакции варианта 14 (2Cu + О2 = 2CuО). Изменение энергии Гиббса системы с реакцией варианта 14 рассчитываем по равенству (6): ∆ rG(T) = - 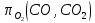 + ∆ G°II(T) (6) + ∆ G°II(T) (6)Все перечисленные расчеты выполняются два раза в указанном температурном интервале при двух давлениях - 1,0 и 1,382 атм. Рассчитанные величины вносятся в таблицу. По результатам расчетов строится график, зависимости изменения энергии Гиббса системы от температуры и давления. Таблица 3 - Расчетные величины при Р = 1 атм.
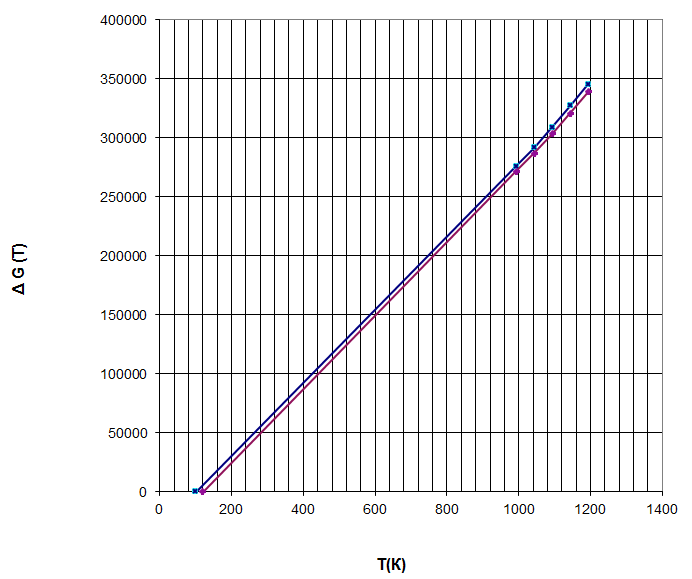 Таблица 4 - Расчетные величины при Р = 1,382 атм.
По данным таблиц 3 и 4 строим график. Рисунок 1 - Зависимость изменения энергии Гиббса системы с реакцией: 2Cu + О2 = 2CuО от температуры и давления (Р=1 атм, Р=1,382 атм) АНАЛИЗ РАСЧЕТНЫХ ВЕЛИЧИН Проведенные расчеты в интервале температур и при двух давлениях показали, что в системе с заданной газовой фазой в присутствии углерода, изменение энергии Гиббса положительно. Следовательно, в системе реакция течет не самопроизвольно. Медь окисляется. Газовая фаза является окислительной. Поведение изменения энергии Гиббса с ростом температуры системы указывает на увеличение окислительных свойств газовой фазы заданного состава. Очевидно, что экстраполяцией полученных линейных зависимостей до пересечения с осью температур можно определить температуру, начиная с которой медь начинает окисляться. Выполнить экстраполяцию можно с помощью линейки. По графику находим температуры для условия ∆rG(T) = 0: Р = 1 атм, Т = 100 К, Р = 1,382 атм, Т = 120 К ВЫВОДЫ 1. Газовая фаза из смеси 62 % N2 и 38 % O2 в присутствии углерода и в интервале температур 720-920°C является окислительной для Сu по реакции 2Cu + O2 = 2CuО. 2. Методом экстраполяции определено, что свойства газовой фазы меняются на окислительные начиная с температуры: с 100 К для системы под давлением 1,0 атм; с 120 К для системы под давлением 1,382 атм. 3. Углетермическим способом в данной газовой фазе Cu можно получать из его оксида CuО при температурах выше 100 К или 120 К соответствующих давлениям 1,0 атм или 1,382 атм. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
