Контрольная работа материаловедение ИРНИТУ. ИРБз-21-1 Кабачий С.А. Контрольная работа. Контрольная работа по Материаловедению
 Скачать 1.36 Mb. Скачать 1.36 Mb.
|
|
Контрольная работа по «Материаловедению» Группа ИРБз-21-1 Выполнил: Кабачий С.А. Вариант 2 Что такое твердый раствор? Опишите виды твердых растворов, приведите примеры. Дайте общую характеристику свойств твердых растворов, используйте закономерности Курнакова. Ответ: В жидком состоянии большинство металлических сплавов, применяемых в технике, представляет собой однородные жидкости, т. е. жидкие растворы. При переходе в твердое состояние во многих таких сплавах однородность сохраняется, следовательно, сохраняется и растворимость. Твердая фаза, образующаяся в результате кристаллизации такого сплава, называется твердым раствором. Химический или спектральный анализ показывает в твердых растворах наличие двух элементов или более, тогда как по данным металлографического анализа такой сплав, как и чистый металл, имеет однородные зерна. Рентгеновский анализ обнаруживает и твердом растворе, как и у чистого металла, только один тип решетки. Следовательно, в отличие от механической смеси твердый раствор является однофазным, состоит из одного вида кристаллов, имеет одну кристаллическую решетку; отличие от химического соединения твердый раствор существует не при строго определенном соотношении компонентов, а в интервале концентраций. Строение твердых растворов на основе одного из компонентов сплава таково, что в решетку основного металла-растворителя входят атомы растворенного вещества. Здесь возможны два принципиально различных случая. 1. Твердые растворы замещения. Металл А, а. Растворение компонента В в металле А происходит путем частичного замещения атомов А атомами В в решетке основного металла 2. Твердые растворы внедрения. Атомы растворенного вещества С располагаются между атомами При образовании растворов внедрения и замещения, - атомы растворенного компонента распределяются в решетке растворителя беспорядочно. а - чистый металл; б - твердый раствор замещения; в - твердый раствор внедрения При образовании твердого раствора сохраняется решетка одного из элементов и этот элемент называется растворителем. Атомы растворенного вещества искажают и изменяют средние размеры элементарной ячейки растворителя. При образовании твердых растворов замещения периоды решетки изменяются в зависимости от разности атомных диаметров растворенного элемента и растворителя. Если атом растворенного элемента больше атома растворителя, то элементарная ячейка решетки увеличивается, если меньше, то сокращается. В первом приближении это изменение пропорционально концентрации растворенного компонента, выраженной в атомных процентах; однако отклонения от линейной зависимости бывают иногда довольно значительными. Изменение параметров решетки при образовании твердых растворов -- весьма важный момент, определяющий изменение свойств. В общем независимо от вида металла относительное упрочнение при образовании твердого раствора пропорционально относительному изменению параметра решетки, причем уменьшение параметра решетки ведет к большему упрочнению, чем ее расширение. При образовании твердых растворов внедрения периоды решетки увеличиваются, так как размеры атомов (вернее, ионов) растворенного элемента больше размеров тех межатомных промежутков, в которых они располагаются, так что атомы решетки растворителя несколько раздвигаются. Твердые растворы замещения могут быть ограниченные и неограниченные. При неограниченной растворимости любое количество атомов А может быть заменено атомами В. Следовательно, если увеличивается концентрация атомов В, то все больше и больше атомов В будет находиться в узлах решетки вместо атомов А до тех пор, пока все атомы А не будут заменены атомами В и, таким образом, как бы плавно совершится переход от металла А к металлу В Это, конечно, возможно при условии, если оба металла имеют одинаковую кристаллическую структуру, т. е. оба компонента являются изоморфными. Следовательно, первым условием образования неограниченного ряда твердых растворов является наличие у обоих компонентов одинаковых кристаллических решеток, т. е. условие изоморфности компонентов. Если у двух металлов с одинаковыми кристаллическими решетками сильно различаются атомные радиусы, то образование твердых растворов между этими металлами сильно искажает кристаллическую решетку, что приводит к накоплению в решетке упругой энергии. Когда это искажение достигает определенной величины, кристаллическая решетка становится неустойчивой и наступает предел растворимости. Итак, вторым условием образования неограниченных твердых растворов является достаточно малое различие атомных размеров компонентов. Наконец, замечено, что неограниченная растворимость наблюдается преимущественно у элементов, близко расположенных друг от друга в периодической таблице Д.И. Менделеева, т. е. близких друг к другу по строению валентной оболочки атомов, по физической природе. Если сплавляемые металлы принадлежат к далеко расположенным друг от друга группам периодической системы и поэтому имеют различную физическую природу, то они часто бывают склонны к образованию химических соединений, а не твердых растворов. Очевидно, что при образовании твердых растворов на базе химического соединения формула химического соединения уже не отвечает действительному соотношению атомов в соединении. Для химического соединения, которое растворяет в себе посторонние атомы, принята такая система обозначения. Например, борид железа (Fe4B2) способен растворить хром и углерод, причем хром заменяет в узлах решетки железо, а углерод- бор. Отношение (Fe+Cr)/(B-}-C)=4/2 сохраняется, и такой раствор на базе химического соединения Fe4B2 обозначается через (Fe, Cr)4(B, С)г. Иногда допускается упрощение обозначений - буквой М обозначаются металлы, а буквой X - неметаллы. Следовательно, твердый раствор на основе борида железа обозначается через М4Х2. Образование твердых растворов на базе химических соединений может сопровождаться не только заменой одних атомов в узлах кристаллической решетки другими, но и тем, что отдельные узлы в решетке оказываются не занятыми атомами («пустыми»). Так, например, соединение СоА1 может кристаллизоваться с избытком кобальта и алюминия по сравнению со стехиометрическим соотношением Со: А1 = 1 :1; в последнем случае избыток алюминиевых атомов получился потому, что не все места в кристаллической решетке, где должны быть атомы кобальта, ими заняты. Получаются в кристаллической решетке «дыры», «пустоты». Твердые растворы на базе химических соединений, образование которых сопровождается появлением пустых мест в узлах решетки, называются растворами вычитания. Если два металла не отвечают перечисленным выше условиям, то они могут ограниченно растворяться друг в друге. Замечено, что растворимость тем меньше, чем больше различие в размерах атомов и в свойствах компонентов, образующих раствор. Ограниченная растворимость в большинстве случаев уменьшается с понижением температуры. Условимся в дальнейшем твердые растворы обозначать символом А (В), где А - растворитель (металл, решетка которого сохранилась в твердом растворе), а В - растворимый элемент. Для неограниченных твердых растворов обозначения - (В) и В (А) однозначны, но для ограниченных твердых растворов раствор А (В) есть раствор В в А, а раствор В (А) - раствор А в В; у первого раствора решетка А, а у второго В, т. е. эти растворы существенно различны. Рассмотрим, при каких условиях образуются твердые растворы внедрения. Так как в твердых растворах этого рода атомы В должны внедряться в решетку А, то очевидно, что диаметр атома В должен быть невелик, а внутри решетки металла А должно иметься достаточное пространство для атома В. Действительно, металлы образуют твердые растворы внедрения с элементами I и II периодов, т. е. с элементами, имеющими малые атомные размеры (Н, N, С, О, В). Диаграмма состояния сплавов, компоненты которых полностью растворимы в жидком и твердом состояниях. Полная взаимная растворимость в твердом состоянии возможна тогда, когда оба компонента имеют одинаковые кристаллические решетки и атомные диаметры компонентов мало отличаются по размерам. Такая диаграмма имеет простой вид и состоит из двух линий-ликвидус и солидус, пересекающихся между собой в точках кристаллизации чистых компонентов А и В. Все сплавы затвердевают в некотором интервале температур (С = 1). Диаграммы такого типа имеют системы Ni-Cu, Ag-Au, Mo-V, Mo-W и др. Рассмотрим затвердевание одного из сплавов этой системы состава хс Жидкий раствор при температуре t1 начинает кристаллизоваться. Можно предполагать, что состав выпадающих кристаллов должен быть того же состава, как жидкость. Однако из жидкого раствора состава хс при температуре t1 начинают выпадать кристаллы, сильно обогащенные более тугоплавким компонентом В. При дальнейшем охлаждении до температуры t2 в равновесии с жидкостью состава ха, обогащенной компонентом А, будут находиться кристаллы твердого раствора состава хь. При медленном охлаждении, а это необходимое условие для получения равновесных состояний, компонент А из жидкости диффундирует в кристаллы состава хе, и они изменяют состав до хь. К концу затвердевания при температуре t3 все кристаллы будут иметь одинаковый состав хс. На диаграмме утолщенными линиями показано, как изменяется состав жидкого и твердого растворов в процессе кристаллизации от температуры t1 до t3. В процессе кристаллизации изменяется не только состав фаз, но и количественное соотношение жидкой и твердой фаз. После окончания кристаллизации должна наблюдаться однофазная структура. Если процесс кристаллизации протекает в условиях ускоренного охлаждения, что обычно имеет место при получении литых деталей и слитков, то диффузионное выравнивание состава у кристаллов, выпавших при температурах выше t3, не успевает происходить, в результате чего получается неодинаковый состав не только у отдельных кристаллов, а в каждом из них. Внутренние участки кристалла будут более богаты тугоплавким компонентом В, а наружные компонентом А. Это явление неоднородности химического состава носит название микроликвации. Первые кристаллы поверхности слитка будут обогащены компонентом В, а последние, образовавшиеся в середине слитка, компонентом А. В результате этого возникает макроликвация в слитке. Ликвация чаще всего играет отрицательную роль и особенно в тех случаях, когда вредные примеси распределяются неравномерно. Повышенное содержание вредных примесей может привести к преждевременному разрушению деталей. Имея диаграмму состояния, можно проследить за фазовыми превращениями любого сплава и указать состав и количественное соотношение фаз при любой температуре. Это осуществляется при помощи двух простых правил. Ранее указывалось, что химический состав выделяющихся кристаллов по мере снижения температуры изменяется по линии солидус от хе до хс В это же время состав жидкой фазы изменяется по линии ликвидус от хс до xf. Это дает основание сформулировать правило определения состава фаз (правило концентраций). Для определения концентрации компонентов в двух фазах через данную точку, характеризующую состояние сплава, проводят горизонтальную линию (коноду) до пересечения с линиями, ограничивающими данную область; проекции точек пересечения (а и b) на горизонтальную ось диаграммы покажут составы фаз (ха и хb). Правило определения количественного соотношения фаз (правило отрезков-правило Курнакова). Через данную точку с проводят горизонтальную линию. Отрезки этой линии (коноды) между точкой с и точками а и b, определяющими составы фаз, обратно пропорциональны количествам этих фаз: Жа/аь = bс/ас. Эти правила справедливы для любой двухфазной области диаграммы состояния и не имеют смысла в однофазной области. Используя эти два правила и привлекая еще дополнительно правило фаз, можно «прочитать» любую сложную диаграмму, состоящую из большого числа ветвей и областей. Вычертите диаграмму состояния «железо–карбид железа», укажите структурные составляющие во всех областях диаграммы, опишите фазовые и структурные превращения в сплаве, содержащем 0,3 % углерода, при охлаждении из жидкого состояния. Постройте кривую охлаждения (с применением правила фаз Гиббса) для этого сплава. Какова структура сплава при комнатной температуре, как сплав называется? По правилу Курнакова определите количественное соотношение фаз в сплаве при температуре 800 °С Ответ: Сплав с содержанием 0,3 % С относится к доэвтектоидным сталям (стали с содержанием до 0,8% углерода). Проводим на диаграмме состояния линию сплава, соответствующую данному процентному содержанию углерода (0,3%) . Точки пересечения с линиями диаграммы обозначаем цифрами. Выше линии ликвидус (температура выше 1510°С, точка 1 на кривой охлаждения) сплав находится в виде расплава (Жидкости). В равновесии находится только одна фаза – Жидкость. В соответствии с правилом фаз Гиббса количество степеней свободы равно С=kf + 1 =21+ 1=2 где k количество компонентов в сплаве, k=2 (Железо и Цементит) fколичество фаз, f=1 (Жидкость) При температуре 1510 °С (точка 1) из Жидкости начинает выделятся кристаллы твердой фазы (Феррит).Схема превращения: ЖФ В интервале температур между точками 1 и 2 в равновесии будет находится две фазы: Жидкость и Феррит. В соответствии с правилом фаз Гиббса количество степеней свободы равно 1 С=kf + 1 =22+ 1=1 где k количество компонентов в сплаве, k=2 (Железо и Цементит) fколичество фаз, f=2 (Жидкость и Феррит) При достижении температуры 1499 °С (точка 2) сплав состоит из высокотемпературного феррита с концентрацией углерода 0,1 % и жидкой фазы с концентрацией углерода 0,5 %. Между этими фазами происходит перитектическая реакция с образованием аустенита состава точки J (0,16 % С). Схема превращения: Ф0,1+Ж0,5А0,16 В соответствии с правилом фаз Гиббса количество степеней свободы при 1499 °С равно 0 С=kf + 1 =23+ 1=0 где k количество компонентов в сплаве, k=2 (Железо и Цементит) fколичество фаз, f=3 (Жидкость, Феррит и Аустенит) При охлаждении в интервале температур от 1499 °С (точка 2) до 1450°С (точка 3) в равновесии будут находится две фазы: Жидкость и Аустенит. В процессе кристаллизации состав жидкой фазы изменяется по линии ликвидус ВС, а Аустенита – по линии солидус IE. Схема превращения: ЖидкостьАустенит В соответствии с правилом фаз Гиббса количество степеней свободы в указанном интервале температур равно. В соответствии с правилом фаз Гиббса количество степеней свободы в указанном интервале температур будет равно С=kf + 1 =22+ 1=1 где k количество компонентов в сплаве, k=2 (Железо и Цементит) fколичество фаз, f=2 (Жидкость и Аустенит) В интервале температур от 1440°С (точка 3) до 790°С (точка 4), сталь имеет однофазную структуру – Аустенит. В соответствии с правилом фаз Гиббса количество степеней свободы в указанном интервале температур равно: С=kf + 1 =21+ 1=2 где k количество компонентов в сплаве, k=2 (Железо и Цементит) fколичество фаз, f=1 (Аустенит) Начало вторичной кристаллизации происходит на линии GS (точка 4, температура 790°С). Из Аустенита выделяется Феррит. Схема превращения: АустенитФеррит При температуре 727°С (линия PSK на диаграмме) происходит эвтектоидное превращение. При этом, Аустенит с содержанием углерода 0,8% распадается на эвтектоидную смесь Феррита и Цементита. При эвтектоидном превращении на кривой охлаждения наблюдается горизонтальный участок 5-5`. Схема эвтектоидного превращения: А0,8П(Ф0,02 + Fe3C) При 727°С количество степеней свободы равно: С=kf + 1 =23+ 1=0 где k количество компонентов в сплаве, k=2 (Железо и Цементит) fколичество фаз, f=3 (Аустенит, Цементит, Феррит) При охлаждении ниже 727°С из Феррита, в следствии уменьшения растворимости углерода, выделяется Цементит третичный. В структуре сплава Цементит третичный не проявляется. Схема превращения: ФFe3CIII Ниже 727°С (точка 5) количество степеней свободы равно: С=kf + 1 =22+ 1=1 где k количество компонентов в сплаве, k=2 (Железо и Цементит) fколичество фаз, f=2 (Цементит, Феррит) 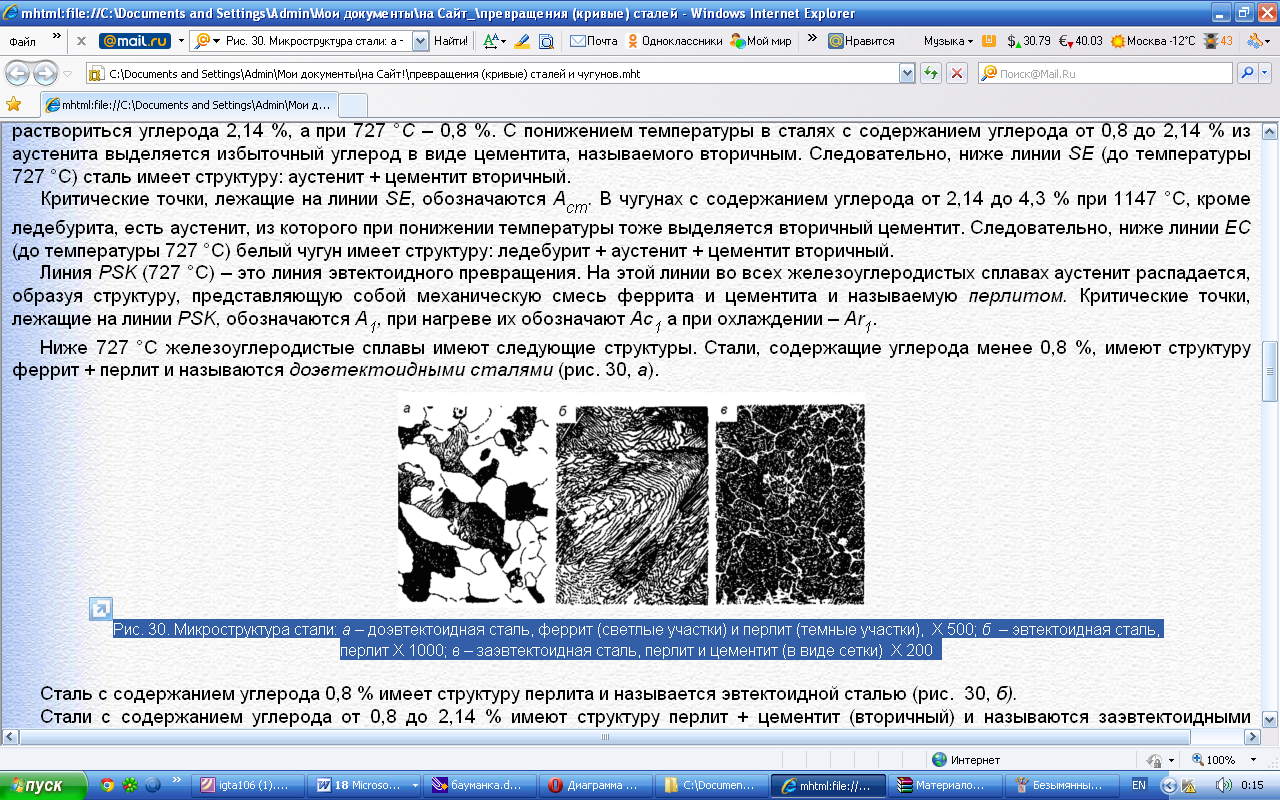 Рис. Микроструктура доэвтектоидной стали феррит (светлые участки) и перлит (темные участки), X500; 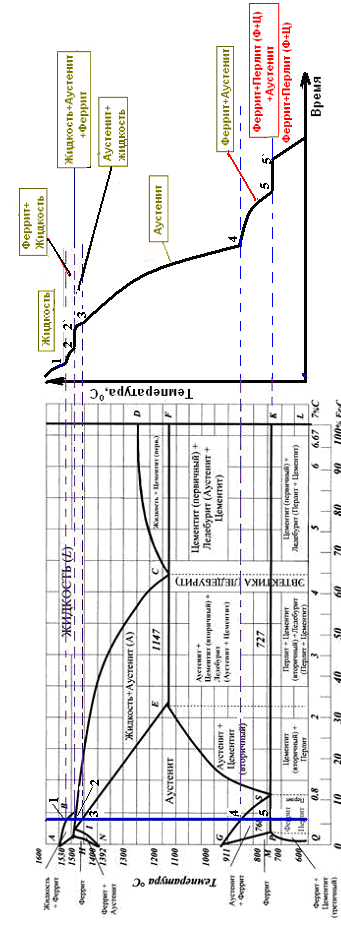 Пользуясь правилом отрезков, определим количественное соотношение фазовых составляющих при 800 °С. Обозначим точкой b сплав при температуре 800ºС. Для определения количественного соотношения фазовых составляющих с точки b проводим горизонтальные участки (коноды) до пересечения с соответствующими линиями диаграммы (точки а и с). 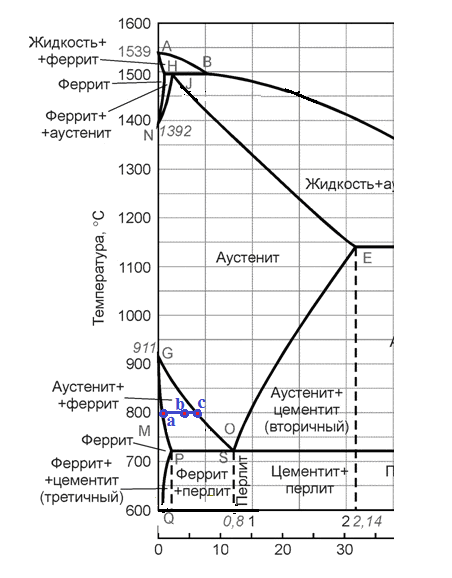 В соответствии с правилом отрезков, соотношение структурных составляющих обратно пропорционально длинам соответствующих конод. Так как длины конод пропорциональны концентрации Углерода, то длина отрезка bc равна разнице содержания Углерода в точке с (0,4%) и b (0,01%). Аналогично, длина отрезка ac равна разнице содержания Углерода в точкe с и a.  Q(Аустенита)= Q(Аустенита)=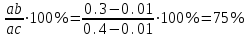  Q(Феррита)= Q(Феррита)= 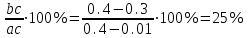 Изделия из углеродистой стали 60 после правильно выполненной закалки и последующего отпуска имеют твердость более низкую, чем предусмотрено техническими условиями. Чем вызван этот дефект, и как можно его исправить? Используйте при ответе диаграмму состояния «железо–карбид железа», опишите превращения структуры и изменение свойств стали. Ответ: Сталь 60 – качественная конструкционная углеродистая сталь. Содержание углерода в стали составляет 0,6% (первая цифра в марке указывает на содержание углерода в сотых долях процента). Сталь 60 по содержанию углерода относится к доэвтектоидным сталям (содержание углерода менее 0,8%). Исходная структура стали - перлит + феррит. Критические точки стали: Ас1=725 0С, Ас3=750 оС. Доэвтектоидные стали подвергают полной закалке, при этом ее нагревают до образования однородной аустенитной структуры (проводят закалку с температуры Тзак = Ас3 + 70ºС = 820 ºС). 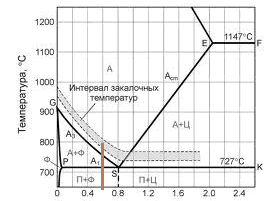 Рис. 2– Выбор температуры закалки по диаграмме «Железо-Fe3C» Последующее охлаждение в масле или воде со скоростью большей, чем критическая (Vкр - наименьшая скорость охлаждения, при которой аустенит превращается в мартенсит), обеспечивает получение мелкозернистого мартенсита. Также после закалки в структуре стали присутствует незначительное количество остаточного аустенита. Полученный мартенсит представляет собой пересыщенный твердый раствор углерода в  железе и имеет тетрагональную кристаллическую решетку. Образование в результате закалки мартенсита приводит к большим остаточным напряжениям, повышение твердости, прочности, однако при этом возрастает склонность к хрупкому разрушению, что требует проведения дополнительно отпуска непосредственно сразу после закалки. железе и имеет тетрагональную кристаллическую решетку. Образование в результате закалки мартенсита приводит к большим остаточным напряжениям, повышение твердости, прочности, однако при этом возрастает склонность к хрупкому разрушению, что требует проведения дополнительно отпуска непосредственно сразу после закалки.Недостаточная твердость закаленной стали может быть вызвана недогревом (низкая температура закалки, слишком короткая выдержка при правильной температуре печи) или при недостаточно интенсивном охлаждении, т.е. со скоростью меньше критической. Однако в задание указано, что закалка выполнена правильно. В результате закалки получен мартенсит (или мартенсит + цементит для заэвтектоидной стали). Поэтому твердость более низкая, чем предусмотрено техническими условиями, есть результат проведения отпуска при температурах выше необходимых. 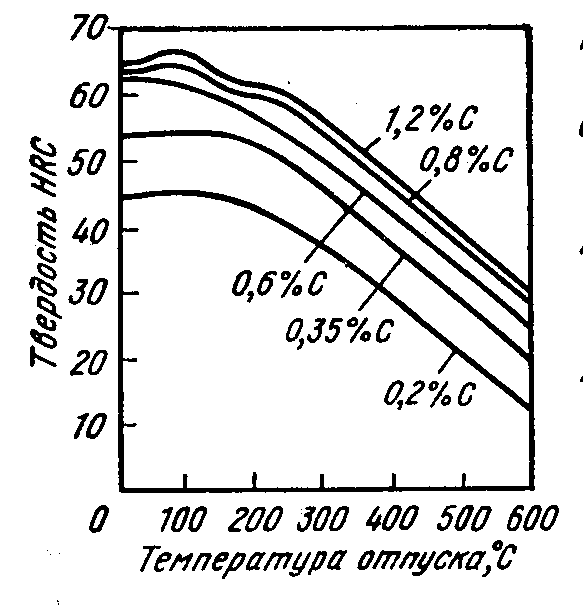 Рис.4– Зависимость твердости углеродистых сталей разного состава от температуры отпуска При нагреве при отпуске происходит выделение углерода из мартенсита, приводящее к уменьшению искажений решетки α-железа. Такой мартенсит называют отпущенным. При температурах порядка 300-400°Сзавершается выделение углерода и образуется высокодисперсная ферритно-цементитная смесь, называемая трооститом отпуска. При дальнейшем нагреве происходит коагуляция кристаллов карбидов и уменьшается дисперсность структуры. Структуру углеродистой стали образующуюся при температурах отпуска 500-650°С, называют сорбитом отпуска. При более высоких температурах нагрева образуется перлит отпуска. С увеличением температуры отпуска общий уровень напряжений уменьшается, что выражается снижением твердости. Для изготовления матриц холодной штамповки выбрана сталь Х12Ф1. Расшифруйте марку стали, приведите примерный химический состав данной стали, определите группу стали. Назначьте и обоснуйте режимы термообработки. Опишите сущность происходящих при термообработке превращений, микроструктуру и главные свойства матриц после термообработки. Ответ: Х12Ф1 - сталь штамповая ГОСТ 5950-2000 применяется для изготовления профилированных роликов сложных форм, секций кузовных штампов, накатных плашек, матриц, пуансонов вырубных просечных штампов и т. д. Таблица 1 - Химический состав стали Х12Ф1, % ГОСТ 5950-2000
Отжиг производится при 850-870°С получается твердость НВ 207-255 и структура - сорбитообразный перлит с карбидами. На твердость и количество остаточного аустенита большое влияние оказывает температура закалки. Как видно из кривых, приведенных для стали Х12Ф1, твердость с повышением температуры закалки сначала повышается, достигая максимума при 1050- 1075° С, а затем понижается. После закалки в масле (или на воздухе) получается структура мартенсита с карбидами и остаточным аустенитом. Чем выше температура закалки, тем больше сохраняется в стали остаточного аустенита. Это объясняется тем, что с повышением температуры закалки увеличивается растворимость в аустените карбидов хрома и аустенит получается более легированным, более устойчивым. Понижение твердости стали после закалки от температур выше 1075° С связано с наличием в стали большого количества остаточного аустенита, имеющего невысокую твердость. Учитывая влияние температуры закалки на твердость и количество остаточного аустенита, высокохромистые стали (и, в частности, сталь Х12Ф1) термически обрабатывают по двум режимам: 1. Обработка на первичную твердость. 2. Обработка на вторичную твердость. После термической обработки высокохромистых сталей в них сохраняется значительное количество остаточного аустенита. Удельный вес аустенита и мартенсита различен, поэтому изменением соотношений количества аустенита и количества мартенсита можно регулировать размеры обрабатываемых изделии. Такой метод обработки, особенно целесообразный для изделий, которые окончательно механически обрабатываются перед термической обработкой, называется бездеформационной закалкой, закалкой в размер, тепловой доводкой. Бездеформационная закалка наиболее широко применяется при обработке штампов. Температура нагревания штампов выбирается такой, чтобы при закалке размер штампа получился несколько меньше исходного размера. Например, штампы из стали Х12Ф1 закаливают от 1125-1140° С с получением минусовых размеров. Охлаждение производится в масле или в соляной ванне с температурой 400-450° С, т. е. в области наиболее устойчивого аустенита, с последующим охлаждением на воздухе. Охлажденные штампы проверяют на соответствие заданным размерам и, так как размеры уменьшены, производят отпуск при 500--520° С, в результате которого за счет распада остаточного аустенита размеры штампа увеличиваются (см. фиг. 150). Если увеличение размеров после первого отпуска недостаточно, то отпуск повторяют и доводят размеры до заданных. Х12Ф1 от температуры закалки При обработке на первичную твердость сталь Х12Ф1 закаливают (обычно в масле) от температуры 1070-1090° С до твердости НRC 61-63. Для сохранения высокой твердости отпуск закаленной стали производится при 150-170° С. Размер инструмента при обработке по такому режиму почти не изменяется. При обработке на вторичную твердость сталь Х12Ф1 нагревают до 1140-1160° С и охлаждают в масле или в расплавленной голи при 400-450° С, получая пониженную твердость HRC 48-54. Распад остаточного аустенита и повышение твердости до НRC 60-62 происходят при многократном отпуске (3-4 раза при 510-520° С) или обработке холодом (до --78° С) и однократном отпуске (при 510-520° С). После обработки на вторичную твердость сталь обладает красностойкостью и повышенным сопротивлением износу, но более низкими механическими свойствами по сравнению со сталью, закаленной на первичную твердость. Кроме того, при обработке на вторичную твердость возникают большие объемные изменения. После этого для улучшения механических свойств производится отпуск пои 150-75° С. Если размер штампа после закалки получился больше исходного (после закалки от более низких температур), то производится отпуск при 300-400° С, в результате которого размер штампа уменьшается в связи с распадом мартенсита (уменьшением степе-пи его тетрагональности). Если закалка произведена в размер, то в этом случае производится низкотемпературный отпуск при 150-170° С для снятия внутренних напряжений. Для изготовления деталей методом глубокой вытяжки применяют латунь Л68. Укажите состав. Используя диаграмму медь-цинк, определите структуру сплава. Назначьте режим термообработки, применяемый между отдельными операциями вытяжки, обоснуйте его выбор. Приведите общие характеристики механических свойств сплава. Ответ: Л68–Латунь, обрабатываемая давлением. В марке сплава буква «Л» обозначает Латунь, цифра после буквы указывает на содержание меди в %. Химический состав Л68 в % (ГОСТ 15527 – 2004) Механические свойства отожженной латуни Л68 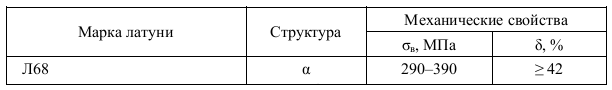 По содержанию цинка сплав относится к гомогенному типу латуни (имеет однородную α структуру). Латуни со структурой α - фазы пластичны, имеют высокую технологичность и легко поддаются горячей и холодной обработке давлением. Холодная деформация латуни приводит к существенному повышению прочности латуни при одновременном очень резком снижении пластичности. 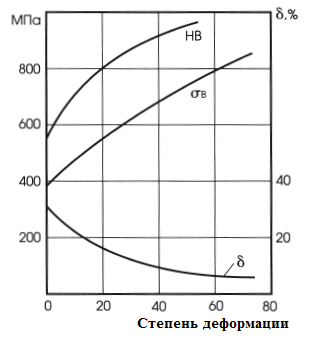 Рис.5–Влияние степени холодной пластической деформации на твердость (НВ), прочность (σв) и пластичность (δ,%) латуни Л68. Холодная пластическая деформация вызывает изменение структуры металла и его свойств. Сдвиговая деформация вызывает увеличение плотности дефектов кристаллической решетки, таких как вакансии, дислокации. Образование ячеистой структуры происходит с изменением формы зерен, они вытягиваются в направлении главной деформации. Все эти процессы ведут к тому, что прочность металла постепенно увеличивается, пластичность падает, т.е. возникает наклеп или нагартовка. Дальнейшая деформация такого металла невозможна, т.к. происходит его разрушение. Для снятия эффекта упрочнения применяют рекристаллизационный отжиг, т.е. нагрев металла до температур выше начала кристаллизации, выдержку с последующим медленным охлаждением. Температура нагрева зависит от состава сплава. Для сплавов температура начала рекристаллизации составляет порядка 0,6*Тпл. Продолжительность такого отжига зависит от размеров детали и в среднем составляет от 0,5 до 2 часов. 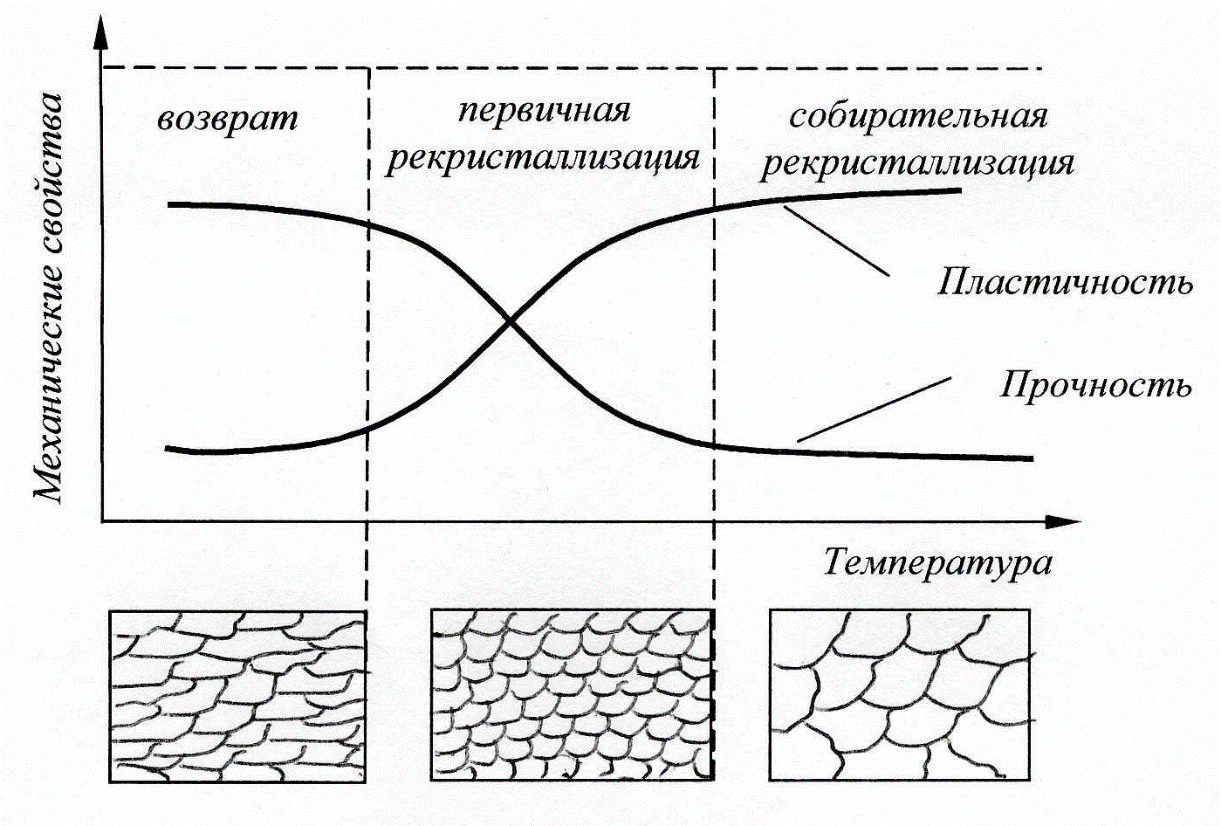 Рис.6 –Изменение свойств латуни в процессе рекристаллизационного отжига Отжиг в качестве промежуточной операции применяют при холодной деформации или между горячей и холодной деформациями Механические свойства при Т=20oС материала Л68
|
