Контрольная работа по микробиологии. Контрольная работа по микробиологии студентки 3 курса спбгавм коротаевой Любови Анатольевны СанктПетербург 2006
 Скачать 248 Kb. Скачать 248 Kb.
|
|
Министерство сельского хозяйства РФ Санкт-Петербургская государственная академия ветеринарной медицины Ветеринарный факультет заочной формы обучения Шифр - 20534 Контрольная работа по микробиологии студентки 3 курса СПбГАВМ Коротаевой Любови Анатольевны Санкт-Петербург 2006 Содержание ПОНЯТИЕ ОБ АНТИТЕЛАХ. ФИЗИКО-ХИМИЧЕСКИЕ, АНТИГЕННЫЕ, ФУНКЦИОНАЛЬНЫЕ РАЗЛИЧИЯ ИММУНОГЛОБУЛИНОВ Антителами называются специфические белки, которые образуются клетками лимфоидных органов позвоночных при введении антигенов и обладающие способностью вступать с ними в специфическую связь. Антитела появляются в сыворотках животных и людей после перенесения явной или скрытой инфекционной болезни. Формирование антител происходит не только в результате перенесения инфекции, но и вследствие иммунизации живыми (ослабленными), убитыми бактериями, риккетсиями, вирусами, токсинами, анатоксинами и другими антигенными веществами. Природа антител В настоящее время установлено, что антитела представляют собой иммуноглобулины сыворотки крови человека или животных. Иммуноглобулины также встречаются в сыворотках людей и животных, не перенесших инфекционных заболеваний и не подвергавшихся иммунизации. Полагают, что они образуются под влиянием нормальной микрофлоры в процессе развития организма. У молодых ядовитых змей некоторых видов нет нормальных иммуноглобулинов и вследствие этого они чувствительны к собственному яду; у взрослых змей имеются нормальные иммуноглобулины, которые нейтрализуют их собственный яд. Иммуноглобулины к одному и тому же антигену, продуцирующиеся в крови разных видов животных, так же как и соответствующие нормальные глобулины, неодинаковы по своему химическому составу. Методом фракционирования установлено, что иммуноглобулины (антитела) содержатся в разных глобулиновых фракциях (рис. 48). Изучены классы и подклассы иммуноглобулинов, их строение, размеры молекул, активные центры. 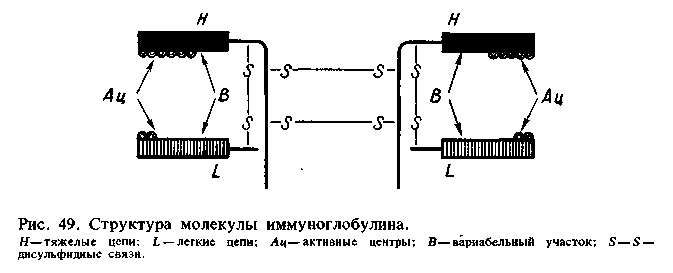 1 Молекула иммуноглобулина состоит из двух неидентичных полипептидных цепей: одна пара тяжелых—Н (англ, heavy) и одна пара легких—L (англ, light) (рис.1). L- и Н-цепи соединяются дисульфидными связями. Большинство молекул антител состоят из димеров (LH)2, меньшая часть — из< полимеров (LH)2n- При воздействии на антитела папаином они распадаются на фрагменты: Fab-фрагмент — одновалентный, активно соединяющийся с антигеном, Fc-фрагмент, который не взаимодействует с антигеном и состоит из С-концевых половин тяжелых цепей; Fd-фрагмент — участок тяжелой цепи, входящий в Fab-фрагмент. Около 80% антител бивалентны, другие моновалентны (неполные, или «блокирующие», антитела). Активные центры (Fab-фрагменты) антител представляют собой полости, образуемые легкими и тяжелыми цепями, по размеру и форме соответствующие гомологичной антигенной детерминанте. Большинство иммуноглобулинов обладает двумя активными центрами. Специфичность активных центров определяется последовательностью аминокислот в концевых участках тяжелых и легких цепей. Вторая часть молекулы иммуноглобулина (Fc-фрагмент) осуществляет фиксацию комплемента на комплексе антиген — антитело. Каждой группе иммуноглобулинов присуща определенная структура активных центров и вариабельных участков. Выяснены генетические механизмы, обусловливающие разнообразие как молекул белка, так и иммуноглобулинов определенных классов. Обнаружены варианты иммуноглобулинов, или алотипы. Строение иммуноглобулинов контролируется двумя группами генов, локализованных в разных локусах: одна группа генов контролирует синтез тяжелых цепей, другая — легких. Один ген детерминирует строение вариабельного участка, другой — стабильного участка активного центра молекулы иммуноглобулина. Иммуноглобулины представляют собой гетерогенную группу белков. По своим физико-химическим свойствам иммуноглобулины подразделяют на пять классов: IgM, IgG, IgA, IgE, IgD. Основные свойства иммуноглобулинов представлены в таблице. I 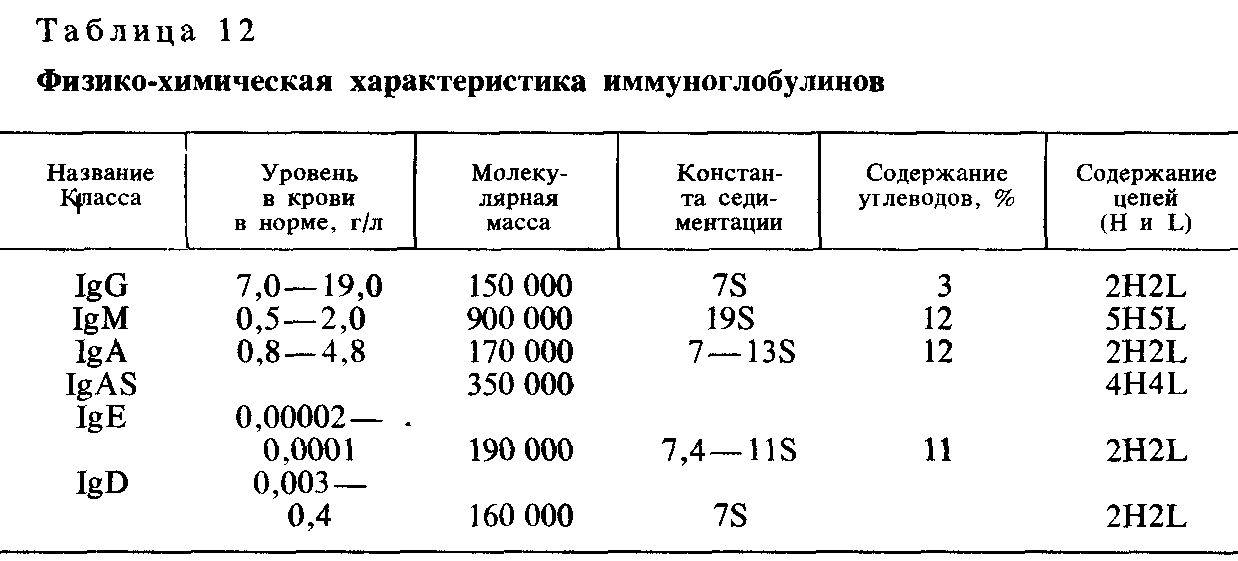 gG — классические антитела; они составляют основную массу (около 80%) иммуноглобулинов, легко проходящих через плаценту. Они наиболее активно связывают растворимые антигены бактерий, экзотоксины, вирусы. gG — классические антитела; они составляют основную массу (около 80%) иммуноглобулинов, легко проходящих через плаценту. Они наиболее активно связывают растворимые антигены бактерий, экзотоксины, вирусы.IgM первыми появляются после иммунизации или антигенной стимуляции, оказывают действие на грамотрицательные бактерии, проникшие в кровь, активизируют фагоцитоз. Они во много раз активнее IgG, так как содержат около 10 активных центров. IgA подразделяется на два вида: IgA — сывороточный и IgAS — секреторный, которые отличаются друг от друга по физико-химическим свойствам, месту синтеза и выполняемой функции. Секреторный IgA вырабатывается лимфоидными клетками слизистых оболочек дыхательных путей, полости рта, кишечника, мочевыводящих путей, содержатся в молозиве, слюне, слезах, слизи кишечника, поте. Он отличается от IgA сывороточного секреторным компонентом и выполняет защитную функцию при кишечных и респираторных инфекциях, обезвреживая бактерии, вирусы; обладает выраженной бактерицидностью, опсонизирующим эффектом. Сывороточные IgA обезвреживают микробы и их токсины, проникшие в кровь, однако по силе действия они слабее, чем IgAS. IgE — реагины, кожно-сенсибилизирующие антитела; они не проходят через плаценту и обладают способностью фиксироваться на различных органах и тканях, играют важную роль в развитии аллергических реакций немедленного типа (бронхиальная астма, аллергический ринит, атоническая экзема и др.). IgD — их функция до конца не выяснена. Считают, что они обусловливают ряд аутоаллергических поражений при заболеваниях щитовидной железы. Они не фиксируют комплемента, не проходят через плаценту, их содержание увеличивается при некоторых заболеваниях кожи. Антитела являются термолабильными веществами (блокирующие антитела термостабильны). Они денатурируются при нагревании до 70°С в течение 1 ч. На активность антител оказывает влияние рН среды, а также и другие факторы, под действием которых происходят глубокие нарушения белковых веществ. Установлено, что антитела не денатурируются от осаждения их этиловым спиртом при низкой температуре (от 0° до 4°С), но денатурируются спиртом при высокой температуре. Нейтральные соли (сульфаты магния, аммония, натрия) вызывают осаждение белков, но не денатурируют антитела. Поэтому этиловый спирт при низкой температуре, сульфаты магния, натрия и аммония используются для фракционирования иммунных сывороток и получения антител в очищенном виде. В продукции иммуноглобулинов большое значение имеет наследственная обусловленность силы иммунного ответа. У организмов разных генотипов один и тот же антиген вызывает различной силы иммунный ответ—от нуля до очень высокого уровня. Один и тот же -организм с определенным генотипом по-разному реагирует на антигены. Признак силы иммунного ответа наследуется как доминантный, не сцепленный с полом. В образовании антител также определенную роль играют структурные гены, от которых зависит возникновение активных центров антител, обладающих специфичностью и являющихся составной частью иммуноглобулина. Ареактивность тканей, присущая родительской линии, является доминантным признаком. Динамика выработки антител, их накопления и исчезновения имеет определенные характеристики; при этом различают первичный и вторичный иммунный ответ. Первичный иммунный ответ характеризуется появлением антител спустя 1—4 дня после антигенного раздражения (индуктивная фаза); затем наступает продуктивная фаза — период логарифмического возрастания антител, заканчивающийся периодом максимума (5—15-е сутки), когда их количество в крови достигает наибольшего уровня. Спустя 1—3 мес и позже концентрация их в крови уменьшается (период снижения). В случае повторной иммунизации спустя 2—4 нед и даже несколько месяцев и лет организм может ответить усиленной выработкой иммуноглобулинов на гомологичный и даже гетеро-логичный антигены. Эта реакция получила название вторичного иммунного ответа; она базируется на иммунологической памяти. Иммунологическая память. В иммунизированном организме, а также в организме, перенесшем инфекционное заболевание, но затем утратившем способность сохранять антитела, под влиянием специфических и неспецифических раздражителей в сыворотке крови повышается титр иммуноглобулинов. Клетки памяти — часть долгоживущих В-лимфоцитов, которые переходят в покоящееся состояние после 2—3 делений и выполняют функцию анамнестической реакции. На нуклеиновых матрицах клеток, обладающих иммунологической памятью, синтезируются структурные белки, отличающиеся антидетерминантами по отношению к детерминантам антигенов. Память в виде иммунологической информации о предшествующем стимуле обеспечивает способность отвечать более усиленной продукцией на ревакцинацию. Исходя из изученных иммунологических закономерностей, в практике иммунизации людей против инфекционных заболеваний и гипериммунизации крупных животных для получения лечебных сывороток в настоящее время широко применяют метод ревакцинации—повторных введений антигенов, обеспечивающий повышение иммунологической активности. Иммунологическая толерантность Иммунологическая толерантность (лат. tolerantia— терпение) — отсутствие иммунного ответа организма на определенный антиген. Иммунологическая толерантность возникает в том случае, когда организм в эмбриональном периоде контактировал с данным антигеном. Антигены, вызывающие иммунологическую толерантность, получили название толерогенов; ими чаще всего могут быть сывороточные белки (альбумины или глобулины). Толерантный организм принимает за «свое» чужеродный материал и не отвечает на него иммунными реакциями. Иммунологическая толерантность может быть воспроизведена эмбриональным парабиозом, пересадкой ткани и инъекцией толерогенов эмбриону. В возникновении толерантности принимают участие Т- и В-системы лимфоцитов. Под влиянием Т-супрессоров происходит блокирование В-клеток, продуцирующих антитела. Необходимым условием для поддержания толерантности является персистенция антигена в организме. Иммунологическая толерантность может быть утрачена в результате исчезновения антигена, находящегося в организме, а также при введении иммунной сыворотки против антигенов, которыми была индуцирована толерантность. К срыву толерантности приводит также введение перекрестно реагирующих антигенов. ХАРАКТЕРИСТИКА ВОЗБУДИТЕЛЕЙ МИКОПЛАЗМОЗОВ РОГАТОГО СКОТА Микоплазмы. Группа объединяет микроорганизмы, лишенные неточной стенки. Они выделены в отдельный класс Mollicutes, который содержит два семейства—Mycoplasmataceae и Acholeplasmataceae. Семейство dycoplasmataceae состоит из видов, широко распространенных в природе почва, сточные воды, каменный уголь и др.). Некоторые микоплазмы шляются возбудителями заболеваний у человека. Семейство Acholeplasmataceae не содержит патогенных для человека видов, но объединяет свободноживущие микоплазмы, а также паразиты некоторых млекопитающих и птиц. Во введении к 8-му изданию «Определителя» сказано, что в дальнейшем высшие таксоны будут перегруппированы, это даст возможность составить более точную классификацию бактерий. Микоплазмы принадлежат к классу Mollicutes, порядку Муcoplasmatales, семейству Mycoplasmataceae. Это мелкие бактерии размером 100—150 нм, иногда 200—700 нм, не образующие спор, неподвижные, грамотрицательные. Впервые на них обратил внимание Л. Пастер при изучении возбудителя плевропневмонии крупного рогатого скота, однако не мог в то время выделить его в чистой культуре на обычных питательных средах и обнаружить в световом микроскопе. В 1898 г. Э. Нокар и Э. Ру установили, что возбудитель плевропневмонии может развиваться на сложных питательных средах, не содержащих клеток культур ткани, а У. Эльфорд определил путем применения специальных фильтров размеры этого микроба. Микоплазмы обнаружены в почве, сточных водах, на различных субстратах, в организме животных и человека. Имеются патогенные и непатогенные виды. К патогенным для человека микоплазмам отнесена Mycoplasma pneumoniae, к условно-патогенным — М. hominis и Т-группа микоплазм. Морфология Клетки весьма полиморфны (шаровидные, кольцевидные, коккобациллярные, нитевидные, ветвистые, в виде элементарных телец). В поздней фазе роста образуются цепочки кокковидных телец. Микоплазмы не имеют клеточной стенки, покрыты трехслойной цитоплазматической мембраной толщиной 7,5—10 нм; в цитоплазме содержатся ДНК и РНК, рибосомы и другие клеточные компоненты. Микоплазмы грамотрицательны, окрашиваются медленно. Содержание Г+Ц в ДНК нуклеоида 23—40%. Культивирование Большинство видов — факультативные анаэробы. Для их роста необходимы белки, стеролы, фосфолипиды, муцины, а также пуриновые и пиримидиновые основания. На плотных средах растут в виде характерных колоний с уплотненным, врастающим в среду центром и нежным ажурным краем; через 3 — 5 дней инкубации они иногда становятся крупными (1,5—2 мкм), но чаще трудно различимы невооруженным глазом. На кровяном агаре вокруг колоний наблюдается зона гемолиза. В бульоне микоплазмы развиваются с образованием помутнения и мелкозернистого осадка. Выращивают микоплазмы при температуре 36—37°С (крайние границы роста 22—41°С), на средах с рН 7,0, содержащих сыворотку. Т-группа (от англ, tiny) микоплазм развивается при рН 6,0—7,0 с образованием очень мелких колоний. Добавление к питательной среде холестерола или других стеролов, экстрактов дрожжей ускоряет рост микоплазм. Они могут культивироваться в средах, не содержащих сыворотки, но в присутствии 0,02% гемоглобина и 0,01% цистеина. Микоплазмы хорошо размножаются в хорионаллантоисе куриного зародыша. Ферментативные свойства Процессы метаболизма у микоплазм весьма вариабельны. Протеолитическими свойствами не обладают, хотя и описано несколько видов, разжижающих желатин и свертывающих сыворотку; большая часть штаммов ферментирует глюкозу, некоторые из них образуют аргиназу, фосфатазу. Антигенная структура Микоплазмы обладают видовой и типовой специфичностью. В семейство микоплазм входит 36 видов, из них наибольшее медицинское значение имеют М. pneumoniae, M. hominis, Т-группа. Микоплазмы дифференцируют с помощью реакций ингибиции антисыворотками. Токсинообраювание Из микоплазм извлечены гемолизин и термостабильный эндотоксин. Резистентность Большинство штаммов погибает при температуре 45—55°С в течение 15 мин. Микоплазмы очень чувствительны ко всем дезинфицирующим веществам, к высушиванию, ультразвуку и другим физическим воздействиям, устойчивы к пенициллину, ампициллину, метициллину, чувствительны к эритромицину и другим макролидам. Патогенность для животных Микоплазмы вызывают плевропневмонию у крупного рогатого скота (М. mycoides); некоторые варианты этой бактерии являются возбудителями плевропневмонии у коз. Микоплазмы обнаруживали при воспалительных процессах у овец, коз, свиней, грызунов, птиц. М. hominis вариант 1 непатогеген для мышей, вариант 2 при подкожном заражении вызывает у них локализованные абсцессы. Патогенез заболевания Патогенные микоплазмы поражают органы дыхания, сердечно-сосудистую, мочеполовую и центральную нервную системы. M. pneumoniae, выделенную в 1944 г. М. Итоном из мокроты больных людей, в течение 18 лет на основании фильтруемости ошибочно относили к вирусам. Она вызывает острые респираторные заболевания (риниты, бронхиты, бронхиолиты, иногда круп) и очаговые (атипичные) пневмонии. Поражаются главным образом дети в возрасте 3 — 7 лет. Заболевания, вызываемые микоплазмами, характеризуются затяжным течением и сопровождаются осложнениями (воспаление среднего уха, эмфизема легких и др.). Среди изолированных или полуизолированных групп животных наблюдаются эпидемические вспышки. М. hominis встречается при плевропневмонии, воспалительных процессах гениталий, неспецифических уретритах, простатитах, негонококковых артритах, трихомонадоподобных поражениях, эндокардитах, септических и других заболеваниях. Вероятно, эта микоплазма очень широко распространена среди животных и людей, но ее выявление представляет большие трудности; она обладает условной патогенностью и вызывает заболевания у человека при резком снижении его общей резистентности. Т-группа микоплазм наиболее часто выделяется от больных при негонококковых уретритах и у животных, контактировавших с больными. Иммунитет После плевропневмонии у крупного рогатого скота, овец, коз остается стойкий и продолжительный иммунитет. Вероятно, он связан с общей резистентностью организма человека, а также с выработкой ингибиторов роста микоплазм, агглютининов, преципитинов, комплементсвязывающих антител. Лабораторная диагностика Выделение микоплазм проводится обычно в остром периоде болезни путем высева мокроты, отделяемого слизистой оболочки носоглотки, зева, уретры на специальные питательные среды. Идентификация выросших культур осуществляется изучением культуральных свойств, ферментативной и гемолитической активности, определением видовой принадлежности с помощью специфических антисывороток в реакциях ингибиции роста, реакции связывания комплемента и др. Используются серологические методы исследования (реакция связывания комплемента, реакция непрямой гемагглютинации) с парными сыворотками больных, взятыми с интервалом 3—4 нед., которые позволяют поставить диагноз ретроспективно. Разработан метод экспресс-диагностики, проводимой с помощью специфических меченых флюоресцирующих антисывороток. |
