контрольная химия. Контрольная работа по предмету Химия Студент 2 курса, группа зир(9)21 Сорокин. А. В. Подпись
 Скачать 89 Kb. Скачать 89 Kb.
|
|
Дмитровский рыбохозяйственный технологический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего образования «Астраханский государственный технический университет» (ДРТИ ФГБОУ ВО «АГТУ») Факультет среднего профессионального образования Контрольная работа по предмету: Химия Студент 2 курса, группа ЗИР(9)-21 __________ Сорокин.А.В. Подпись ф. и. о. "___" ____________ 2021 г. Рыбное 2021 Гравиметрический анализ. Техника работы Гравиметрический (весовой) анализ - метод количественного химического анализа, основанный на определении массы искомого компонента анализируемого образца путем измерения (точного взвешивания) массы устойчивого конечного вещества известного состава, в которое полностью переведен данный определяемый компонент. 1. Взвешивание навески: ведут на аналитических и технохимических весах с точностью соответственно до 4 или 2 знаков после запятой. 2. Растворение навески: навеску растворяют в дистиллированной воде, при медленном растворении содержимое стакана нагревают на водяной бане. 3. Осаждение определяемого вещества: прежде чем приступить к процессу осаждения, подбирают реагент-осадитель. При этом учитывают константу растворимости осадка, значение которой должно находиться в пределах 1·10-8 - 1·10 -12. Желательно, чтобы осадитель осаждал только определяемый ион. В качестве осадителя часто используют соединения аммония (гидроксид, карбонат и др.), которые после промывки осадка легко удаляются при прокаливании. Для полного осаждения осадителя обычно добавляют в 1,5 раза больше, чем необходимо по уравнению реакции. Большее добавление количества осадителя может вызвать растворение осадка. Следует различать условия осаждения кристаллических и аморфных осадков. В случае образования кристаллических осадков их осаждение проводят из сильно разбавленных растворов разбавленным раствором осадителя, который прибавляют по каплям в начале осаждения. Осаждение ведут из горячих растворов, и для образования крупных кристаллов раствор медленно охлаждается до комнатной температуры. Осаждение аморфных осадков также ведут из горячих растворов, но при быстром добавлении концентрированного раствора осадителя. Для укрупнения коллоидных частиц добавляют электролиты, и фильтрование осадка проводят сразу из горячих растворов. Необходимо проверять полноту осаждения, добавив после образования осадка по стенке стакана 1 – 2 капли раствора осадителя. Отсутствие помутнения в месте падения капель указывает на полноту осаждения. 4. Отделение осадка (фильтрование) и его промывание: проводят через стеклянные или бумажные беззольные фильтры. Стеклянные фильтры применяют для фильтрования крупнокристаллических, а бумажные - мелкокристаллических осадков. Беззольные бумажные фильтры при сжигании дают малое количество золы (0,0001 г), при расчете ею пренебрегают. 2. Методика приготовления рабочего титрованного раствора щелочи. Сначала готовят приблизительно 0,1 н раствор щелочи, затем стандартный раствор установочного вещества, например щавелевой кислоты, и, наконец, устанавливают титр раствора щелочи по щавелевой кислоте. Гидроксид натрия NaOH, 30—40%-ный. Соляная кислота НС1, 0,1 н раствор. Щавелевая кислота Н2С20^2Н20. Индикатор фенолфталеин, 0,1%-ный раствор в 90%-ном этаноле. Описание определения А) Приготовление 250 мл приблизительно 0,1 н раствора NaOH из более концентрированного Твердый NaOH не отвечает требованиям к исходным веществам, из него нельзя приготовить стандартный раствор по точной навеске. Поэтому целесообразно готовить приблизительно 0,1 н раствор щелочи из более концентрированного, заранее приготовленного для этой работы. Допустим, что приготовленный раствор NaOH имеет плотность, измеренную ареометром, р = 1,390 г/мл, по таблицам определяют, что он содержит 36% гидроксида натрия. Объем этого раствора, необходимый для приготовления 250 мл 0,1 н NaOH, можно рассчитать по формуле Отмеряют нужный объем концентрированного раствора NaOH с помощью градуированной пробирки, разбавляют кипяченой дистиллированной водой до 250 мл и тщательно перемешивают. Б) Приготовление 100 мл стандартного 0,1 н раствора щавелевой кислоты Расчет навески щавелевой кислоты проводят следующим образом: 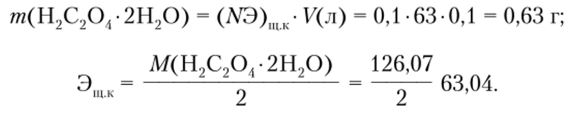 После взвешивания на аналитических весах навески 0,63 г щавелевой кислоты ее растворяют в мерной колбе на 100 мл и тщательно перемешивают (используют кипяченную дистиллированную воду). Рассчитывают титр и нормальную концентрацию приготовленного раствора щавелевой кислоты по формулам В) Установка нормальной концентрации раствора NaOH по щавелевой кислоте Тщательно вымытую бюретку ополаскивают рабочим раствором NaOH, заполняют им «носик» и, убрав воронку, устанавливают мениск жидкости на нулевом делении. Ополоснув пипетку стандартным раствором щавелевой кислоты, переносят 10,00 мл ее в коническую колбу, прибавляют каплю фенолфталеина и титруют раствором щелочи до появления бледно-малиновой окраски, не исчезающей при взбалтывании в течение одной минуты (при продолжительном стоянии окраска индикатора исчезает из-за поглощения раствором С02). Из трех результатов титрования по среднему результату вычисляют нормальную концентрацию раствора щелочи: где У, и N, — объем (мл) и нормальная концентрация раствора щавелевой кислоты, a и N2 — раствора NaOH. 3. Расставьте коэффициенты в уравнении окислительно-восстановительной реак-ции, составив электронный баланс. Укажите окислитель и восстановитель, определите их эквиваленты: KMnO4+NH3→KNO3+MnO2+KOH+H2O 8 KMnO4 (aq) + 3 NH3 (aq) → 8 MnO2 (s) + 3 KNO3 (aq) + 5 KOH (aq) + 2 H2O (l) 8 MnVII + 24 e- → 8 MnIV (восстановле́ние) 3 N-III - 24 e- → 3 NV (окисление)KMnO4 является окислителем, NH3 является восстановителем. 4. Различите вещества: NaOH, K2CO3, BaCl2. Реактивы: HCl, Na2SO4, фенолфтале-ин. Составьте уравнения соответствующих реакций в молекулярном, полном и сокращен-ном ионном виде. 2NaOH + H2SO4 = Na2SO4 + 2H2O 2Na(+) + 2OH(-) + 2H(+) + SO4(-2) = 2Na(+) + SO4(-2) + 2H2O OH(-) + H(+) = H2O HCL + NaOH = NaCl + H2O H(+) + CL(-) + Na(+) + OH(-) = Na(+) + CL(-) + H2O H(+) + OH(-) = H2O. K2co3+2hcl=2kcl+co2+h2o 2k (+) + co3 (2-) + 2h (+) + 2cl (-) = 2k (+) + 2cl (-) + co2+h2o 2h (+) + co3 (2-) = co2+h2o BaCl₂ + H₂SO₄ = BaSO₄↓ + 2HCl Ba²⁺ + 2Cl⁻ + 2H⁺ + SO₄²⁻ = BaSO₄↓ + 2H⁺ + 2Cl⁻ Ba²⁺ + SO₄²⁻ = BaSO₄↓ 5.Сколько миллилитров 25%-ного раствора аммиака (плотность 0,907 г/см3) потре-буется для приготовления 2 л 0,1 н раствора? N   H3+H2O NH4OH H3+H2O NH4OHѠ=25% P=0.907г/см3 V=2л, 0,1 Н р-ра 0.1*2=0.2моль 0,2*17=34г 34/0,25=136г 136/0,907=149,94 мл |
