Гидролиз солей. Произведение растворимости. Гидролизом называют разложение соединений под действием воды. Гидролиз происходит в присутствии воды и является обратимой р-цией. Ионы, полученные при растворении какой-либо соли, взаимодействуют с ионами Н+ и ОН-, всегда имеющимися в воде. В результате могут возникать молекулы кислот или оснований. Гидролиз солей является р-цией обратимой, зависящей от концентрации соли в воде и от температуры. Повышение температуры и уменьшение концентрации соли увеличивают полноту гидролиза. Гидролиз – процесс эндотермический. Полнота гидролиза выражается в изменении соотношения ионов Н+ и ОН-. Накопление недиссоциированных молекул в результате смещения равновесия может привести к насыщению раствора и выпадению осадка. Чем меньше величина произведения растворимости, тем труднее данная соль растворима в воде. ПР=[А]a[B]b, а и b – коэффициенты при ионах в реакции диссоциации.
|
Влияние факторов на коррозию. Количественная оценка коррозионных процессов. Скорость химической коррозии металла зависит от скорости собственно химической р-ции и скорости диффузии окислителя через пленку. Скорость любого вида коррозии измеряется в единицах массы потерянного металла с единицы площади в единицу времени: ω=Δm/St или ω=ρδ/t, где δ - толщина слоя потерянного металла. Для определения скорости коррозии используют методы массовые, объемные и физические. Массовые методы затруднены процессом удаления продуктов коррозии. Объемный метод основан на измерении объема поглощенного кислорода или выделенного водорода. Применим для электрохимической деполяризации. Физические методы применяются для оптического измерения пленок, образовавшихся на пов-сти металла, а для электрохимической коррозии – в измерении величины коррозионного тока или плотности тока: ω=k(ε0K-ε0A)/(pK+pA+R), где ε0K-ε0A – разность нормальных потенциалов катода и анода, pK – катодная поляризация, pA – анодная поляризация, R - омическое сопротивление. Коррозионные среды с малым окислительным потенциалом особенно опасны и резко снижают эксплуатационные св-ва металлических конструкций. На скорость электрохимической коррозии оказывают влияние различные факторы и их многочисленные сочетания, приводящие к изменению условий поляризации электродов. Состав электролита определяет электропроводность и активную концентрацию ионов, участвующих в процессе. Ускоряют коррозионные процессы во всех случаях и для всех металлов ионы Н+, Сl-, Br-, I-, изменяя потенциал растворения металлов. Для амфотерных металлов такую же роль играют ионы ОН-. Соотношение ионов Н+ и ОН- или рН среды сильно влияет на скорость коррозионных процессов. Присутствие в электролите ионов или полярных молекул, которые могут выступать как лиганды при комплексообразовании и растворять пассивирующие пленки (Cl-, CN-, NH3), значительно ускоряет коррозионные процессы. Температура влияет на электрохимическую коррозию весьма сильно. Если процесс идет с поглощением кислорода, то зависимость скорости коррозии от температуры неоднозначна, т.к. при повышении температуры растворимость кислорода в воде резко снижается. Если коррозионный процесс не зависимо от атмосферного кислорода, то скорость такого процесса монотонно возрастает с температурой.
Коррозия с водородной и кислородной деполяризацией. Процесс взаимодействия металлов с электролитной средой может происходить или с водородной, или кислородной деполяризацией в зависимости от рН среды. Водородная деполяризация рН<7 2Н++2ОН-→2Н2О; Fe2++2OH-→Fe(OH)2. Кислородная деполяризация pH≥7 O2+2H2O+4ē→4OH- (в среду выходит Fe2+)
Электрохимические методы защиты от коррозии основаны на электролизе. Металлические защитные слои в этом случае осаждаются на пов-сти изделия, которое в электролизе представляет собой катод и находится под отрицательным потенциалом. Покрытие должно иметь мелкокристаллическую структуру и быть сплошным – без пор и трещин. Для получения мелкозернистой структуры в состав электролита вводят поверхностно-активные в-ва и органические добавки, препятствующие росту отдельных кристаллических зерен (декстрин, ализариновое масло ит.д.). При выборе покрытий следует учитывать относительную активность основного металла и металла покрытия. Гальваностегия – нанесение металлических покрытий. Катодные процессы, идущие с выделением водорода, используются для обезжиривания в слабо кислых или щелочных р-рах, травления. Анодные процессы: травление металла до нужной толщины, электрополирование, анодное оксидирование пов-сти изделия для защиты от коррозии и для декоративных целей.
Фазовое равновесие. Правило фаз Гиббса. Выбор параметров, влияющих на равновесие данной гетерогенной сис-мы, и условия равновесия определяются правилом фаз Гиббса – Коновалова: число степеней свободы в гетерогенной сис-ме равно числу компонентов плюс два и минус число фаз. С=К+2-Ф, где С - число степеней свободы, К – число компонентов, Ф – число фаз. Число компонентов К – это число различных видов молекул, необходимое и достаточное для построения данной сис-мы. Числом фаз Ф определяется строение сис-мы. Фазы в гетерогенной сис-ме могут представлять собой чистые в-ва или иметь переменный состав – р-ры ли газовые смеси. Число степеней свободы – число параметров равновесия, которые в определенных пределах могут принимать произвольные значения без изменения числа фаз в сис-ме или без изменения её строения.
Типы связей (π, σ-связи). В зависимости от этих способов перекрывания различают π и σ-типы связей. σ-связь образуется вдоль линии, соединяющей центры атомов. π-связь образуется по обе стороны о линии, соединяющей центры атомов. Таким образом, в молекуле N2 имеется 1 σ-связь и 2 π-связи. Следует отметить, что в первую очередь образуется всегда σ-связь. Она является более прочной. Каждая последующая π-связь будет слабее предыдущей.
|
Свойства растворов неэлектролитов. Закон Рауля. Осмотические явления. I закон Рауля: понижение давления насыщенного пара над р-ром по сравнению с чистым растворителем прямо пропорционально числу молей растворенного в-ва и обратно пропорционально числу молей растворителя. р0-р=Δр; 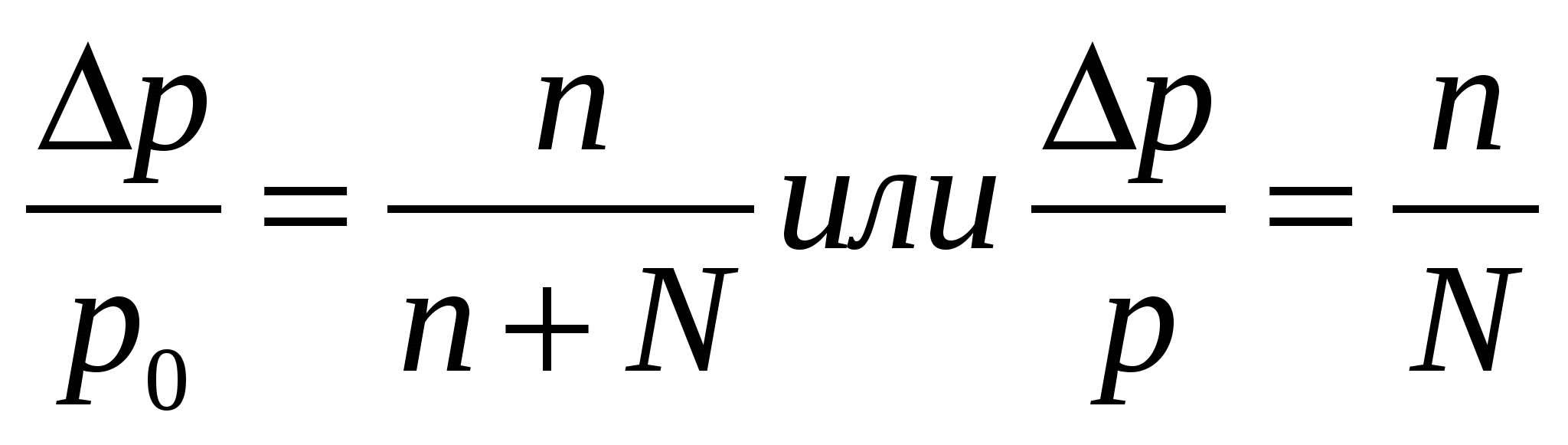 где р0 – давление пара над чистым растворителем, р – давление пара над р-ром, n – число молей растворенного в-ва, N – число молей растворителя. II закон Рауля: повышение температуры кипения р-ра по сравнению с чистым растворителем прямо пропорционально моляльной концентрации. ΔTкип=T-T0, где р0 – давление пара над чистым растворителем, р – давление пара над р-ром, n – число молей растворенного в-ва, N – число молей растворителя. II закон Рауля: повышение температуры кипения р-ра по сравнению с чистым растворителем прямо пропорционально моляльной концентрации. ΔTкип=T-T0, 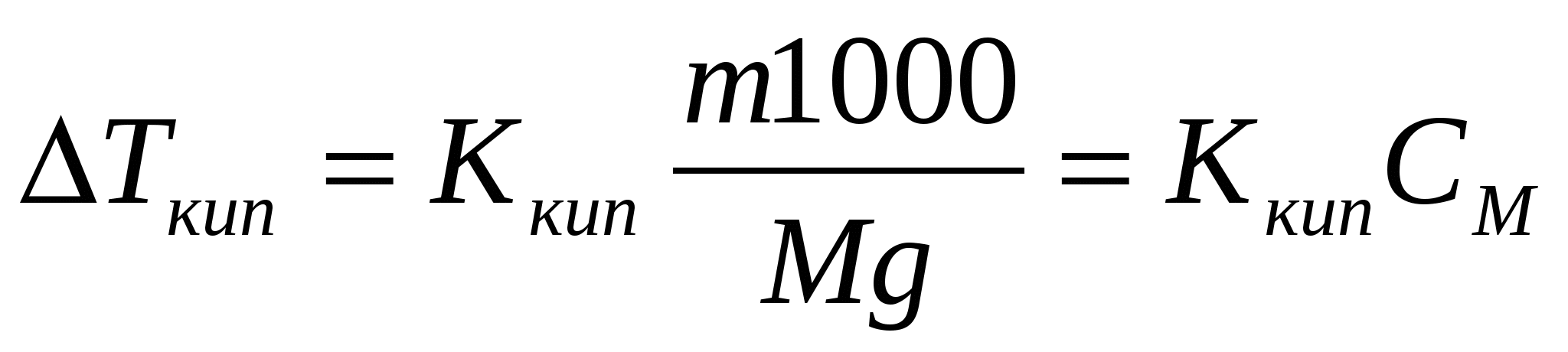 где Т – температура кипения р-ра, Т0 – температура кипения растворителя, Ккип – эбуллиоскопическая константа, m – масса растворенного в-ва, M – его молекулярная масса, g – масса растворителя. Если моляльная концентрация равна единице (1 моль на 1 кг растворителя), то повышение температуры равно эбуллиоскопической константе, которую также называют молекулярное повышение температуры кипения. При аналитическом выводе закона Рауля получаем: где Т – температура кипения р-ра, Т0 – температура кипения растворителя, Ккип – эбуллиоскопическая константа, m – масса растворенного в-ва, M – его молекулярная масса, g – масса растворителя. Если моляльная концентрация равна единице (1 моль на 1 кг растворителя), то повышение температуры равно эбуллиоскопической константе, которую также называют молекулярное повышение температуры кипения. При аналитическом выводе закона Рауля получаем: 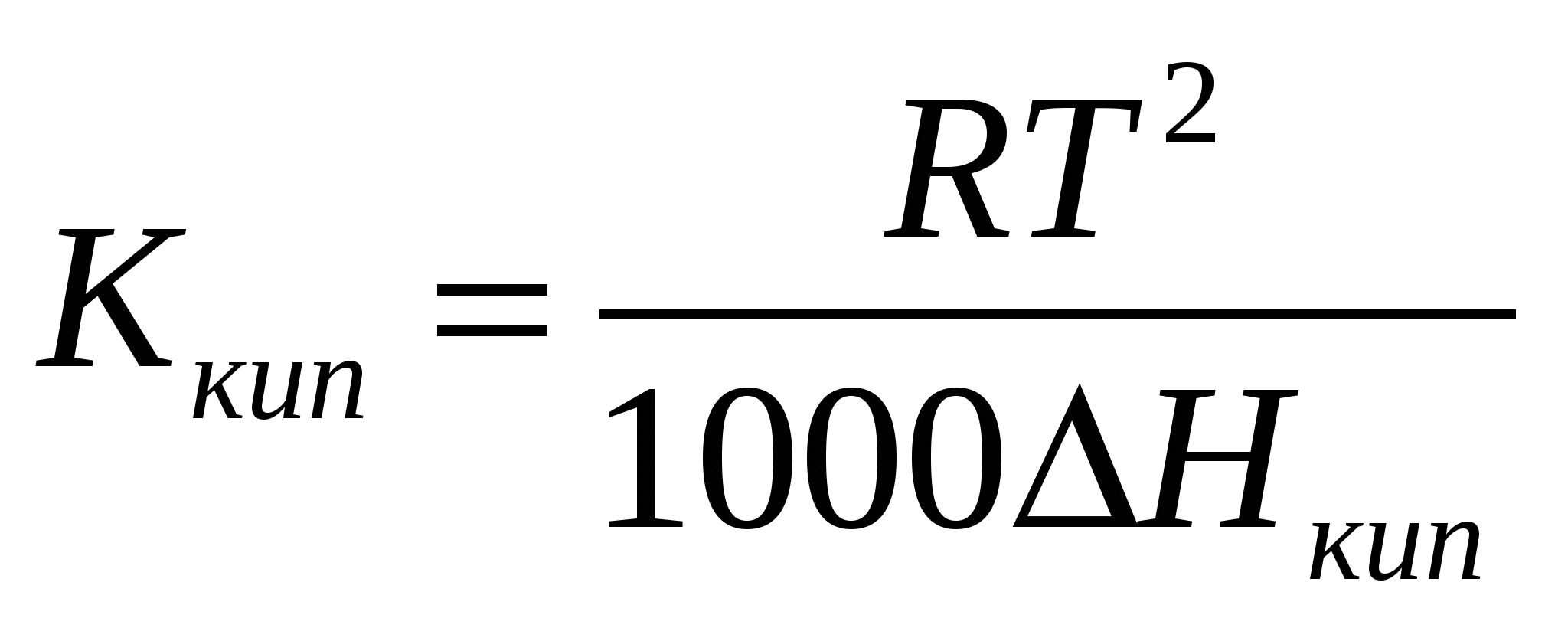 , где Т – температура кипения чистого растворителя, R – газовая постоянная, Дж/моль∙град, ΔHкип – удельная скрытая теплота испарения, Дж/г, 1000 – масса растворителя, г. III закон Рауля: понижение температуры затвердевания р-ра по сравнению с чистым растворителем прямо пропорционально моляльной концентрации: ΔTкрист=T0-Т, , где Т – температура кипения чистого растворителя, R – газовая постоянная, Дж/моль∙град, ΔHкип – удельная скрытая теплота испарения, Дж/г, 1000 – масса растворителя, г. III закон Рауля: понижение температуры затвердевания р-ра по сравнению с чистым растворителем прямо пропорционально моляльной концентрации: ΔTкрист=T0-Т, 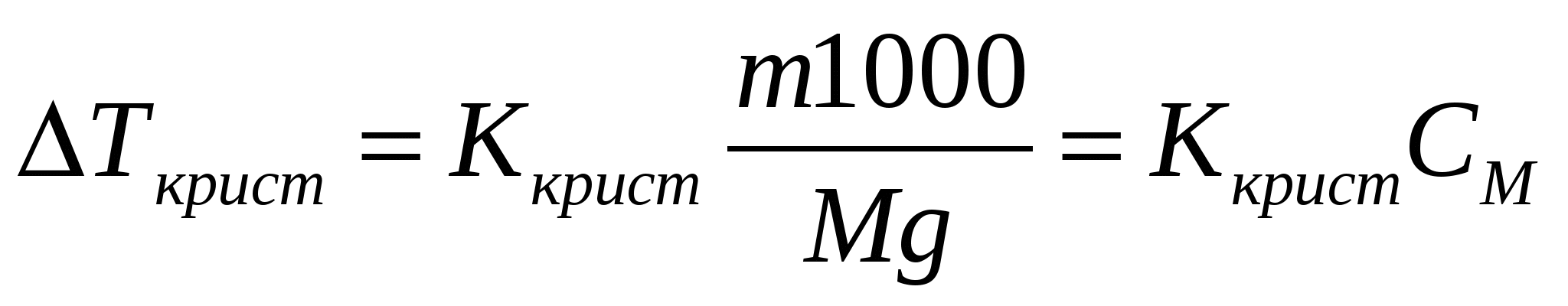 , где Т0 – температура кристаллизации растворителя, Т – температура кристаллизации растворителя из р-ра данной концентрации, Ккрист – криоскопическая константа. Законы Рауля можно использовать для определения молекулярных масс растворенных в-в. Для этого дифференциальным терометром определяют разность температур, и, зная массы растворителя и растворенного в-ва, вычисляют молекулярную массу по ур-ю: , где Т0 – температура кристаллизации растворителя, Т – температура кристаллизации растворителя из р-ра данной концентрации, Ккрист – криоскопическая константа. Законы Рауля можно использовать для определения молекулярных масс растворенных в-в. Для этого дифференциальным терометром определяют разность температур, и, зная массы растворителя и растворенного в-ва, вычисляют молекулярную массу по ур-ю: 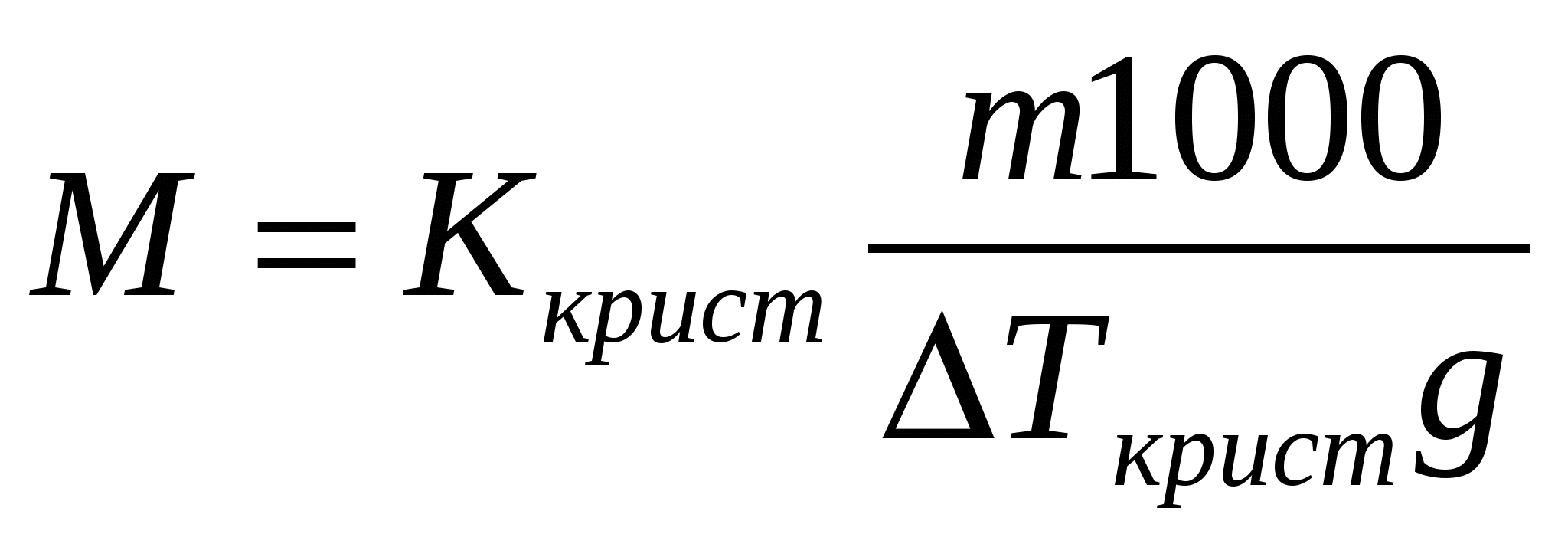 Если молекулярная масса уменьшается, то это означает процесс диссоциации молекул в воде. По величине изменения молекулярной массы можно вычислить приближенную степень электролитической диссоциации. Законы Рауля также применяют при подборе депрессанта к припоям в металлических сис-мах – сплавах – для понижения их температуры плавления. Осмос - односторонняя диффузия, возникающая в р-рах при наличии полупроницаемой перегородки, которая может пропускать через себя только молекулы растворителя. В результате в р-р, помещенный в сосуд с полупроницаемыми стенками, проникает растворитель, разбавляя его и увеличивая при этом его объем. Если в пробку такого сосуда вставить трубку, то жидкость в ней будет подниматься за счет увеличения объема р-ра до тех пор, пока гидростатическое давление не уравновесит осмотическое давление в р-ре. Вант-Гофф, предполагая поведение растворенного в-ва в р-ре аналогичным его поведению в газообразном состоянии, предложил для расчета осмотического давления ур-е Менделеева-Клапейрона в следующем виде: π=CRT, где π – осмотическое давление, С – молярная концентрация, R – газовая постоянная, Т – абсолютная температура. Р-ры, обладающие одинаковыми осмотическими давлениями, называются изотоническими. Если молекулярная масса уменьшается, то это означает процесс диссоциации молекул в воде. По величине изменения молекулярной массы можно вычислить приближенную степень электролитической диссоциации. Законы Рауля также применяют при подборе депрессанта к припоям в металлических сис-мах – сплавах – для понижения их температуры плавления. Осмос - односторонняя диффузия, возникающая в р-рах при наличии полупроницаемой перегородки, которая может пропускать через себя только молекулы растворителя. В результате в р-р, помещенный в сосуд с полупроницаемыми стенками, проникает растворитель, разбавляя его и увеличивая при этом его объем. Если в пробку такого сосуда вставить трубку, то жидкость в ней будет подниматься за счет увеличения объема р-ра до тех пор, пока гидростатическое давление не уравновесит осмотическое давление в р-ре. Вант-Гофф, предполагая поведение растворенного в-ва в р-ре аналогичным его поведению в газообразном состоянии, предложил для расчета осмотического давления ур-е Менделеева-Клапейрона в следующем виде: π=CRT, где π – осмотическое давление, С – молярная концентрация, R – газовая постоянная, Т – абсолютная температура. Р-ры, обладающие одинаковыми осмотическими давлениями, называются изотоническими.
Закон Фарадея. Выход веществ по току. I закон Фарадея: масса в-ва, выделившегося на электродах пропорциональна кол-ву пропущенного электрического тока. M=kQ=kIt=AIt/nF. II закон Фарадея: при пропускании одинакового кол-ва электричества на электродах выделяется эквивалентное кол-во в-в. Коэффициент выхода по току η показывает отношение кол-ва фактически выделившего в-ва к теоретически возможному.
|
Свойства растворов электролитов. Степень диссоциации. Сильные и слабые электролиты. Активная концентрация. Закон разбавления Оствальда. Электролитом называется сис-ма, содержащая положительно и отрицательно заряженные ионы, существующие независимо от внешних электрических или магнитных полей. Образование электролитов может происходить различными путями: диссоциацией растворенных полярных молекул под действием полярных молекул растворителя, растворением ионных кристаллов с образованием гидратированных ионов, плавлением кристаллов. Степенью диссоциации называется отношение числа распавшихся на ионы молекул к числу молекул растворяемого в-ва. Электролитическая диссоциация увеличивает число частиц в р-ре, причем это увеличение зависит от строения растворенных молекул и от степени диссоциации. Диссоциация молекул на ионы оказывает влияние и на осмотической давление, т.к. увеличивает число частиц в р-ре. Увеличение числа частиц вызывает увеличение осмотического давления. Степень диссоциации увеличивается с повышением температуры. Сильным электролитом называют р-р, в котром степень диссоциации или средний коэффициент активности превышает 0,5 при нормальной концентрации и комнатной температуре р-ра.
|
Коррозия металлов. Классификация коррозионных процессов. Самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с окружающей средой, происходящий с выделением энергии и рассеиванием в-ва (рост энтропии), называется коррозией. Коррозионные процессы протекают самопроизвольно и необратимо в соответствии со вторым началом термодинамики. Изменение пов-сти металла в результате коррозионных процессов может быть различным в зависимости от св-в металла и условий протекания коррозионных процессов. На их развитии очень сильно влияет механическая напряженность металла. Виды коррозии: равномерная, местная, питтинг, селективная, интеркристаллитная, транскристаллитная. По природе гетерогенных процессов взаимодействия окружающей среды с металлами коррозионные процессы можно разделить на 2 основных типа: химическая и электрохимическая, идущая под действием внутренних микро- и макрогальванических пар или внешней разности потенциалов..
|
Электролитическая диссоциация воды. рН - водородный показатель. В 1887 г. Шведский ученый Сванте Аррениус предложил теорию электролитической диссоциации в р-рах взамен прежних представлений, согласно которым в-ва в р-ре распадаются на ионы под действием электрического тока. Электролитическая диссоциация не зависит от разности потенциалов, создающей электрический ток, что подтверждается своеобразным течением химических р-ций в электролите между отдельными ионами вне зависимости от того, из каких в-в эти ионы получены. Полярные молекулы воды могут диссоциировать, проявляя при этом свою амфотерность: Н2О↔Н++ОН- или 2Н2О↔Н3О++ОН-. Вторая ступень диссоциации ещё никем не наблюдалась и ионов О2- в воде не обнаружено. Вода является очень слабым электролитом, степень её диссоциации 2∙10-9, чистая вода почти не проводит электрический ток. Однако на все ионные равновесия в водных р-рах присутствие ионов Н+ и ОН- оказывает влияние и процесс диссоциации воды необходимо всегда учитывать. При диссоциации абсолютно чистой воды, которую мы принимаем за эталон нейтральности, концентрации ионов Н+ и ОН- равны и условие нейтральности мы можем записать следующим образом: КН2О=[H+][OH-]=1,0∙10-14. Введем новую величину, характеризующую среду и равную – lg[H+]. Обозначим её рН и в дальнейшем будем называть её водородным показателем. рН=7 (для нейтральной среды). Для кислотной среды рН<7. Для щелочной среды рН>7. Равновесие электролитической диссоциации воды влияет на общее равновесие в среде электролита, содержащего те ли другие растворенные в-ва.
Общие свойства металлов. Взаимодействие металлов с водой, кислотами и щелочами. Общие хим. св-ва металлов: малая ЭО как следствие низких потенциалов ионизации и малого, чаще отрицательного, сродства к электрону, атомы металлов образуют только положительные элементарные ионы, отдавая электроны, в сложных ионах или полярных молекулах атомы металлов всегда образуют положительные центры. Общие физические св-ва: электропроводность, твердость и т.д. Металлы высокой хим. активности (сильные восстановители) могут разлагать воду с вытеснением водорода при комнатных температурах. Менее активные металлы вступают в р-цию с водой при нагревании, образуя гидроксиды или оксиды. Со щелочами могут реагировать металлы, дающие амфотерные оксиды, или металлы, обладающие высокими степенями окисления, в присутствии сильных окислителей. Соли амфотерных гидратов обычно в водных р-рах образуют комплексные анионы, в которых лигандами являются ионы гидроксила. Металлы с переменными степенями окисления также могут образовывать растворимые соли кислот, соответствующие высшим степеням окисления данного металла. Эти р-ции идут в присутствии сильных окислителей. С кислотами металлы реагируют различно в зависимости от активности самого металла и окислительных св-в кислоты. Если кислоты кислородные и атомы неметаллов, их образующие будут иметь высокие степени окисления, то металлы могут восстанавливать кислоты до различных степеней окисления, сами при этом окисляясь до ионного состояния: а) в р-рах галогеноводородов является только ион Н+ или Н3О+; б) серная кислота сама может восстанавливаться или до S2-, или чаще до S4+. Степень восстановления зависит от активности металла, концентрации кислоты и температуры. Взаимодействие металлов с азотной кислотой может приводить к образованию различных продуктов с различными степенями окисления азота: активные металлы восстанавливают азот до NH3 и его комплексного иона – аммония.
|
Х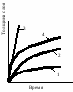 имическая и электрохимическая коррозия. Химическая коррозия, развивается в отсутствие электролитов. Она протекает при температурах, исключающих возможность образования насыщенного пара воды, - высокотемпературная или газовая коррозия. Этот же вид может возникать и в неводных органических средах. 1- логарифмический закон, 2 - параболически1 закон, 3 - линейный, 4 - сложнопараболический. Скорость окисления металла зависит от скорости химической р-ции и скорости диффузии окислителя через оксидную пленку. В зависимости от температуры для одного и того же окисляющегося металла проявляются различные законы роста пленки оксида. Электрохимическая коррозия подразделяется на: атмосферную, почвенную и т.д. Рассмотрим различные случаи возникновения коррозионных гальванических пар. 1. Контакт с электролитом двух разных металлов в случае сочетания в одном узле. 2. Контакт металла и его соединения, обладающего металлообразными и полупроводниковыми св-вами. В любом случае свободный металл имеет отрицательный заряд, а соединение – положительный, т.к. в нем часть электронов проводимости связана. 3. Различные концентрации электролитов или воздуха, растворенного в жидком электролите. 4. Различный уровень механических напряжений в одной и той же детали. Механизм электрохимической коррозии, определяемый разностью потенциалов пассивных (катодных) и активных (анодных) участков, сводится к работе ГЭ, однако результат может быть различен. имическая и электрохимическая коррозия. Химическая коррозия, развивается в отсутствие электролитов. Она протекает при температурах, исключающих возможность образования насыщенного пара воды, - высокотемпературная или газовая коррозия. Этот же вид может возникать и в неводных органических средах. 1- логарифмический закон, 2 - параболически1 закон, 3 - линейный, 4 - сложнопараболический. Скорость окисления металла зависит от скорости химической р-ции и скорости диффузии окислителя через оксидную пленку. В зависимости от температуры для одного и того же окисляющегося металла проявляются различные законы роста пленки оксида. Электрохимическая коррозия подразделяется на: атмосферную, почвенную и т.д. Рассмотрим различные случаи возникновения коррозионных гальванических пар. 1. Контакт с электролитом двух разных металлов в случае сочетания в одном узле. 2. Контакт металла и его соединения, обладающего металлообразными и полупроводниковыми св-вами. В любом случае свободный металл имеет отрицательный заряд, а соединение – положительный, т.к. в нем часть электронов проводимости связана. 3. Различные концентрации электролитов или воздуха, растворенного в жидком электролите. 4. Различный уровень механических напряжений в одной и той же детали. Механизм электрохимической коррозии, определяемый разностью потенциалов пассивных (катодных) и активных (анодных) участков, сводится к работе ГЭ, однако результат может быть различен.
|
Применение железа в технике. Электрорафинирование. Электроэкстракция. Гальванотехника. Электрохимическая обработка металла. ЭХО это новый метод формообразования изделий из металлов любой прочности и твердости, трудно поддающиеся механической обработке. Станок подает с заданной скоростью медный катод и через него прогоняет с большой скоростью электролит в зазор между стенками изделия и электродом для процесса электролиза и удаления пузырьков водорода и твердых частиц, которые могут возникнуть в этом процессе. Этот метод незаменим при обработке внутренних полостей, твердых металлом и т.д. Гальванопластика – получение изделий путем электролиза. Гальваностегия – нанесение металлических покрытий.
|
Последовательность разрядов ионов на катоде. Влияние водородного перенапряжения на восстановление ионов на катоде из водных растворов. 1. Катионы металлов, стоящих в ряду активности после водорода восстанавливаются на катоде без выделения водорода из воды. 2. Катионы металлов, стоящих в ряду активности поле алюминия, но до водорода, восстанавливаются на катоде одновременно с молекулами воды. 3. Катионы металлов, стоящих в ряду активности до алюминия на катоде не восстанавливаются, а единственным катодным процессом является восстановление воды.
|
Последовательность разрядов ионов на аноде. Явление пассивации при электролизе. 1. Ионы бескислородных кислот на аноде окисляются без выделения кислорода и воды. 2. Анионы кислородсодержащих кислот с атомом кислотообразующего элемента в промежуточной степени окисления на аноде окисляются одновременно с молекулами воды. 3. Анионы кислородсодержащих кислот с атомом кислотообразующего элемента в максимальной степени окисления на аноде не окисляются, а единственным анодным процессом является окисление молекул воды.
|
Гибридизация атомных орбиталей. Иногда в образовании хим. связи происходит перекрывание электронных облаков, разных по форме и энергии одного и того же атома. Экспериментально было установлено, что в молекуле СН4 все 4 хим. связи равноценны. Этот факт и подобные объясняются образованием гибридных облаков (гибридизацией), т.е. при образовании связей предварительно образуются гибридные облака. Энергетически это выгодно, т.к. энергия, которая затрачивается на возбуждение атома, компенсируется выделяющейся энергией при образовании связи гибридными облаками, т.к. область перекрывания существенно больше. Sp-гибридизация – элементы II A группы. Угол равен 1800, строение линейное. sp2 III A строение молекулы треугольное (1200). sp3 IV A 109028’ тетраэдрическое строение молекулы.
|
|
|
|
| |
 Скачать 206.5 Kb.
Скачать 206.5 Kb.