Кислота
|
Название и
Формула
|
Кд
|
Название и
Формула
|
Кд
|
Азотистая
HNO2
|
|
5,1310–4
|
Сероводородная H2S
|
К1 К2
|
1,0510–7
1,310–13
|
Алюминиевая-мета HAlO2
|
|
610–13
|
Сернистая
H2SO3
|
К1 К2
|
1,410–2
6,310–8
|
Борная
Н3ВО3
|
К1 К2 К3
|
5,810–10
1,810–13
1,610–14
|
Теллуристая H2TeO3
|
К1 К2
|
2,710–3
1,810–8
|
Бромноватистая HOBr
|
|
2,510–9
|
Теллуроводородная H2Te
|
К1 К2
|
2,310–3
10–11
|
Ванадиевая H3VO4
|
К2 К3
|
1,110–9
410–15
|
Теллуровая
H2TeO4
|
К1 К2
|
2,510–9
4,110–11
|
Водорода пероксид Н2О2
|
К1
|
210–12
|
Угольная
Н2СО3
|
К1 К2
|
4,510–7
4,810–11
|
Германиевая–мета H2GeO3
|
К1 К2
|
1,710–9
2,010–13
|
Уксусная CH3COOH
|
|
1,810–5
|
Иодноватистая
HOI
|
|
2,310–11
|
Фосфористая
H3PO3
|
К1 К2
|
1,610–2
210–7
|
Кремневая–мета H2SiO3
|
К1 К2
|
2,210–10
1,610–12
|
Фосфорная
H3PO4
|
К1 К2 К3
|
7,110–3
6,210–8
4,210–13
|
Марганцовистая H2MnO4
|
К1
К2
|
10–1
7,110–11
|
Фтороводородная
HF
|
|
6,810–4
|
Мышьяковая H3AsO4
|
К1 К2 К3
|
5,610–3
1,710–7
310–12
|
Хлорноватистая HClO
|
|
510–8
|
Муравьиная
НСООН
|
|
1,810–4
|
Хромовая
H2CrO4
|
К1 К2
|
1,110–1
3,210–7
|
Селенистая
H2SeO3
|
К1 К2
|
2,410–3
4,810–9
|
Циановодородная
(синильная) НCN
|
|
6,210–10
|
Селеноводородная H2Se
|
К1 К2
|
1,310–4
10–11
|
Щавелевая
Н2С2О4
|
К1 К2
|
5,610–2
5,410–5
|
О к о н ч а н и е т а б л. П2
Основание
|
Название и
Формула
|
Кд
|
Название и
Формула
|
Кд
|
Алюминия
гидроксид
Al(OH)3
|
К1 К2 К3
|
7,410–9
2,110–9
1,110–9
|
Марганца(II) гидроксид Mn(OH)2
|
К2
|
3,910–4
|
Аммония гидроксид NH4ОН
|
|
1,810–5
|
Меди(II) гидроксид Cu(OH)2
|
К2
|
3,410–7
|
Бария гидроксид Ва(ОН)2
|
К2
|
2,310–1
|
Никеля (II) гидроксид Ni(OH)2
|
К2
|
8,3210–4
|
Железа (II) гидроксид Fe(OH)2
|
К1 К2
|
1,210–2
1,310–4
|
Олова (II) гид-роксид Sn(ОН)2
|
К2
|
10–12
|
Железа (III) гидроксид Fe(OH)3
|
К2 К3
|
1,8210–11
1,3510–12
|
Ртути (II) гидроксид Hg(OH)2
|
К1 К2
|
410–12
510–11
|
Кадмия гидроксид Cd(OH)2
|
К1 К2
|
8,110–4 4,210–7
|
Свинца (II) гидроксид Pb(OH)2
|
К1 К2
|
510–4
1,410–8
|
Кобальта (II) гидроксид Со(ОН)2
|
К1 К2
|
7,910–5
8,910–6
|
Хрома (II) гидроксид Cr(OH)2
|
К2
|
410–8
|
Кальция гидроксид Са(ОН)2
|
К2
|
5,810–2
|
Хрома (III) гидроксид Cr(OH)3
|
К3
|
10–10
|
Магния гидроксид Mg(OH)2
|
К2
|
2,6310–3
|
Цинка гидроксид
Zn(OH)2
|
К1 К2
|
1,3210–5
2,010–9
|
П р и л о ж е н и е 3
Произведение растворимости ПР некоторых малорастворимых
электролитов при 298 К
Вещество
|
ПР
|
Вещество
|
ПР
|
Вещество
|
ПР
|
Be(OH)2
|
2,0910–19
|
Zn(OH)2
|
3,6910–17
|
Fe(OH)2
|
410–16
|
Mg(OH)2
|
6,7610–12
|
Sc(OH)3
|
210–30
|
Fe(OH)3
|
2,5110–39
|
Ga(OH)3
|
1,5810–37
|
Sn(OH)2
|
6,310–27
|
Al(OH)3
|
1,110–34
|
Bi(OH)3
|
310–36
|
Pb(OH)2
|
1,210–20
|
Co(OH)2
|
210–16
|
Pd(OH)2
|
10–30
|
Cr(OH)2
|
10–17
|
Co(OH)3
|
410–45
|
Cd(OH)2
|
2,210–14
|
Cr(OH)3
|
6,310–31
|
Ni(OH)2
|
6,3110–18
|
Cu(OH)2
|
210–20
|
Mn(OH)2
|
1,910–13
|
In(OH)3
|
1,2910–37
|
П р и л о ж е н и е 4
Температуры кипения Ткип, кристаллизации Тзам,
криоскопическая Ккр и эбуллиоскопическая Кэб постоянные
некоторых чистых растворителей
Растворитель
|
Тзам,
С
|
Ткип,
С
|
Ккр, 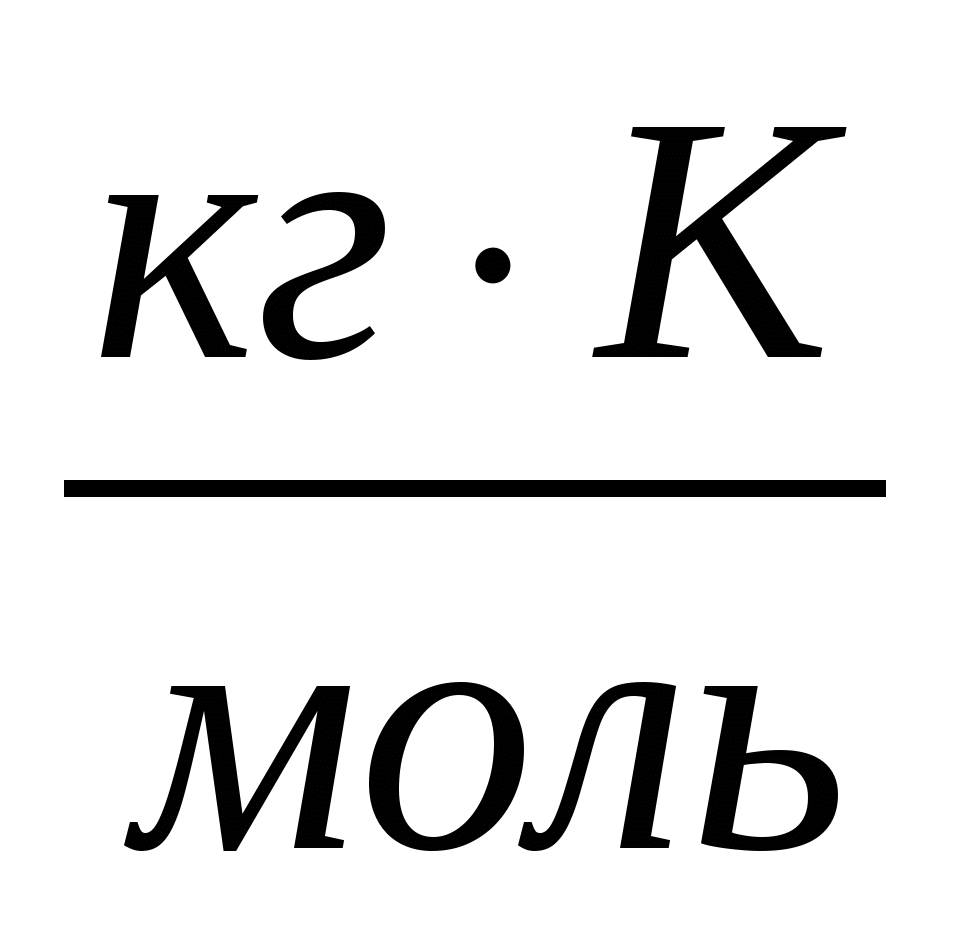
|
Кэб,
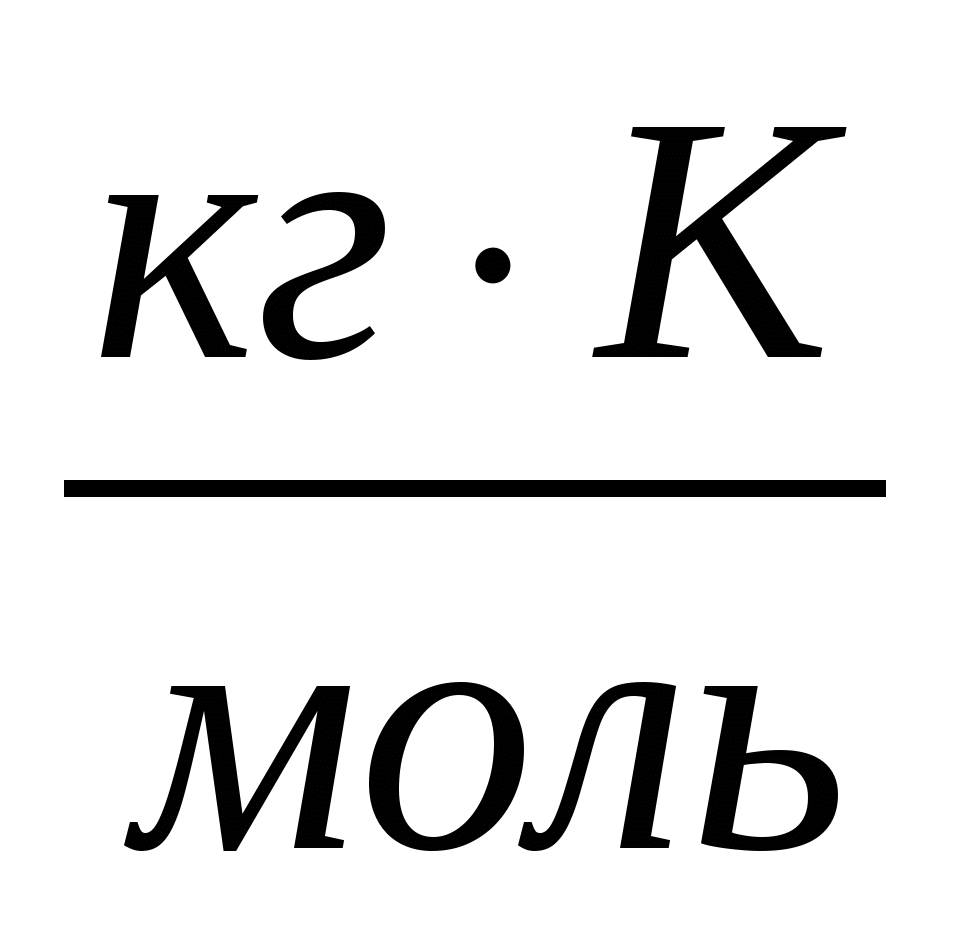
|
Ацетон
|
–95,35
|
56,24
|
2,4
|
1,48
|
Бензол
|
5,53
|
80,1
|
5,12
|
2,57
|
Вода
|
0
|
100
|
1,86
|
0,52
|
Диэтиловый эфир
|
–116
|
34,5
|
1,79
|
2,12
|
Сероуглерод
|
–111,6
|
46,2
|
3,8
|
2,29
|
Уксусная кислота
|
16,75
|
118,1
|
3,9
|
3,07
|
Циклогексан
|
6,6
|
80,75
|
20,2
|
2,75
|
Хлороформ
|
–63,5
|
61,2
|
4,9
|
3,61
|
Четыреххлористый углерод
|
–22,96
|
76,75
|
29,8
|
5,25
|
Этанол
|
–114,5
|
78,3
|
1,99
|
1,22
|
П р и л о ж е н и е 5
Константы нестойкости некоторых комплексных ионов
Формула иона
|
Кнест
|
Формула иона
|
Кнест
|
Формула иона
|
Кнест
|
Аммиакаты
|
Цианидные комплексы
|
Галогенидные
комплексы
|
[Zn(NH3)4]2+
|
3,510–10
|
[Cu(CN)4]2–
|
510–28
|
[AuCl4]–
|
510–22
|
[Cu(NH3)2]+
|
1,410–11
|
[Zn(CN)4]2–
|
210–17
|
[AgI4]3–
|
7,9410–14
|
[Cd(NH3)4]2+
|
2,510–7
|
[Cd(CN)4]2–
|
7,761018–
|
[BeF4]2–
|
4,1710–17
|
[Hg(NH3)4]2+
|
5,210–20
|
[Ni(CN)4]2–
|
310–16
|
[BiBr6]3–
|
310–10
|
Гидроксокомплексы
|
Роданидные комплексы
|
[CdI4]2–
|
7,9410–7
|
[Ag(SCN)4]3–
|
2,1410–10
|
[PdBr4]2–
|
7,9410–14
|
[In(OH)4]–
|
210–29
|
[Cu(SCN)4]2–
|
310–7
|
[PtBr4]2–
|
3,1610–21
|
[Be(OH)4]2–
|
10–15
|
[Cr(SCN)6]3–
|
1,5810–4
|
[PtCl4]2–
|
10–16
|
[Cu(OH)4]2-
|
3,1610–19
|
Нитритные комплексы
|
[HgI4]2–
|
1,4810–30
|
[Zn(OH)4]2–
|
2,210–15
|
[PdCl6]4–
|
510–12
|
[Sb(OH)4]–
|
510–39
|
[Hg(NO2)4]2–
|
2,8810–14
|
[HgBr4]2–
|
10–21
|
П р и л о ж е н и е 6
Стандартные электродные потенциалы
электродов Е при 298 К
Электрод
|
Электродная реакция
|
Е, В
|
Металлические электроды
|
Li+|Li
|
Li+ + e ó Li
|
–3,045
|
K+|K
|
K+ + e ó K
|
–2,925
|
Cs+|Cs
|
Cs+ + e ó Cs
|
–2,92
|
Ba2+|Ba
|
Ba2+ + 2e ó Ba
|
–2,906
|
Ca2+|Ca
|
Ca2+ + 2e ó Ca
|
–2,866
|
Na+|Na
|
Na+ + e ó Na
|
–2,714
|
La3+|La
|
La3+ + 3e ó La
|
–2,522
|
Mg2+|Mg
|
Mg2+ + 2e ó Mg
|
–2,363
|
Be2+|Be
|
Be2+ + 2e ó Be
|
–1,847
|
Al3+|Al
|
Al3+ + 3e ó Al
|
–1,662
|
Ti2+|Ti
|
Ti2+ + 2e ó Ti
|
–1,628
|
Ti3+|Ti
|
Ti3+ + 3e ó Ti
|
–1,21
|
V2+|V
|
V2+ +2e ó V
|
–1,186
|
Mn2+|Mn
|
Mn2+ + 2e ó Mn
|
–1,180
|
Cr2+|Cr
|
Cr2+ + 2e ó Cr
|
–0,913
|
Zn2+|Zn
|
Zn2+ + 2e ó Zn
|
–0,763
|
Cr3+|Cr
|
Cr3+ + 3e ó Cr
|
–0,744
|
Ga3+|Ga
|
Ga3+ + 3e ó Ga
|
–0,529
|
Fe2+|Fe
|
Fe2+ + 2e ó Fe
|
–0,44
|
Cd2+|Cd
|
Cd2+ + 2e ó Cd
|
–0,403
|
In3+|In
|
In3+ + 3e ó In
|
–0,34
|
Tl+|Tl
|
Tl+ + e ó Tl
|
–0,336
|
Co2+|Co
|
Co2 + + 2e ó Co
|
–0,277
|
Ni2+|Ni
|
Ni2+ + 2e ó Ni
|
–0,25
|
Mo3+|Mo
|
Mo3+ +3e ó Mo
|
–0,2
|
П р о д о л ж е н и е т а б л. П6
Электрод
|
Электродная реакция
|
Е0, В
|
Sn2+|Sn
|
Sn2+ + 2e ó Sn
|
–0,136
|
Pb2+|Pb
|
Pb2+ + 2e ó Pb
|
–0,126
|
W3+|W
|
W3+ + 3e ó W
|
–0,05
|
Fe3+|Fe
|
Fe3+ + 3e ó Fe
|
–0,036
|
Sn4+|Sn
|
Sn4+ + 4e ó Sn
|
+0,007
|
Ge2+|Ge
|
Ge2+ + 2e ó Ge
|
+0,01
|
Sb3+|Sb
|
Sb3+ + 3e ó Sb
|
+0,2
|
Bi3+|Bi
|
Bi3+ + 3e ó Bi
|
+0,215
|
Cu2+|Cu
|
Cu2+ + 2e ó Cu
|
+0,337
|
Cu+|Cu
|
Cu+ + e ó Cu
|
+0,521
|
Ag+|Ag
|
Ag+ + e ó Ag
|
+0,8
|
Os2+|Os
|
Os2+ + 2e ó Os
|
+0,85
|
Hg2+|Hg
|
Hg2+ + 2e ó Hg
|
+0,854
|
Pd2+|Pd
|
Pd2+ + 2e ó Pd
|
+0,987
|
Pt2+|Pt
|
Pt2+ + 2e ó Pt
|
+1,200
|
Au3+|Au
|
Au3+ + 3 e ó Au
|
+1,498
|
Au+|Au
|
Au+ + e ó Au
|
+1,691
|
Газовые электроды
|
Pt|H2|H+
|
2H+ + 2e ó H2
|
0,00
|
Pt|H2|OH–, H2O
|
2H2O + 2e ó H2 + 2 OH–
|
–0,828
|
Pt|Cl2|Cl–
|
Cl2 + 2e ó 2Cl–
|
+1,36
|
Pt|F2|F–
|
F2 + 2e ó 2F–
|
+2,87
|
Pt|O2|OH–, H2O
|
O2 + 2H2O + 4eó 4OH–
|
+0,401
|
Pt|O2|H+, H2O
|
O2 + 4H+ + 4e ó 2H2O
|
+1,229
|
Электроды второго рода
|
Ag | AgCl, Cl–
|
AgCl + e ó Ag + Cl–
|
+0,222
|
Hg | Hg2Cl2, Cl–
|
Hg2Cl2 + 2e ó 2Hg + 2Cl–
|
+0,268
|
О к о н ч а н и е т а б л. П6
Электрод
|
Электродная реакция
|
Е, В
|
Электроды второго рода
|
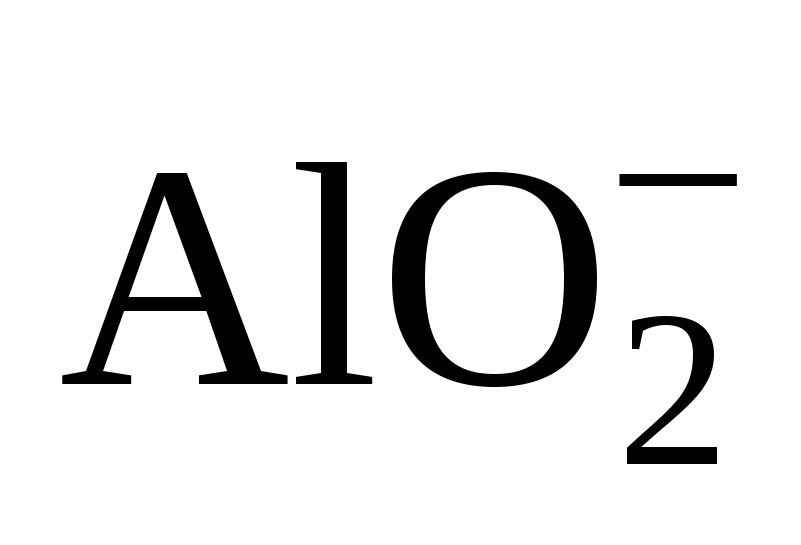 |Al |Al
|
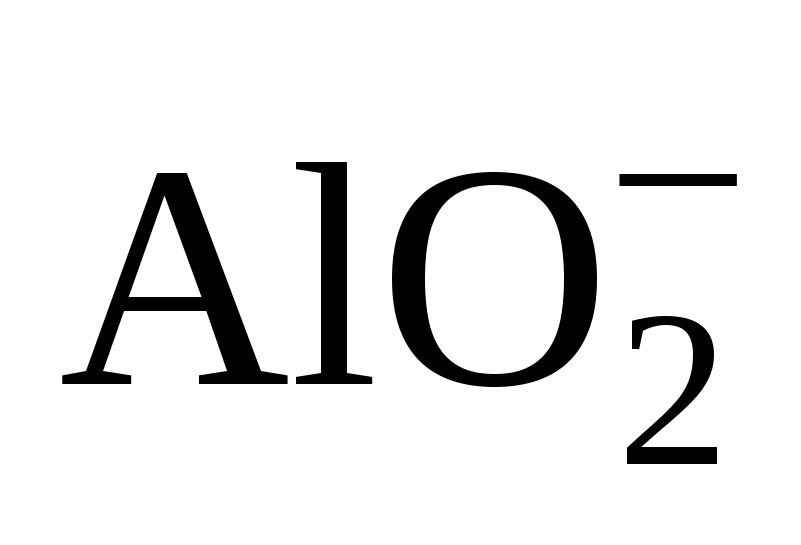 + 2 H2O + 3e ó Al + 4 OH– + 2 H2O + 3e ó Al + 4 OH–
|
–2,35
|
Al(OH)3 |Al
|
Al(OH)3 + 3e ó Al + 3 OH–
|
–2,31
|
Ag2O |Ag
|
Ag2O + H2O + e ó 2Ag + 2 OH–
|
+0,345
|
Be(OH)2|Be
|
Be(OH)2 + 2e ó Be + 2 OH–
|
–2,6
|
Bi2O3|Bi
|
Bi2O3 + 3 H2O + 6e ó Bi + 6 OH–
|
–0,46
|
Cd(OH)2|Cd
|
Cd(OH)2 + 2e ó Cd + 2 OH–
|
–0,824
|
Co(OH)2|Co
|
Co(OH)2 + 2e ó Co + 2 OH–
|
–0,73
|
Cr(OH)2|Cr
|
Cr(OH)2 + 2e ó Cr + 2 OH–
|
–1,355
|
Cu(OH)2|Cu
|
Cu(OH)2 + 2e ó Cu + 2 OH–
|
–0,224
|
Fe(OH)2|Fe
|
Fe(OH)2 + 2e ó Fe + 2 OH–
|
–0,877
|
Ga(OH)3|Ga
|
Ga(OH)3 + 3e ó Ga + 3 OH–
|
–1,26
|
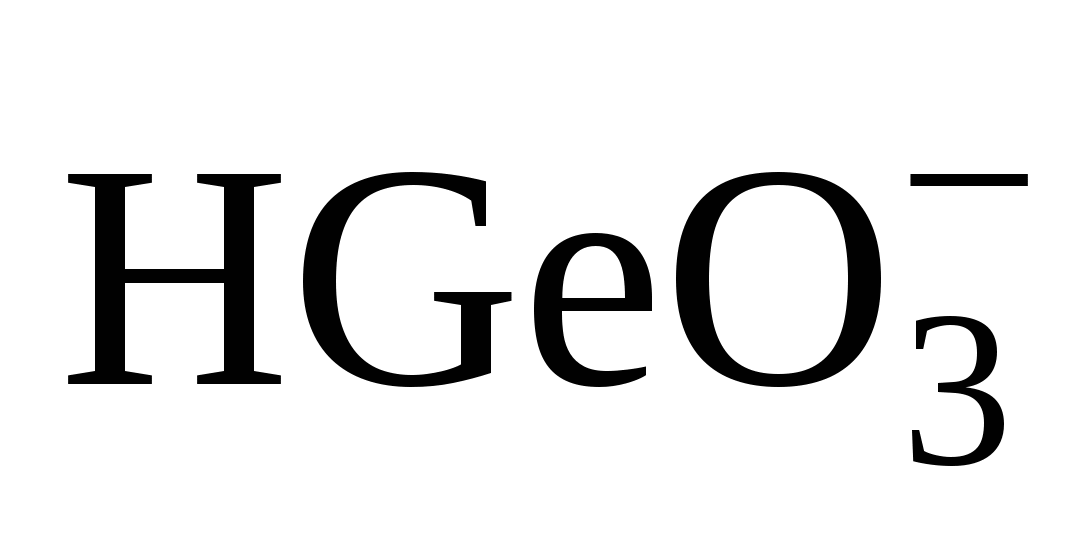 |Ge |Ge
|
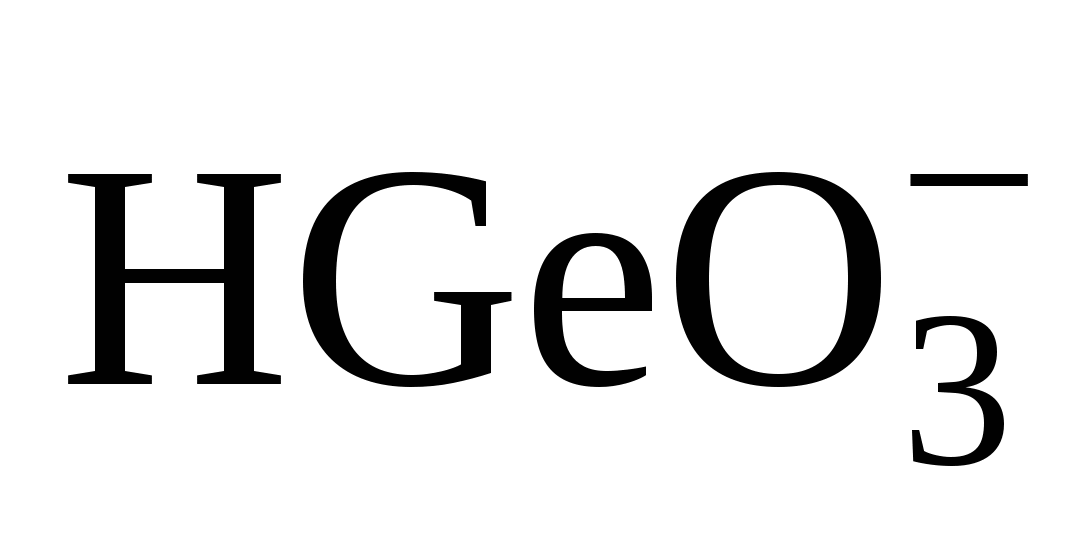 + 2 H2O + 4e ó Ge + 5OH– + 2 H2O + 4e ó Ge + 5OH–
|
–1,0
|
In(OH)3|In
|
In(OH)3 + 3e ó In + 3 OH–
|
–1,0
|
HgOHg
|
HgO + H2O + 2e ó Hg + 2 OH–
|
+0,098
|
Mg(OH)2|Mg
|
Mg(OH)2 + 2e ó Mg + 2 OH–
|
–2,694
|
Ni(OH)2|Ni
|
Ni(OH)2 + 2e ó Ni + 2 OH–
|
–0,729
|
Mn(OH)2|Mn
|
Mn(OH)2 + 2e ó Mn + 2 OH–
|
–1,56
|
PbO|Pb
|
PbO + H2O + 2e ó Pb + 2 OH–
|
–0,578
|
Pb(OH)2|Pb
|
Pb(OH)2 + 2e ó Pb + 2 OH–
|
–0,714
|
Pd(OH)2|Pd
|
Pd(OH)2 + 2e ó Pd + 2 OH–
|
+0,07
|
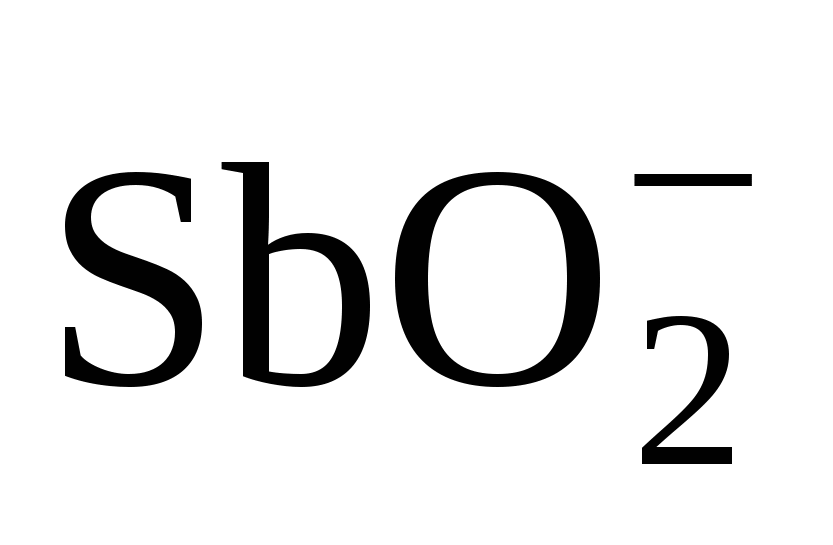 |Sb |Sb
|
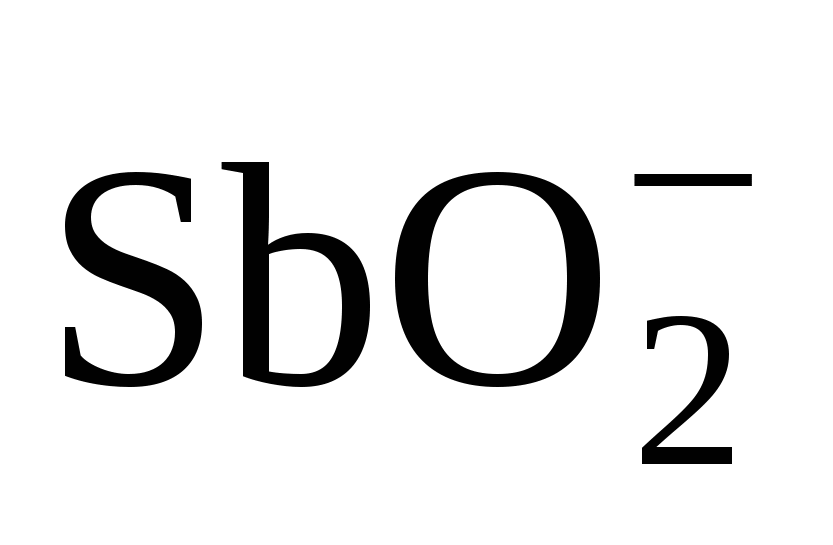 + 2 H2O + 3e ó Sb + 4 OH– + 2 H2O + 3e ó Sb + 4 OH–
|
–0,675
|
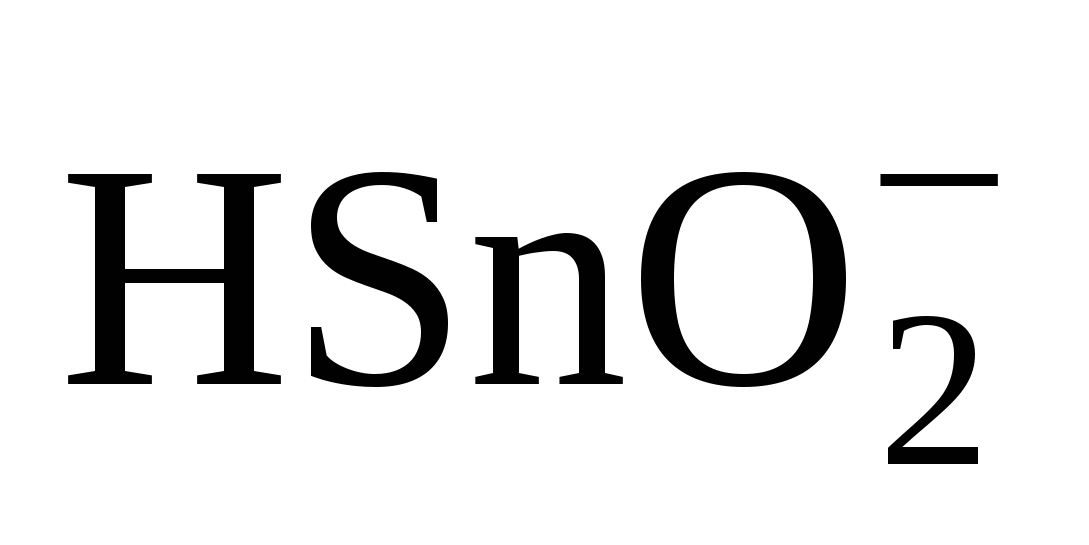 |Sn |Sn
|
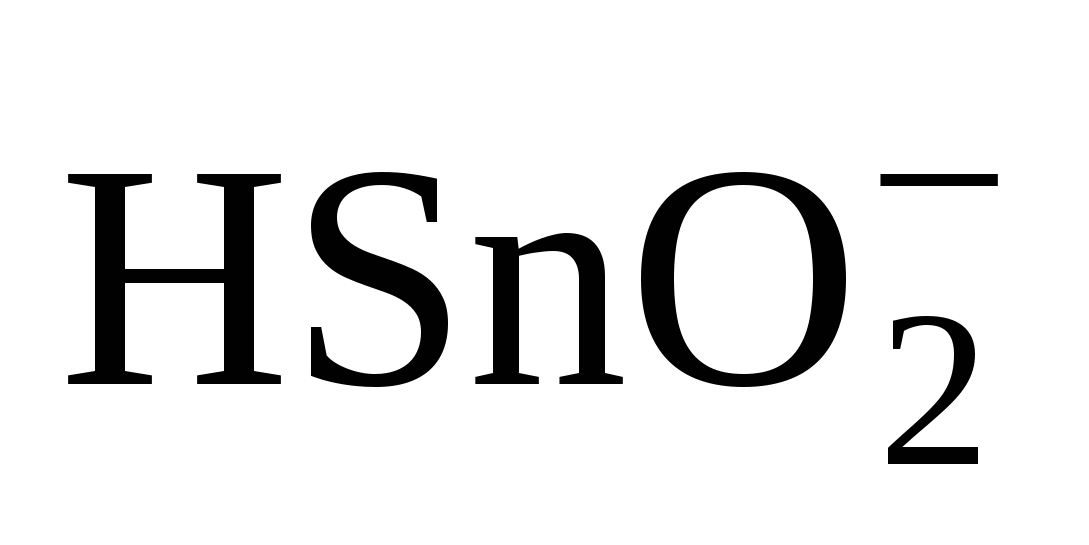 + H2O + 2e ó Sn + 3 OH– + H2O + 2e ó Sn + 3 OH–
|
–0,91
|
TlOHTl
|
TlOH + e ó Tl + OH–
|
–0,344
|
Zn(OH)2|Zn
|
Zn(OH)2 + 2e ó Zn + 2 OH–
|
–1,245
| |
 Скачать 1.17 Mb.
Скачать 1.17 Mb.