Гальванический элемент
Задание 1. Даны два электрода (см. вариант в табл. 12).
Запишите уравнение Нернста для расчета электродного потенциала и вычислите его значение для каждого электрода в растворе электролита при заданных условиях и Т=298 К.
Запишите электрохимическую систему (гальванический элемент), уравнения электродных реакций (на катоде и аноде), суммарной (токообразующей) реакции, определяющих работу этого элемента.
Рассчитайте равновесное напряжение составленного гальванического элемента.
Стандартные электродные потенциалы электродов приведены в приложении 6.
Т а б л и ц а 12
Номер варианта
|
Электрод I
|
Электрод II
|
схема
электрода
|
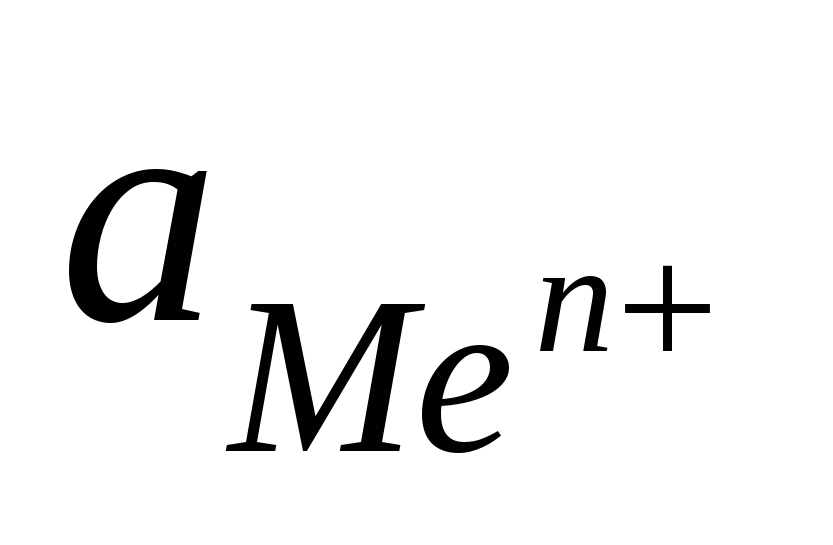 , ,
моль/л
|
схема
электрода
|
рН
раствора
|
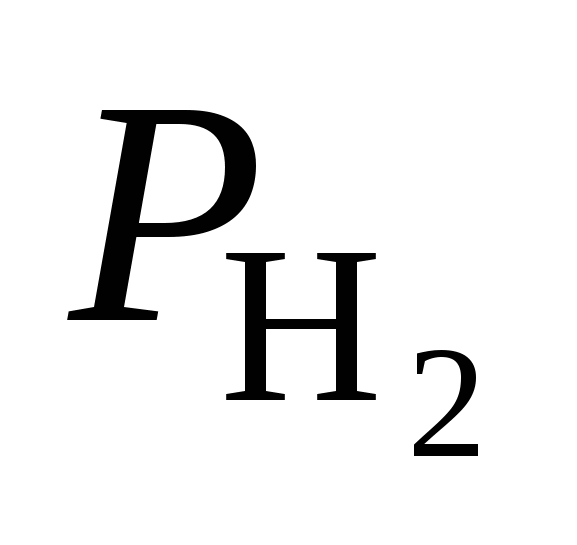 ( (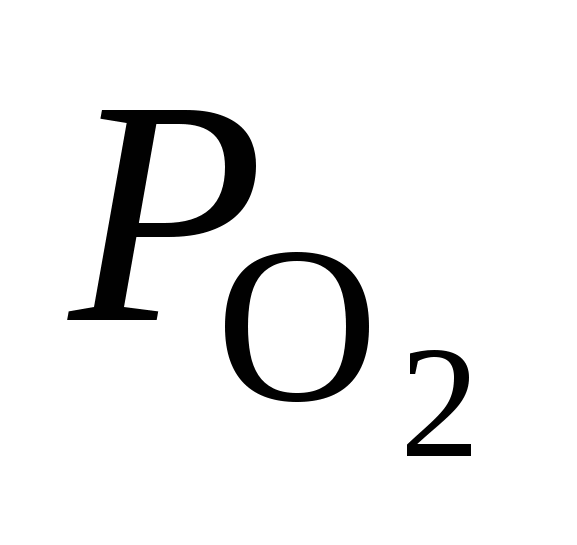 ) )
мм рт. cт.
|
1
|
Ag+ | Ag
|
0,01
|
Н2О, ОН– | О2, Pt
|
8
|
0,5
|
2
|
Fe2+ | Fe
|
0,05
|
Н2О, ОН– | О2, Pt
|
5
|
0,5
|
3
|
Cu2+ | Cu
|
0,02
|
Н+ | Н2, Pt
|
4
|
0,5
|
4
|
Co2+ | Co
|
0,01
|
Н2О, ОН– | О2, Pt
|
9
|
0,25
|
5
|
Ni2+ | Ni
|
0,03
|
Н2О, ОН– | О2, Pt
|
2
|
0,7
|
6
|
Fe2+ | Fe
|
0,05
|
Н+ | Н2, Pt
|
3
|
1,5
|
7
|
Pb2+ | Pb
|
0,02
|
Н+ | Н2, Pt
|
9
|
0,5
|
8
|
Bi3+ | Bi
|
0,03
|
Н+ | Н2, Pt
|
4
|
0,2
|
9
|
Sn2+ | Sn
|
0,04
|
Н2О, ОН– | О2, Pt
|
2
|
1,2
|
10
|
Cr2+ | Cr
|
0,02
|
Н2О, ОН– | О2, Pt
|
3
|
0,4
|
О к о н ч а н и е т а б л. 12
Номер варианта
|
Электрод I
|
Электрод II
|
схема
электрода
|
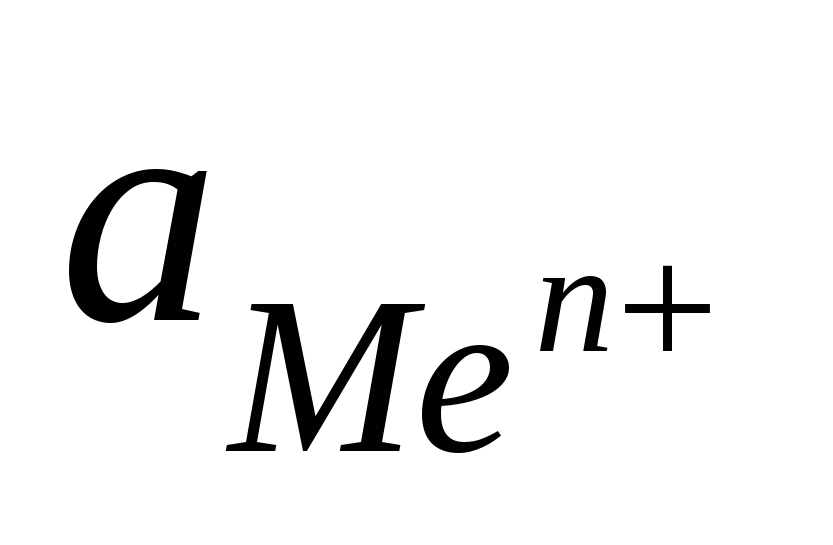 , ,
моль/л
|
схема
электрода
|
рН
раствора
|
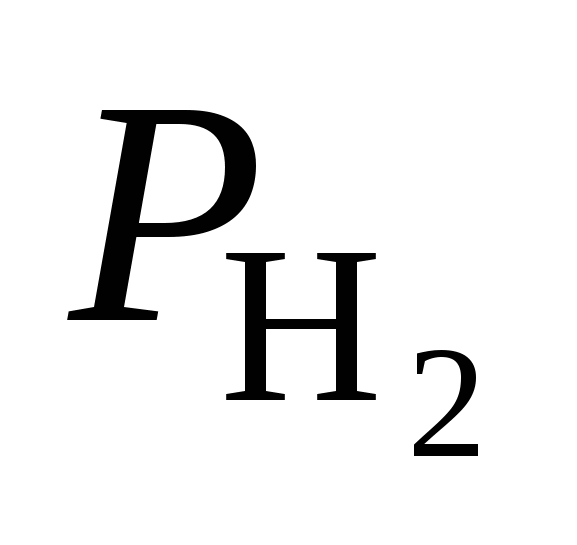 ( (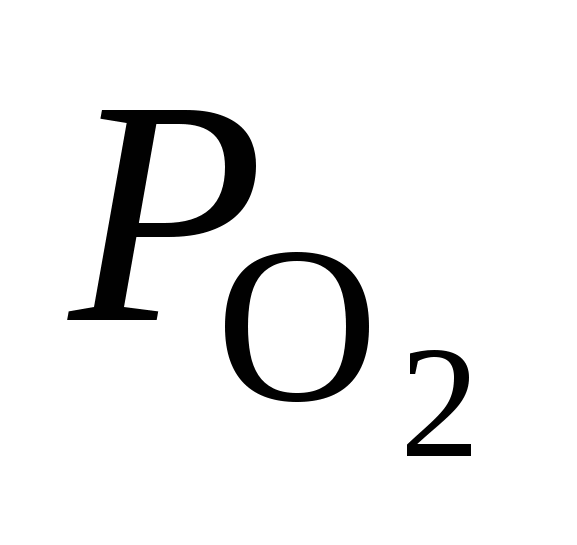 ) )
мм рт. cт.
|
11
|
Cr3+ | Cr
|
0,01
|
Н+ | Н2, Pt
|
11
|
0,4
|
12
|
Ti3+ | Ti
|
0,03
|
Н+ | Н2, Pt
|
5
|
0,9
|
13
|
In3+ | In
|
0,01
|
Н2О, ОН– | О2, Pt
|
1
|
0,2
|
14
|
Cu+ | Cu
|
0,02
|
Н2О, ОН– | О2, Pt
|
2
|
0,7
|
15
|
Mn2+ | Mn
|
0,01
|
Н+ | Н2, Pt
|
12
|
0,3
|
16
|
Ti2+ | Ti
|
0,04
|
Н+ | Н2, Pt
|
5
|
1,5
|
17
|
Cd2+ | Cd
|
0,05
|
Н+ | Н2, Pt
|
9
|
0,5
|
18
|
Zn2+ | Zn
|
0,5
|
Н2О, ОН– | О2, Pt
|
2
|
0,7
|
19
|
Mg2+ | Mg
|
0,02
|
Н+ | Н2, Pt
|
4
|
1,2
|
20
|
Al3+ Al
|
0,03
|
Н+ | Н2, Pt
|
8
|
0,5
|
21
|
Ag+ | Ag
|
0,05
|
Н2О, ОН– | О2, Pt
|
5
|
0,5
|
22
|
Fe2+ | Fe
|
0,01
|
Н2О, ОН– | О2, Pt
|
8
|
0,5
|
23
|
Sb3+ | Sb
|
0,04
|
Н2О, ОН– | О2, Pt
|
5
|
0,8
|
24
|
W3+ | W
|
0,01
|
Н2О, ОН– | О2, Pt
|
12
|
0,1
|
25
|
Mo3+ | Mo
|
0,03
|
Н+ | Н2, Pt
|
6
|
0,4
|
Задание 2. Гальванический элемент составлен из двух металлических электродов (см. вариант в табл. 13).
Подберите электролиты (см. приложение 7) и запишите электрохимическую систему (гальванический элемент).
Запишите уравнения электродных реакций и суммарной реакции, определяющие работу гальванического элемента.
Рассчитайте равновесное напряжение гальванического элемента, составленного из указанных электродов с учетом активности потенциалопределяющих ионов (а).
Рассчитайте энергию Гиббса, используя равновесное напряжение гальванического элемента.
Т а б л и ц а 13
-
Номер варианта
|
Электрод I
|
Электрод II
|
Активность потенциал определяющих ионов а, моль/л
|
электрода I
|
электрода II
|
1
|
Ga3+Ga
|
Ag+ | Ag
|
0,1
|
0,01
|
2
|
Pd2+ | Pd
|
Cr3+ | Co
|
0,2
|
0,05
|
3
|
Au3+ | Au
|
Cd2+ | Cd
|
0,01
|
0,5
|
4
|
Sn2+ Sn
|
Ag+ Ag
|
0,2
|
0,001
|
5
|
Au3+ | Au
|
Sn2+ | Sn
|
0,005
|
1,5
|
6
|
Ag+ | Ag
|
Mg2+ | Zn
|
0,02
|
0,5
|
7
|
Cu+ | Cu
|
Ti2+ | Ti
|
0,05
|
0,2
|
8
|
Cr3+Cr
|
Sn2+ | Sn
|
0,03
|
1,2
|
9
|
Ni2+ | Ni
|
Al3+ | Al
|
0,05
|
1,3
|
10
|
Mg2+ | Mg
|
In3+ | In
|
1,7
|
0,05
|
11
|
Pb2+ | Pb
|
Au3+ | Au
|
0,02
|
0,003
|
12
|
Cd2+ | Cd
|
Cr3+ | Cr
|
0,8
|
0,2
|
13
|
Zn2+ | Zn
|
Sb3+ | Sb
|
0,002
|
0,03
|
14
|
Pd2+ | Pd
|
Ga3+ Ga
|
0,01
|
1,0
|
15
|
Fe2+ | Fe
|
Sb3+ | Sb
|
0,02
|
0,2
|
16
|
In3+ | In
|
Cо2+ | Cо
|
0,2
|
0,005
|
17
|
Ti2+ | Ti
|
Fе3+ | Fe
|
0,05
|
1,5
|
18
|
Ga3+ | Ga
|
Zn2+ | Zn
|
0,8
|
0,5
|
19
|
Cr3+ | Cr
|
Ag+ Ag
|
0,7
|
0,1
|
20
|
Cd2+ | Cd
|
Fe3+ | Fe
|
0,5
|
0,02
|
О к о н ч а н и е т а б л. 13
-
Номер варианта
|
Электрод I
|
Электрод II
|
Активность потенциал определяющих ионов а, моль/л
|
электрода I
|
электрода II
|
21
|
Cu2+ | Cu
|
Au3+ | Au
|
2,0
|
0,001
|
22
|
V2+ | V
|
Sn4+ | Sn
|
0,04
|
0,5
|
23
|
Bi3+ Bi
|
Cu2+ | Cu
|
0,5
|
0,05
|
24
|
Pb2+ Pb
|
Ga3+Ga
|
0,5
|
0,1
|
25
|
Mo3+ | Mo
|
Zn2+ | Zn
|
0,01
|
0,9
|
Электролиз водных растворов электролитов
Задание3.Дан водный раствор электролита (см. вариант в таб. 14).
Запишите электрохимическую систему, уравнения электродных реакций электролиза с графитовыми электродами.
Укажите рН раствора до электролиза (больше, меньше или равно 7). Если в процессе электролиза меняется рН раствора у электродов, укажите в какую сторону.
Рассчитайте массу или объем (для газа) веществ, выделившихся на электродах при электролизе. Катодный выход металла по току равен 80%, если на электроде протекает две реакции. Если на катоде выделяется только один металл или один газ, выход по току процесса равен 100%. Анодный выход по току 100% во всех случаях.
Как изменится анодный процесс, если анод заменить на другой металл, указанный в таблице. Запишите соответствующие электродные реакции.
Т а б л и ц а 14
Номер варианта
|
Раствор электролита
|
Ток,
А
|
Время,
ч
|
Количество прошедшего электричества, Ач
|
Замена материала анода
|
1
|
СоCl2
|
|
|
8
|
Со
|
2
|
NiSO4
|
5
|
7
|
|
Ni
|
3
|
SnSO4
|
3
|
5
|
|
Sn
|
4
|
Zn(NO3)2
|
|
|
11
|
Zn
|
5
|
BeSO4
|
3
|
7
|
|
Fe
|
6
|
Cr2(SO4)3
|
3
|
3
|
|
Cu
|
7
|
Bi(NO3)3
|
|
|
5
|
Bi
|
8
|
Pb(NO3)2
|
3
|
2
|
|
Pb
|
9
|
FeCl3
|
5
|
7
|
|
Fe
|
10
|
CoSO4
|
|
|
8
|
Fe
|
11
|
Pd(NO3)2
|
4
|
1,5
|
|
Al
|
12
|
KCl
|
3
|
7
|
|
Cd
|
13
|
Li2SO4
|
|
|
22
|
Fe
|
14
|
Fe(NO3)3
|
3
|
5
|
|
Fe
|
15
|
SnCl4
|
3
|
3
|
|
Sn
|
16
|
MgBr2
|
|
|
11
|
Ni
|
17
|
SbCl3
|
4
|
3
|
|
Sb
|
18
|
LiNO3
|
2,5
|
4
|
|
Cu
|
19
|
MnCl2
|
|
|
43
|
Mn
|
20
|
Al2(SO4)3
|
|
|
23
|
Bi
|
21
|
SnCl2
|
3
|
5
|
|
Sn
|
22
|
FeSO4
|
|
|
21
|
Fe
|
23
|
NiCl2
|
|
|
12
|
Ni
|
24
|
Mo(NO3)3
|
5
|
6
|
|
Mo
|
25
|
In2(SO4)3
|
|
|
15
|
In
|
Коррозия металлов
Задание 4. Даны пара металлов и значения рН водной среды (см. вариант в таблица 15).
Оцените возможность коррозии металла в данной электрохимической системе на основании сравнения рассчитанных равновесных потенциалов электродов: водородного, кислородного и данных металлов (равновесные потенциалы металлических электродов принимаем равными их стандартному значению).
Запишите коррозионную электрохимическую систему, уравнения электродных реакций при коррозии металла из данной пары в водной среде с заданным значением рН при контакте с воздухом.
Предложите для данной пары металлов при заданном значении рН катодное и анодное металлическое покрытие.
Запишите электрохимическую схему коррозионных элементов, образующихся при нарушении целостности покрытий, уравнения электродных реакций при коррозии для данных элементов.
Предложите протекторную защиту для данной пары металлов. Запишите электрохимическую систему, уравнения электродных реакций при протекторной защите.
Запишите электрохимическую систему электрозащиты (катодной) данной пары металлов, уравнения электродных реакций при работе электрозащиты.
Т а б л и ц а 15
-
Номер варианта
|
Металлы
|
рН
|
1
|
Cu–Co
|
4
|
10
|
2
|
Cu–Fe
|
5
|
11
|
3
|
Cu–Ni
|
2
|
9
|
4
|
Fe–Sb
|
5
|
11
|
5
|
Cu–Cd
|
3
|
10
|
О к о н ч а н и е т а б л. 15
-
6
|
Sn–Cd
|
4
|
11
|
7
|
Fe–Co
|
3
|
10
|
8
|
Zn–Ag
|
7
|
10
|
9
|
Cu–Sn
|
5
|
9
|
10
|
Cd–Ni
|
4
|
10
|
11
|
Ni–Cr
|
2
|
8
|
12
|
Fe–Pd
|
3
|
11
|
13
|
Fe–Pb
|
3
|
8
|
14
|
Cu–Pb
|
3
|
12
|
15
|
Fe–In
|
4
|
10
|
16
|
Ag–Ni
|
6
|
10
|
17
|
Вi–Cu
|
3
|
10
|
18
|
Cd–Pb
|
6
|
12
|
19
|
Ni–Sn
|
2
|
10
|
20
|
Al–Zn
|
2
|
9
|
21
|
Al–Cd
|
5
|
11
|
22
|
Al–Ni
|
2
|
9
|
23
|
Al–Ag
|
3
|
8
|
24
|
Mg–Cu
|
2
|
9
|
25
|
Ge–Ni
|
4
|
10
| |
 Скачать 1.17 Mb.
Скачать 1.17 Mb.