№ 4158
54
Х 465
Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
ХИМИЯ
Сборник индивидуальных домашних заданий
для студентов технических направлений
дневной формы обучения
НОВОСИБИРСК
2012
УДК
Составители: А.И. Апарнев, к.х.н., доцент
В.К. Варенцов, д.т.н., профессор
Г.К. Лупенко, к.х.н., доцент
Р.Е. Синчурина, ассистент
Рецензенты: Т.П. Александрова, к.х.н., доцент
Работа подготовлена на кафедре химии
Новосибирский государственный
технический университет, 2012
ОГЛАВЛЕНИЕ
Тема 1. Химический эквивалент. Закон эквивалентов. Окислительно-восстановительные реакции 5
Тема 2. Строение вещества 7
Тема 3. Основные закономерности протекания химических процессов 8
Тема 4. Кинетика химических процессов и химическое равновесие 9
Тема 5. Растворы электролитов 12
Тема 6. Коллоидные растворы 16
Тема 7. Общие свойства растворов 19
Тема 8. Комплексные соединения 21
Тема 9. Электрохимические процессы 23
Приложения 30
Литература 40
ПРЕДИСЛОВИЕ
Выполнение индивидуальных заданий дает возможность проверить уровень усвоения основных разделов курса химии. Индивидуальная работа осуществляется в основном по учебникам Коровин Н. В. Общая химия: учебник для вузов / В. Н. Коровин. – М.: Высшая школа, 2008; Глинка Н. Л. Общая химия: [учебное пособие для вузов] / Н. Л. Глинка; под ред. А. И. Ермакова. – М.: Интеграл-Пресс, 2005 и конспектам лекций. Необходимые справочные данные приведены в приложении. Студенту выдается определенное число заданий по темам, номер варианта соответствует номеру в журнале группы. Задания выполняются в письменной форме в отдельной тетради (или на отдельных листах) и сдаются преподавателю в сроки, указанные в учебном плане.
Т е м а 1
Химический эквивалент.
Закон эквивалентов.
Окислительно-восстановительные реакции
Задание 1. Даны массы двухвалентного металла (mМе), его оксида (mо) и сульфида (mс) (см. ваш вариант в табл. 1).
Рассчитайте молярные массы эквивалентов металла, серы, оксида и сульфида металла. Установите и запишите химические формулы веществ.
Задание 2. Даны масса двухвалентного металла (mМе) и объем кислорода (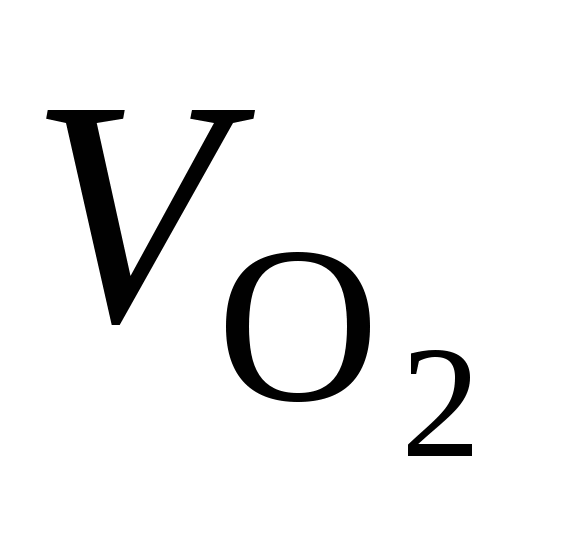 ), затраченного на его окисление при н.у. (см. ваш вариант в табл. 1). ), затраченного на его окисление при н.у. (см. ваш вариант в табл. 1).
Рассчитайте молярную массу эквивалентов металла, молярную массу металла и назовите металл.
Т а б л и ц а 1
Номер варианта
|
Задание 1
|
Задание 2
|
Номер варианта
|
Задание 1
|
Задание 2
|
mМе,
г
|
mо,
г
|
mс,
г
|
mМе,
г
|
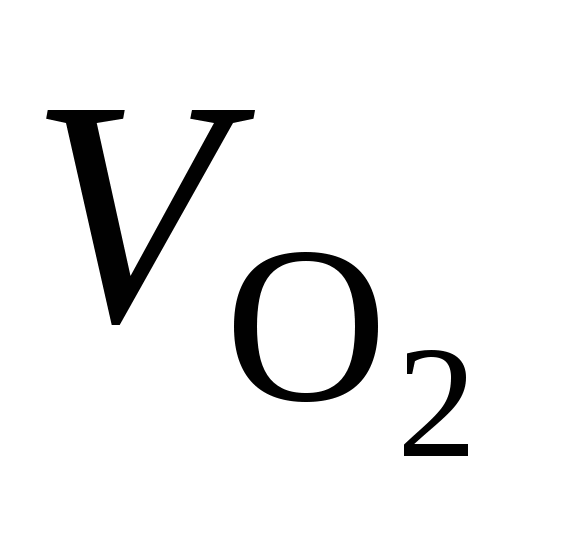 , ,
л
|
mМе,
г
|
mо,
г
|
mс,
г
|
mМе,
г
|
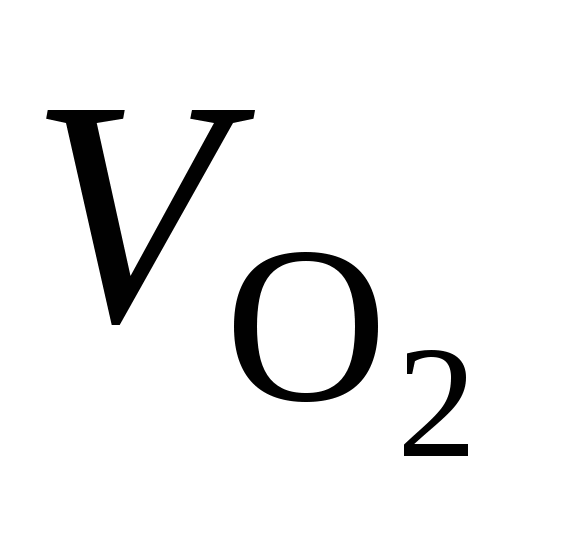 , ,
л
|
1
|
3,01
|
3,56
|
4,11
|
17,9
|
1,46
|
14
|
3,74
|
4,99
|
6,24
|
7,42
|
1,41
|
2
|
3,22
|
4,01
|
4,80
|
9,4
|
1,61
|
15
|
3,66
|
6,07
|
8,48
|
5,05
|
0,89
|
3
|
2,58
|
3,23
|
3,88
|
6,6
|
3,04
|
16
|
2,98
|
4,17
|
5,36
|
5,44
|
1,52
|
4
|
3,07
|
3,95
|
4,83
|
7,9
|
1,01
|
17
|
3,22
|
3,93
|
4,64
|
16,56
|
1,65
|
5
|
4,07
|
5,18
|
6,29
|
9,8
|
1,87
|
18
|
3,99
|
4,59
|
5,19
|
4,4
|
5,47
|
6
|
3,88
|
5,01
|
6,14
|
11,4
|
2,01
|
19
|
3,65
|
4,29
|
4,93
|
3,3
|
1,52
|
7
|
2,98
|
3,21
|
3,44
|
6,6
|
3,04
|
20
|
3,72
|
4,25
|
4,78
|
10,36
|
0,56
|
8
|
3,34
|
3,79
|
4,24
|
5,8
|
1,62
|
21
|
3,94
|
4,66
|
5,38
|
4,98
|
0,95
|
9
|
2,74
|
3,13
|
3,52
|
11,4
|
0,93
|
22
|
2,86
|
3,56
|
4,26
|
21,85
|
1,22
|
10
|
2,51
|
2,71
|
2,91
|
4,9
|
0,84
|
23
|
4,41
|
5,52
|
6,63
|
10,64
|
1,12
|
11
|
3,17
|
3,43
|
3,69
|
10,84
|
1,08
|
24
|
2,27
|
2,92
|
3,57
|
8,18
|
3,77
|
12
|
3,35
|
3,74
|
4,13
|
15,8
|
2,02
|
25
|
2,31
|
2,94
|
3,57
|
15,88
|
2,03
|
13
|
4,59
|
5,28
|
5,97
|
9,15
|
1,47
|
26
|
2,14
|
2,66
|
3,19
|
7,3
|
2,04
|
Задание 3. Дана схема реакции (см. в табл. 2):
определите степень окисления атомов элементов, меняющих ее в процессе реакции;
составьте электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов, укажите процессы окисления и восстановления;
запишите множители в уравнение окислительно - восстановительной реакции как основные стехиометрические коэффициенты;
подберите стехиометрические коэффициенты остальных участников реакции;
выпишите формулы вещества – окислителя и восстановителя и рассчитайте их молярные массы эквивалентов.
Т а б л и ц а 2
Номер варианта
|
Схема реакции
|
1
|
KI + KIO3 + H2SO4 I2 + K2SO4 + H2O
|
2
|
SnCl2 + K2Cr2O7 + HCl SnCl4 + CrCl3 + KCl + H2O
|
3
|
CuS + HNO3 Cu(NO3)2 + NO2 + H2SO4 + H2O
|
4
|
KMnO4 + HCl MnCl2 + Cl2 + KCl + H2O
|
5
|
HNO2 + KMnO4 + H2SO4 HNO3 + MnSO4 + K2SO4 + H2O
|
6
|
K2Cr2O7 + HBr CrBr3 + Br2 + KBr + H2O
|
7
|
H2S + Cl2 + H2O H2SO4 + HCl
|
8
|
I2 + HNO3 HIO5 + NO + H2O
|
9
|
HNO3 + Zn Zn(NO3)2 + N2O + H2O
|
10
|
FeS + HNO3 Fe(NO3)2 + S + NO + H2O
|
11
|
Cr2O3 + KClO3 + KOH K2CrO4 + KCl + H2O
|
12
|
K2Cr2O7 + KI + H2SO4 Cr2(SO4)3 + I2 + K2SO4 + H2O
|
13
|
FeCl2 + HNO3 + HCl FeCl3 + NO + H2O
|
14
|
H2SO3 + HNO3 H2SO4 + NO + H2O
|
15
|
K2Cr2O7 + SO2 + HCl CrCl3 + KCl + H2SO4 + H2O
|
16
|
Cl2 + Br2 + KOH KCl + KBrO3 + H2O
|
17
|
K2Cr2O7 + H2O2 + H2SO4 O2 + Cr2(SO4)3 + H2O + K2SO4
|
18
|
NaIO3 + CO + H2SO4 I2 + CO2 + Na2SO4 + H2O
|
19
|
H2S + HClO3 H2SO4 + HCl
|
О к о н ч а н и е т а б л. 2
20
|
KCl + KMnO4 + H2SO4 Cl2 + MnSO4 + K2SO4 + H2O
|
21
|
FeSO4 + KClO3 + H2SO4 Fe2(SO4)3 + KCl + H2O
|
22
|
Cr2(SO4)3 + Br2 + NaOHNa2CrO4 + NaBr + Na2SO4 + H2O
|
23
|
MnSO4 + KMnO4 + H2O MnO2 + H2SO4 + K2SO4
|
24
|
Sn + HNO3 Sn(NO3)2 + N2 + H2O
|
25
|
Ca + HNO3 Ca(NO3)2 + NH4NO3 + H2O
|
Т е м а 2.
Строение вещества
Задание. Для элементов, атомы которых образуют молекулу (см. вариант в табл. 3):
напишите электронные формулы, подчеркните валентные электроны и определите семейство;
укажите значения квантовых чисел для валентных электронов;
распределите валентные электроны по энергетическим ячейкам и определите валентность в основном (невозбужденном) и возбужденном состояниях;
объясните связь электронного строения атома элементов с их положением в периодической системе (период, группа, подгруппа);
Т а б л и ц а 3
-
Номер
варианта
|
Формула
вещества
|
Номер
варианта
|
Формула
вещества
|
Номер
варианта
|
Формула
вещества
|
1
|
CF4
|
10
|
AlCl3
|
19
|
BrF3
|
2
|
CCl4
|
11
|
GaCl3
|
20
|
BeCl2
|
3
|
NF3
|
12
|
SBr6
|
21
|
CS2
|
4
|
SiCl4
|
13
|
SiBr4
|
22
|
SnCl2
|
5
|
PI3
|
14
|
SbBr3
|
23
|
ScBr3
|
6
|
AsCl3
|
15
|
HgCl2
|
24
|
AsF5
|
7
|
PCl3
|
16
|
PCl5
|
25
|
CdF2
|
8
|
SeF4
|
17
|
SF6
|
26
|
SCl6
|
9
|
PbCl2
|
18
|
InI3
|
27
|
BF3
|
определите степени окисления элементов в молекуле;
составьте электронные формулы для атомов элементов с данной степенью окисления и охарактеризуйте их окислительно-восстановительные свойства;
охарактеризуйте химические свойства элементов, заполнив таблицу:
Элемент
|
Формула
оксида
|
Формула
гидроксида
|
Формула
водородного
соединения
|
|
|
|
|
|
|
|
|
Химический характер
|
|
|
|
Т е м а 3
Основные закономерности протекания
химических процессов
|
 Скачать 1.17 Mb.
Скачать 1.17 Mb.