Задание. Дано уравнение реакции (см. вариант в табл. 4).
Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин 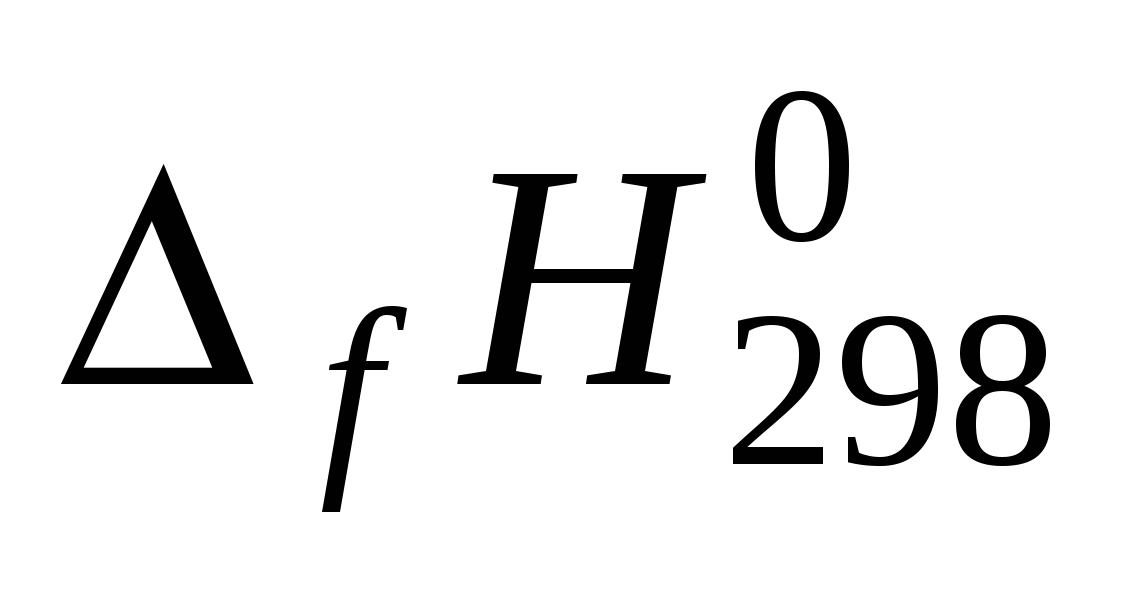 и и 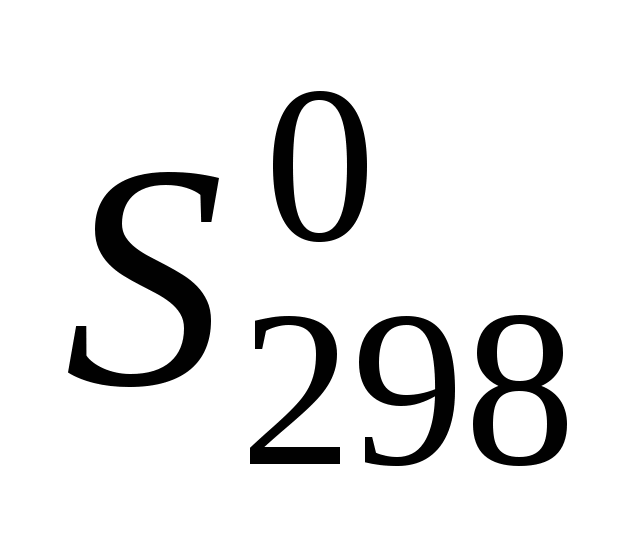 . .
Вычислите изменение энтальпии реакции 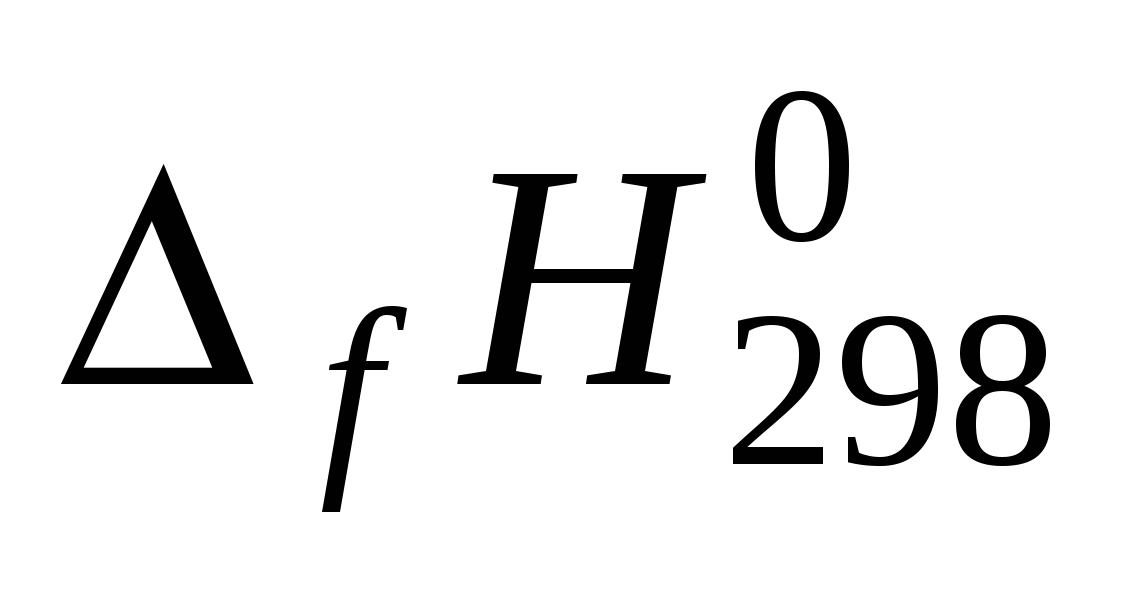 и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции. и определите, является ли данная реакция экзо- или эндотермической. Запишите термохимическое уравнение реакции.
По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции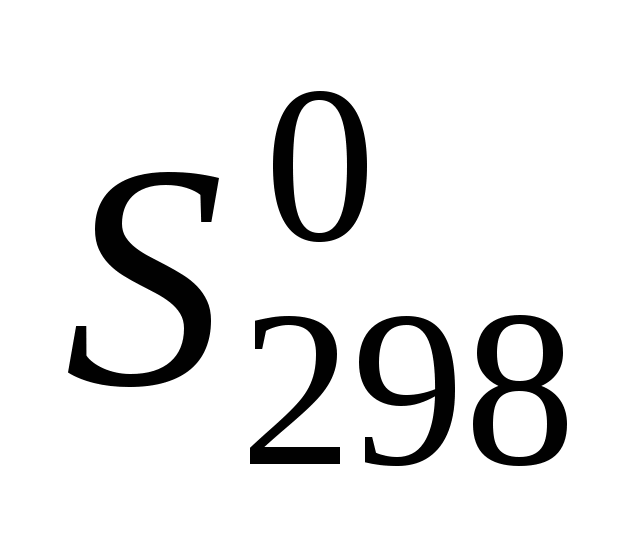 . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак . Вычислив изменение энтропии реакции в стандартных условиях, объясните знак 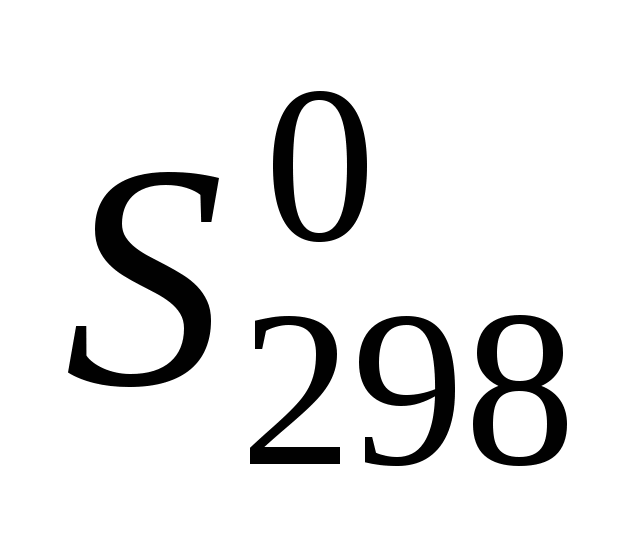 . .
Вычислите энергию Гиббса прямой реакции в стандартных условиях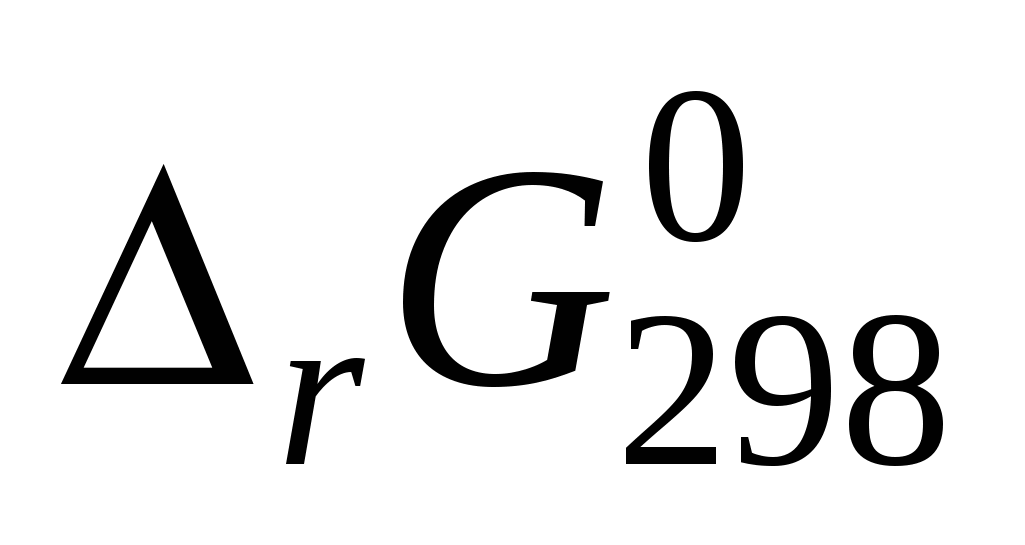 и установите возможность самопроизвольного протекания реакции. и установите возможность самопроизвольного протекания реакции.
Определите температуру, при которой реакция находится в равновесии (Тр).
Рассчитайте 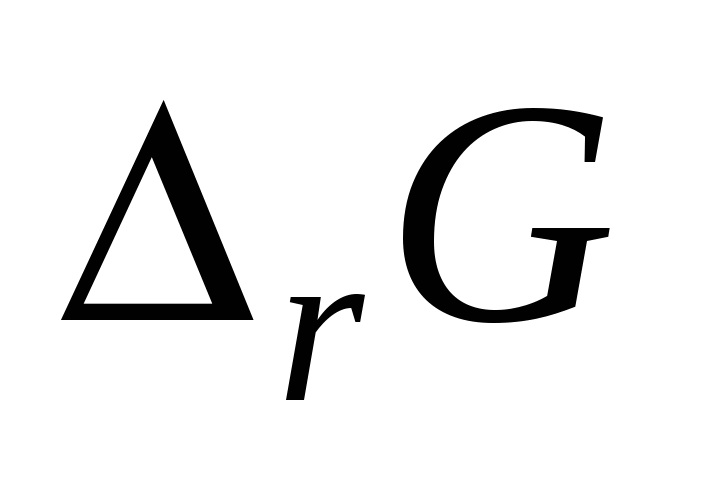 при Т1 = Тр–100, Т2 = Тр+100. при Т1 = Тр–100, Т2 = Тр+100.
Постройте график зависимости 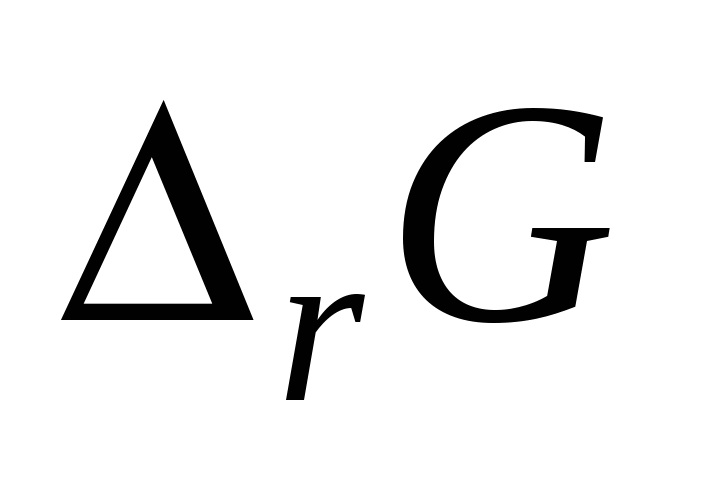 от Т и обозначьте на графике область температур самопроизвольного протекания реакции. от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
Вычислите значения константы равновесия Кc при температурах Тр, Т1 и Т2. Cделайте вывод о влиянии температуры на величину Кc и на смещение химического равновесия.
Т е м а 4
Кинетика химических процессов
и химическое равновесие
Задание 1. Дано уравнение реакции (см. вариант в табл. 4).
Запишите кинетические уравнения скоростей прямой 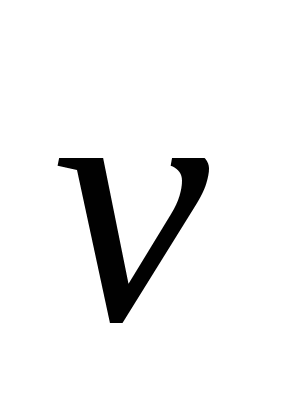 и обратной и обратной 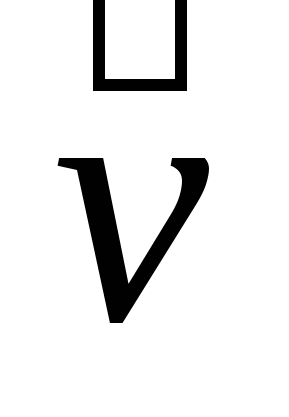 реакций. Гомо- или гетерогенной является данная реакция? реакций. Гомо- или гетерогенной является данная реакция?
Рассчитайте скорость прямой реакции 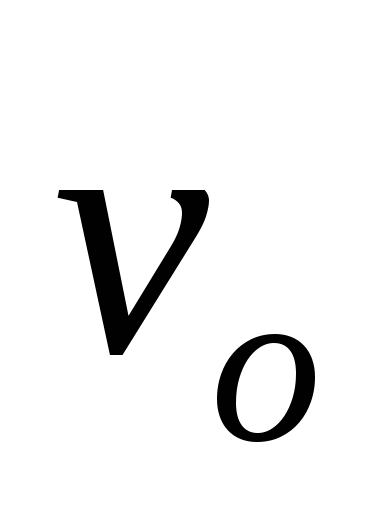 в начальный момент времени (при Со). Как изменится скорость прямой реакции к моменту времени в начальный момент времени (при Со). Как изменится скорость прямой реакции к моменту времени 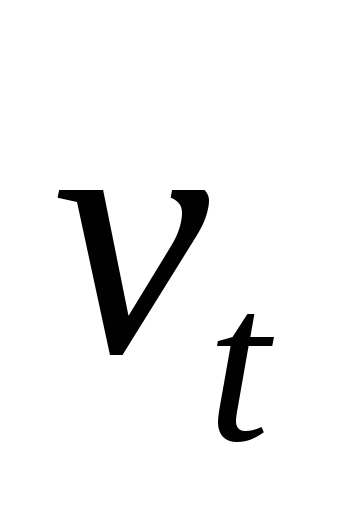 , когда прореагирует 20 % вещества В? , когда прореагирует 20 % вещества В?
Рассчитайте увеличение скорости прямой реакции  при одновременном повышении давления в системе в 2 раза и температуры при одновременном повышении давления в системе в 2 раза и температуры 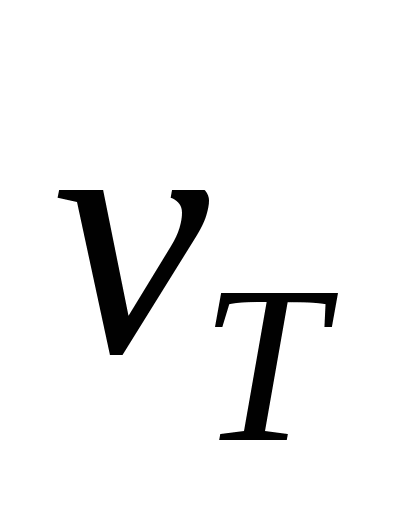 на 20 С при = 2. на 20 С при = 2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4).
Запишите выражение для константы равновесия химической реакции через концентрации Кс.
Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия.
Укажите направление смещения равновесия при изменении каждого из факторов (С, Р, V и Т).
Т а б л и ц а 4
Номер варианта
|
Задание 1, 2
|
Изменение внешних условий
|
аА + bВ cC + dD
|
Cо(А),
моль/л
|
Cо(В),
моль/л
|
Сисх
|
Р
|
V
|
Т
|
1
|
CН4(г) + Н2О(г) = CO(г) + 3 Н2(г)
|
1
|
2
|
↑
|
↓
|
↓
|
↓
|
2
|
СS2(г) + 4 Н2(г) = CH4(г) + 2 Н2S(г)
|
0,2
|
0,8
|
↑
|
↑
|
↑
|
↓
|
3
|
CO2(г) + 2 H2(г) = C(т) + 2 Н2О(г)
|
0,8
|
1,5
|
↓
|
↓
|
↑
|
↑
|
4
|
2 NF3(г) + O2(г) = 2 NOF3(г)
|
2
|
2
|
↑
|
↑
|
↓
|
↓
|
5
|
СО2(г) + 4 Н2 = СН4(г) + 2 Н2О(г)
|
0,5
|
2
|
↑
|
↑
|
↓
|
↓
|
6
|
2 PCl5(г) + О2 = 2 POCl3(г) + 2 Сl2(г)
|
0,3
|
1,5
|
↓
|
↓
|
↑
|
↑
|
7
|
2 AsCl3(г) + 3 H2(г) = 2 As(г) + 6 НCl(г)
|
0,2
|
0,6
|
↑
|
↑
|
↓
|
↓
|
8
|
2 СН3ОН(г) + 3 О2 = 2 СО2(г) + 4 Н2О(г)
|
3
|
3
|
↓
|
↓
|
↑
|
↑
|
9
|
2 NO2(г) + F2(г) = 2 (NO2)F(г)
|
3
|
2
|
↓
|
↓
|
↑
|
↑
|
10
|
О2(г) + 2 Н2S(г) = 2 S(т) + 2 Н2О(г)
|
2
|
3
|
↑
|
↑
|
↓
|
↓
|
11
|
2 PF3(г) + О2(г) = 2 POF3(г)
|
2
|
3
|
↓
|
↓
|
↑
|
↑
|
12
|
S2(г) + 4 CO2(г) = 2 SO2(г) + 4 CO(г)
|
1
|
2
|
↑
|
↑
|
↓
|
↓
|
О к о н ч а н и е т а б л. 4
Номер варианта
|
Задание 1, 2
|
Изменение внешних условий
|
аА + bВ cC + dD
|
Cо(А),
моль/л
|
Cо(В),
моль/л
|
Сисх
|
Р
|
V
|
Т
|
13
|
2 NO(г) + 2 SO2(г) = N2(г) + 2 SO3(г)
|
0,2
|
0,4
|
↑
|
↑
|
↑
|
↑
|
14
|
2 CO(г) + 2 H2 = CH4(г) + CО2(г)
|
3
|
1
|
↓
|
↓
|
↑
|
↑
|
15
|
2 H2S(г) + SO2(г) = 3 S(т) + 2 H2O(г)
|
2
|
1
|
↓
|
↓
|
↓
|
↓
|
16
|
2 PCl3(г) + O2(г) = 2 PCl3O(г)
|
3
|
1
|
↑
|
↑
|
↑
|
↑
|
17
|
SiCl4(г) + 2 Н2(г) = Si(т) + 4 HCl(г)
|
2
|
3
|
↓
|
↓
|
↓
|
↓
|
18
|
2 NO(г) + Cl2(г) = 2 NOCl(г)
|
3
|
2
|
↑
|
↑
|
↑
|
↓
|
19
|
SО2(г) + 2 Н2S(г) = 3 S(т) + 2 H2O(ж)
|
2
|
4
|
↓
|
↑
|
↑
|
↓
|
20
|
CCl4(г) + 2 Н2(г) CН4(г) + 2 Cl2(г)
|
1
|
3
|
↑
|
↓
|
↑
|
↑
|
21
|
2 H2О (г) + 2 Cl2(г) = 4 НCl (г) + O2(г)
|
3
|
2
|
↑
|
↓
|
↓
|
↑
|
22
|
2 BCl3(г) + 3 Н2(г) = 2 В(т) + 6 HCl(г)
|
3
|
3
|
↓
|
↑
|
↓
|
↑
|
23
|
CS2(г) + 2 Сl2(г) = CCl4(г) + 2 S(т)
|
1
|
1
|
↑
|
↓
|
↑
|
↑
|
24
|
2 H2S(г) + 3 О2 = 2 Н2О(г) + 2 SO2(г)
|
0,3
|
0,9
|
↑
|
↑
|
↓
|
↑
|
25
|
2 NO(г) + 2 H2(г) = N2(г) + 2 H2O(г)
|
3
|
2
|
↓
|
↑
|
↑
|
↓
|
Т е м а 5
Растворы электролитов
Задание 1. Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5).
Определите молярную концентрацию вещества (С), молярную концентрацию эквивалентов вещества (Сэк), массовую долю растворенного вещества (ω, %) в растворе и титр раствора (Т).
Таблица 5
-
Номер
варианта
|
Вещество
|
ρ,
г/мл
|
Концентрация
|
Сэк, моль/л
|
ω, %
|
С, моль/л
|
1
|
AlCl3
|
1,016
|
|
2
|
|
2
|
AgNO3
|
1,194
|
1,4
|
|
|
3
|
CaСl2
|
1,032
|
|
4
|
|
4
|
Cu(NO3)2
|
1,036
|
|
|
0,22
|
5
|
Fe2(SO4)3
|
1,181
|
|
20
|
|
6
|
MnCl2
|
1,068
|
|
8
|
|
7
|
Zn(NO3)2
|
1,067
|
0,9
|
|
|
8
|
NiSO4
|
1,21
|
2,8
|
|
|
9
|
ZnSO4
|
1,084
|
1,3
|
|
|
10
|
H2SO4
|
1,038
|
|
6
|
|
11
|
(NH4)2SO4
|
1,115
|
|
20
|
|
12
|
Al2(SO4)3
|
1,105
|
1,3
|
|
|
13
|
Na2CO3
|
1,05
|
|
5
|
|
14
|
K2SO4
|
1,056
|
|
7
|
|
15
|
H3PO4
|
1,150
|
|
|
3,0
|
16
|
Co(NO3)2
|
1,015
|
|
|
0,11
|
17
|
Mg(NO3)2
|
1,044
|
|
6
|
|
18
|
Na2SO4
|
1,053
|
|
6
|
|
19
|
Ba(NO3)2
|
1,015
|
0,5
|
|
|
Окончание табл. 5
-
Номер
варианта
|
Вещество
|
ρ,
г/мл
|
Концентрация
|
Сэк, моль/л
|
ω, %
|
С, моль/л
|
20
|
FeCl3
|
1,032
|
|
4
|
|
21
|
MnSO4
|
1,059
|
|
6
|
|
22
|
Na2CO3
|
1,013
|
|
2
|
|
23
|
ZnCl2
|
1,035
|
0,6
|
|
|
24
|
MgSO4
|
1,27
|
|
|
2,54
|
25
|
CoSO4
|
1,08
|
|
8
|
|
Задание 2. Сколько миллилитров раствора А с заданной массовой долей (%) и плотностью (г/мл) потребуется для нейтрализации раствора В, содержащего определенную массу т растворенного вещества (см. табл. 6)
Т а б л и ц а 6
Номер варианта
|
Раствор А
|
Раствор В
|
Формула вещества
|
, %
|
, г/мл
|
Формула вещества
|
m, г
|
1
|
H2SO4
|
4
|
1,025
|
КОН
|
1,4
|
2
|
HCl
|
1,36
|
1,005
|
Ва(ОН)2
|
1,71
|
3
|
HNO3
|
4
|
1,02
|
Са(ОН)2
|
0,74
|
4
|
Н3РО4
|
6
|
1,031
|
КОН
|
0,7
|
5
|
HCl
|
2
|
1,008
|
Sr(OH)2
|
0,61
|
6
|
КОН
|
1,3
|
1,01
|
H2SO4
|
0,49
|
7
|
H2SO4
|
5,5
|
1,034
|
NaOH
|
0,4
|
8
|
NaOH
|
4,2
|
1,045
|
H2SO4
|
0,98
|
9
|
КОН
|
8,9
|
1,079
|
H2SO4
|
0,98
|
10
|
Н3РО4
|
6
|
1,031
|
NaОН
|
0,8
|
11
|
КОН
|
7,8
|
1,068
|
Н3РО4
|
0,33
|
Окончание табл. 6
Номер варианта
|
Раствор А
|
Раствор В
|
Формула вещества
|
, %
|
, г/мл
|
Формула вещества
|
m, г
|
12
|
NaOH
|
6
|
1,065
|
Н3РО4
|
0,98
|
13
|
NH4OH
|
10,4
|
0,956
|
H2SO4
|
1,47
|
14
|
NaOH
|
11
|
1,12
|
H2SO4
|
2,94
|
15
|
Н3РО4
|
6
|
1,031
|
NH4ОН
|
0,7
|
16
|
H2SO4
|
2,5
|
1,016
|
NaОН
|
0,4
|
17
|
Н3РО4
|
2,15
|
1,01
|
NaОН
|
0,2
|
18
|
HNO3
|
4
|
1,02
|
Ba(OH)2
|
5,13
|
19
|
Н3РО4
|
4
|
1,02
|
LiОН
|
4,8
|
20
|
Н2SО4
|
2,5
|
1,016
|
Ca(ОН)2
|
0,37
|
21
|
HCl
|
4,4
|
1,02
|
Sr(OH)2
|
0,61
|
22
|
H2SO4
|
4
|
1,025
|
Ba(OH)2
|
0,71
|
23
|
Н3РО4
|
4
|
1,02
|
Ca(ОH)2
|
1,11
|
24
|
H2SO4
|
5,5
|
1,034
|
LiOH
|
0,24
|
25
|
Н3РО4
|
4
|
1,02
|
KОН
|
1,68
|
Задание 3. Имеется раствор слабого электролита (см. вариант в табл. 7).
Запишите уравнения диссоциации и выражения для констант диссоциации (Кд) по всем возможным ступеням, укажите их величины (см. приложение 2).
Рассчитайте степень диссоциации слабого электролита, концентрацию ионов H+ в растворе и рН данного раствора с заданной концентрацией электролита.
Задание 4. Имеется насыщенный раствор труднорастворимого электролита (см. вариант в табл. 7). Вычислите растворимость данного электролита (в моль/л и г/л) в одном литре воды, используя значение произведения растворимости (см. приложение 3).
Задание 5. Имеется раствор соли (см. вариант в табл. 7).
Напишите молекулярное и ионно-молекулярное уравнения реакции гидролиза и выражение для константы гидролиза по I ступени (КгI).
Рассчитайте степень гидролиза (г) и рН раствора соли с заданной концентрацией, учитывая только 1-ую ступень гидролиза.
Какой цвет будет иметь индикатор метиловый оранжевый или фенолфталеин в растворе данной соли?
Как изменяться рН раствора соли и окраска индикатора при нагревании и почему?
Таблица 7
Номер
варианта
|
Задание 3
|
Задание 4
|
Задание 5
|
Вещество
|
С, моль/л
|
Вещество
|
Вещество
|
С, моль/л
|
1
|
HCN
|
0,01
|
Mg(OH)2
|
CdSO4
|
0,02
|
2
|
НNO2
|
0,05
|
Fe(OH)2
|
Al(NO3)3
|
0,02
|
3
|
HOCl
|
0,01
|
Be(OH)2
|
K2Se
|
0,03
|
4
|
H2GeO3
|
0,02
|
Bi(OH)3
|
Ba(NO2)2
|
0,04
|
5
|
HF
|
0,1
|
Ga(OH)3
|
CoCl2
|
0,05
|
6
|
HOBr
|
0,05
|
Cd(OH)2
|
K2TeO4
|
0,02
|
7
|
HOI
|
0,1
|
Co(OH)2
|
Na3BO3
|
0,01
|
8
|
Н2ТеО3
|
0,5
|
Cr(OH)2
|
Na2C2O4
|
0,02
|
9
|
H2С2O4
|
0,05
|
Cu(OH)2
|
FeCl2
|
0,05
|
10
|
H2SeO3
|
0,02
|
Ni(OH)2
|
FeBr3
|
0,01
|
11
|
Н2ТеО3
|
0,01
|
Pb(OH)2
|
NiSO4
|
0,05
|
12
|
HOCl
|
0,05
|
Sc(OH)3
|
Na2Te
|
0,01
|
13
|
H3BO3
|
0,01
|
Mn(OH)2
|
K2SiO3
|
0,01
|
14
|
H2S
|
0,05
|
Pd(OH)2
|
MnSO4
|
0,02
|
15
|
H2Se
|
0,02
|
La(OH)3
|
Na3AsO4
|
0,05
|
16
|
H2SO3
|
0,01
|
Sn(OH)2
|
K2GeO3
|
0,01
|
17
|
НNO2
|
0,02
|
Fe(OH)2
|
Cr(NO3)3
|
0,02
|
Номер
варианта
|
Задание 3
|
Задание 4
|
Задание 5
|
Вещество
|
С, моль/л
|
Вещество
|
Вещество
|
С, моль/л
|
18
|
H2TeO4
|
0,01
|
Mg(OH)2
|
ZnBr2
|
0,05
|
19
|
HCN
|
0,02
|
Be(OH)2
|
SnCl2
|
0,02
|
20
|
НNO2
|
0,1
|
Bi(OH)3
|
Na3PO3
|
0,01
|
21
|
H2SiO3
|
0,05
|
Ga(OH)3
|
K2TeO3
|
0,01
|
22
|
H2S
|
0,02
|
Sc(OH)3
|
Na2SeO3
|
0,05
|
23
|
H2Se
|
0,05
|
Zn(OH)2
|
CrCl2
|
0,02
|
24
|
H3AsO4
|
0,02
|
Al(OH)3
|
Pb(NO3)2
|
0,05
|
25
|
HCOOH
|
0,01
|
Со(OH)3
|
Са3(VO4)2
|
0,01
|
Т е м а 6
Коллоидные растворы
Задание. Даны растворы двух реагентов (см. вариант в табл. 8).
Напишите молекулярное уравнение химической реакции образования коллоидной частицы при смешивании двух растворов.
Определите, какой реагент взят в избытке.
Составьте формулу мицеллы, обозначьте и назовите ее составные части.
Определите заряд коллоидной частицы и укажите, к какому электроду будут перемещаться частицы золя в постоянном электрическом поле.
Какой из указанных электролитов будет обладать наилучшим коагулирующим действием. Объясните, почему?
Т а б л и ц а 8
Номер
варианта
|
Раствор I
|
Раствор II
|
Электролиты, вызывающие коагуляцию
|
Вещество
|
С, моль/л
|
V, мл
|
Вещество
|
С, моль/л
|
V, мл
|
1
|
Sr(NO3)2
|
0,05
|
20
|
Na2SO4
|
0,01
|
20
|
KCl, ZnSO4, Na3PO4
|
2
|
Pb(NO3)2
|
0,1
|
100
|
KCl
|
0,1
|
200
|
K3PO4, CaCl2, Al2(SO4)3
|
3
|
FeCl2
|
0,001
|
50
|
Na2S
|
0,002
|
50
|
Na3PO4, Ca(NO3)2, Fe2(SO4)3
|
4
|
BaCl2
|
0,01
|
100
|
K3PO4
|
0,02
|
100
|
Na3PO4, Ca(NO3)2, Fe2(SO4)3
|
5
|
Na2CO3
|
0,5
|
50
|
Ni(NO3)2
|
0,1
|
50
|
K3PO4, CaCl2, Al2(SO4)3
|
6
|
CdCl2
|
0,02
|
50
|
KOH
|
0,01
|
50
|
K3PO4, CaCl2, Fe2(SO4)3
|
7
|
Ni(NO3)2
|
0,02
|
100
|
K2S
|
0,02
|
50
|
AlCl3, FeSO4, K3PO4
|
8
|
Mg(NO3)2
|
0,5
|
20
|
NaF
|
0,1
|
20
|
FeCl3, ZnSO4, Na3PO4
|
9
|
AlCl3
|
0,01
|
50
|
K3PO4
|
0,05
|
50
|
ZnCl2, K3PO4, Fe2(SO4)3
|
10
|
Ca(NO3)2
|
0,2
|
25
|
K2CO3
|
0,1
|
25
|
AlCl3, CuSO4, K3PO4
|
11
|
SnCl2
|
0,05
|
50
|
KOH
|
0,01
|
5
|
K3PO4, CaCl2, Al2(SO4)3
|
12
|
ZnSO4
|
0,001
|
100
|
K2SiO3
|
0,01
|
100
|
Bi(NO3)3 , CuSO4, K3PO4
|
13
|
Bi(NO3)3
|
0,02
|
20
|
K2S
|
0,002
|
20
|
Na3PO4, ZnCl2, Al2(SO4)3
|
14
|
MnCl2
|
0,05
|
50
|
NaOH
|
0,05
|
5
|
K3PO4, CaCl2, Al2(SO4)3
|
15
|
(NH4)2SO4
|
0,05
|
20
|
AgNO3
|
0,01
|
20
|
KI, Na3PO4, Al2(SO4)3
|
О к о н ч а н и е т а б л. 8
Номер
варианта
|
Раствор I
|
Раствор II
|
Электролиты, вызывающие коагуляцию
|
Вещество
|
Сэк, моль/л
|
V, мл
|
Вещество
|
Сэк, моль/л
|
V, мл
|
16
|
CuSO4
|
0,02
|
50
|
K2S
|
0,01
|
50
|
CaBr2, K3PO4, Al2(SO4)3
|
17
|
Hg(NO3)2
|
0,005
|
10
|
K3PO4
|
0,05
|
10
|
NiSO4, K3PO4, Al(NO3)3
|
18
|
CoCl2
|
0,05
|
250
|
K2S
|
0,1
|
50
|
K3PO4, Na2HPO4 , ZnSO4
|
19
|
Fe(NO3)2
|
0,1
|
50
|
Na2CO3
|
0,5
|
50
|
FeSO4, Na3PO4, Al(NO3)3
|
20
|
CrCl3
|
0,025
|
20
|
K3PO4
|
0,25
|
20
|
Fe2(SO4)3 , Li3PO4, Cu(NO3)2
|
21
|
Sr(NO3)2
|
0,01
|
20
|
Na2SO4
|
0,1
|
20
|
NaCl, ZnSO4, Na3PO4
|
22
|
Pb(NO3)2
|
0,1
|
100
|
KCl
|
0,01
|
100
|
K3PO4, CaCl2, Al2(SO4)3
|
23
|
FeCl2
|
0,02
|
250
|
Na2S
|
0,01
|
250
|
Na3PO4, Zn(NO3)2, Fe2(SO4)3
|
24
|
BaCl2
|
0,02
|
100
|
K3PO4
|
0,01
|
100
|
Na3PO4, Ca(NO3)2, Fe2(SO4)3
|
25
|
Na2CO3
|
0,01
|
50
|
Ni(NO3)2
|
0,05
|
50
|
K3PO4, CaCl2, Al2(SO4)3
|
26
|
MnCl2
|
0,01
|
50
|
Na2S
|
0,05
|
50
|
K3PO4, CaCl2, Al2(SO4)3
|
27
|
Ni(NO3)2
|
0,01
|
20
|
K2S
|
0,02
|
20
|
FeCl3, CuSO4, K3PO4
|
28
|
Mg(NO3)2
|
0,01
|
20
|
NaF
|
0,05
|
20
|
Al2(SO4)3, ZnCl2, Na3PO4
|
29
|
AlCl3
|
0,05
|
200
|
K3PO4
|
0,01
|
200
|
ZnCl2, K3PO4, Fe2(SO4)3
|
30
|
Ca(NO3)2
|
0,01
|
50
|
K2CO3
|
0,02
|
50
|
AlCl3, CuSO4, K3PO4
|
Т е м а 7
Общие свойства растворов
Задание. Рассчитайте температуру кипения и замерзания раствора, состав которого представлен в таблице 9.
Температуры кипения, кристаллизации, криоскопическая и эбуллиоскопическая постоянные чистых растворителей приведены в приложении 4.
Т а б л и ц а 9
Номер
варианта
|
Растворитель
|
Растворенное вещество
|
Вещество
|
масса, г
|
Вещество
|
масса, г
|
1
|
Этанол
С2Н5ОН
|
500
|
Сахароза
С12Н22О11
|
30
|
2
|
Вода
Н2О
|
500
|
Мочевина
(NH2)2СО
|
20
|
3
|
Уксусная кислота
СН3СООН
|
100
|
Антрацен
С14Н10
|
4,25
|
4
|
Хлороформ
СНCl3
|
500
|
Пропеновая кислота
С3Н4О2
|
7,2
|
5
|
Этанол
С2Н5ОН
|
200
|
Антраниловая
кислота
NH2C6H4COOH
|
4,0
|
6
|
Бензол
С6Н6
|
250
|
Камфора
С10Н16О
|
7,55
|
7
|
Хлороформ
СНCl3
|
250
|
Нафталин
С10Н8
|
2,35
|
8
|
Вода
Н2О
|
200
|
Глицерин
С3Н5(ОН)3
|
11
|
9
|
Этанол
С2Н5ОН
|
250
|
Салициловая
кислота С7Н6О3
|
11
|
10
|
Сероуглерод
СS2
|
100
|
Бензойная кислота С6Н5СООН
|
2,5
|
11
|
Вода
Н2О
|
250
|
Этиленгликоль
(СН2)2(ОН)2
|
12,5
|
12
|
Циклогексан
С6Н12
|
50
|
Пиррол
С4Н5N
|
0,25
|
О к о н ч а н и е т а б л. 9
Номер
варианта
|
Растворитель
|
Растворенное вещество
|
Вещество
|
масса, г
|
Вещество
|
масса, г
|
13
|
Бензол
С6Н6
|
150
|
Cера
S
|
0,75
|
14
|
Диэтиловый эфир
(С2Н5)2О
|
50
|
Анилин
C6H5NH2
|
0,7
|
15
|
Вода
Н2О
|
250
|
Глюкоза
С6Н12О6
|
20
|
16
|
Бензол
С6Н6
|
50
|
Фенол
С6Н6О
|
0,9
|
17
|
Вода
Н2О
|
500
|
Метанол
СН3ОН
|
16
|
18
|
Вода
Н2О
|
100
|
Сахароза
С12Н22О11
|
17,1
|
19
|
Бензол
С6Н6
|
200
|
Трихлоруксусная кислота
ССl3СООН
|
4,95
|
20
|
Уксусная кислота
СН3СООН
|
200
|
Ацетон
(СН3)2СО
|
2,8
|
21
|
Ацетон
(СН3)2СО
|
400
|
Глицерин
С3Н5(ОН)3
|
9,2
|
22
|
Вода
Н2О
|
100
|
Глюкоза
С6Н12О6
|
4,84
|
23
|
Четыреххлористый
углерод
CCl4
|
100
|
Аспирин
С9Н8О4
|
1,45
|
24
|
Уксусная
кислота
СН3СООН
|
50
|
Антрацен
С14Н10
|
1,8
|
25
|
Этанол
С2Н5ОН
|
50
|
Мочевина
(NH2)2СО
|
1,25
|
Т е м а 8
Комплексные соединения
Задание 1. Дано комплексное соединение (см. вариант в табл. 10).
Укажите: а) внутреннюю и внешнюю сферы, их заряды; б) комплексообразователь, его координационное число и заряд; в) лиганды и их заряд.
Для иона комплексообразователя напишите электронную формулу;
Напишите уравнения диссоциации комплексного соединения в водном растворе и выражение константы нестойкости комплексного иона.
Т а б л и ц а 10
-
Номер варианта
|
Вещество
|
Номер варианта
|
Вещество
|
1
|
[Cr(NH3)2(H2O)4]Cl3
|
14
|
[Co(NH3)5Br]SO4
|
2
|
K2[Pt(NH3)2(NO2)4]
|
15
|
[Pt(NH3)3Cl]Cl
|
3
|
Na[Co(NO2)4(NH3)2]
|
16
|
Mg[Be(OH)F3]
|
4
|
K2[Pt(OH)3Cl]
|
17
|
[Fe(NH3)5Cl]SO4
|
5
|
Na[Pt(NH3)Cl3]
|
18
|
Na2[Sb(H2O)Cl5]
|
6
|
[Ni(NH3)6]Br2
|
19
|
[Zn(NH3)3H2O](NO3)2
|
7
|
[Hg(NH3)4](NO3)2
|
20
|
K4[Ni(CN)4Cl2]
|
8
|
Na[Co(NH3)2(CN)4]
|
21
|
Na[Co(CN)4(H2O)2]
|
9
|
(NH4)2[Ni(CN)4]
|
22
|
Ba[Cu(CN)2Cl2]
|
10
|
Ва[Fe(CN)5(H2O)]
|
23
|
[Sn(OH)2(H2O)4]Cl2
|
11
|
[Co(NH3)4SO4]NO3
|
24
|
K2[Cd(CN)2SO4]
|
12
|
(NH4)2[Pt(OH)2Cl4]
|
25
|
Ca2[Fe(CN)4(OH)2]
|
13
|
Ba[Cr(NH3)2Cl4]
|
26
|
K2[Co(NH3)5Br]
|
Задание 2. Дано комплексное соединение (см. вариант в табл. 11).
Запишите первичную и вторичную диссоциацию комплексного соединения в водном растворе, выражение константы нестойкости комплексного иона и ее численное значение (см. приложение 5).
Вычислите концентрации ионов комплексообразователя, лигандов и ионов внешней сферы в растворе комплексной соли с заданной концентрацией (С).
Численные значения констант нестойкости комплексных ионов приведены в приложении 5.
Т а б л и ц а 11
Номер
варианта
|
Вещество
|
С,
моль/л
|
Номер
варианта
|
Вещество
|
С,
моль/л
|
1
|
K2[HgI4]
|
0,03
|
14
|
(NH4)2[Ni(CN)4]
|
0,02
|
2
|
[Cd(NH3)4]SO4
|
0,02
|
15
|
K2[Zn(CN)4]
|
0,2
|
3
|
K2[Cu(OH)4]
|
0,05
|
16
|
[Zn(NH3)4]SO4
|
0,01
|
4
|
K3[AgI4]
|
0,01
|
17
|
K2[Cu(CN)4]
|
0,1
|
5
|
K2[Be(OH)4]
|
0,1
|
18
|
Na[AuCl4]
|
0,01
|
6
|
Na2[HgBr4]
|
0,01
|
19
|
[Hg(NH3)4](NO3)2
|
0,5
|
7
|
Na2[PtCl4]
|
0,01
|
20
|
[Cu(NH3)2]Cl
|
0,02
|
8
|
K[Sb(OH)4]
|
0,1
|
21
|
Na[Ag(NO2)2]
|
0,01
|
9
|
K2[Cu(SCN)4]
|
0,5
|
22
|
K2[CdI4]
|
0,3
|
10
|
Na2[Hg(NO2)4]
|
0,02
|
23
|
K2[BeF4]
|
0,1
|
11
|
Na[In(OH)4]
|
0,01
|
24
|
(NH4)3[Ag(SCN)4]
|
0,03
|
12
|
K2[PtBr4]
|
0,1
|
25
|
(NH4)2[PdBr4]
|
0,05
|
13
|
Na2[Cd(CN)4]
|
0,05
|
26
|
Li3[Cr(SCN)6]
|
0,05
|
Тема 9
Электрохимические процессы
|
 Скачать 1.17 Mb.
Скачать 1.17 Mb.