дз. Коррозия металлов Коррозия
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
Коррозия металлов Коррозия - самопроизвольное и необратимое разрушение металла под действием компонентов окружающей среды - окислителей. В результате коррозии металл – окисляется, теряет электроны, переходит в форму соединения, а окислители из окружающей среды восстанавливаются, забирают электроны у металла: nM + mOx → MnRedm (1) Коррозия - процесс самопроизвольный, то есть Для большинства металлов ΔfG0 < 0. В природе металлы встречаются в основном в виде соединений. Процесс получения металлов из соединений, наоборот, вынужденный, требует затраты энергии. Убытки от коррозии - миллиарды рублей ежегодно (разрушение трубопроводов, цистерн, машин, корпусов судов, морских сооружений и т. п.; безвозвратные потери металлов более 15% от их производства; косвенные убытки часто превышают прямые потери - выход из строя парового котла, обшивки танкера и пр.). Экологический аспект. 2-я половина прошлого века создана теория коррозии, борьба с ней приняла целенаправленный характер. Классификация коррозии: (по механизму протекания, по условиям протекания, по характеру разрушения) По механизму протекания: Химическая коррозия протекает в неэлектропроводных средах, как гетерогенная окислительно-восстановительная реакция в непроводящих средах. Электрохимическая коррозия протекает в электропроводящих средах как электрохимическая реакция. Химическая коррозия: а) газовая или высокотемпературная коррозия (ВТК) - в газах и парах при высоких температурах; б) в неэлектролитах агрессивных органических жидкостях (сернистая нефть и др.). Происходит прямое взаимодействие металла с окислителем окружающей среды, непосредственный переход электронов металла на окислитель. Критерий возможности протекания ∆ G < 0 Электрохимическая коррозия: протекает в средах, имеющих ионную проводимость: в электролитах в водных растворах солей, кислот, щелочей, в морской воде; в атмосфере любого влажного газа; в почве (в т.ч. коррозия под действием блуждающего тока. При электрохимической коррозии на энергетически неоднородной металлической поверхности возникают локальные ГЭ: участки с более отрицательными потенциалами оказываются анодами, на них идет анодное растворение М, участки с более положительными потенциалами - катодами, на них идет катодное восстановление окислителя. Процессы разделены пространственно, идут на разных участках поверхности. Отличие коррозионного ГЭ от обычного: отсутствие внешней цепи, т.е. КГЭ является короткозамкнутым.от обычного явл.нного Г.Э.ьным Е оказываются анодамиозникают локальные Г. На анодном участке А: M → Mn+(р) + n На катодном участке К: Ox + n e = Red 2) По характеру разрушения поверхности Общая – примерно равномерное разрушение всей поверхности металла Местная – пятнами, язвами, точечная (питтинг), сосредоточена на отдельных участках, проникает на большую глубину Межкристаллитная – разрушение по границам зерен металла (где скапливаются примеси) Избирательная – растворение одного из компонентов сплава (более активного восстановителя) 3) По условиям протекания Коррозия под напряжением (химическое и механическое воздействие): коррозионное растрескивание (КР) - под действием растягивающих напряжений (нержав. стали – образование транскристаллитных трещин), коррозионная усталость (КУ) - под действием циклических напряжений (атмосферная, почвенная и др.) Блуждающими токами (подземные коммуникации, трубопроводы) при недостаточной изоляции рельсов электротранспорта от земли и утечке тока. Термодинамика и механизм электрохимической коррозии При электрохимической коррозии: на анодных участках А: М → Мn+ + n на катодных участках K: Ox + n Один процесс идет за счет другого (без другого не может идти). Такие процессы называют сопряженными. Коррозионный ГЭ работает, пока ЭДС > 0 или Е кат. > Е анод. Условие возможности электрохимической коррозии: ЕРOx/Red - равновесный потенциал окислителя в данной среде ЕРMn+/M - равновесный потенциал металла в данной среде 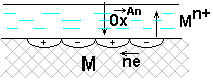 Поверхность М, как правило, энергетически неоднородна (пятна оксида, красок, недостаточная чистота обработки и др.) Самые распространенные окислители: а) О2 воздуха (в том числе растворенный в электролите) Расчет по уравнению Нернста (часто рО2= 0,21): б) ионы Н+ из электролита или молекул H2O. Расчет по уравнению Нернста: Уравнения катодных реакций (восстановления окислителей) - коррозия с поглощением кислорода (с кислородной деполяризацией): O2 + 4H+ + 4 O2 + 2H2O + 4 - коррозия с выделением водорода (с водородной деполяризацией): 2H+ + 2 2H2O + 2 Потенциал окислителя можно определить по диаграмме электрохимической устойчивости воды. Приведенная запись анодного процесса полностью его не отражает, т.к. идет и взаимодействие с компонентами среды. Упрощенная схема взаимодействий: М Н2О ↓ А- М(ОН)2 ([М(ОН)3]-) ← М2+→ МА2 ([МА3]-) Расчет по уравнению Нернста сложен. Для определения Е в водных растворах используют диаграммы Пурбэ. В ориентировачных расчетах используют Е0мет., т.е. для установления термодинамической возможности к 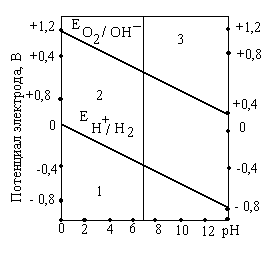 оррозии металла проверяют соблюдение неравенства: Е0мет < Еоx. Разные металлы корродируют по-разному, в зависимости от их стандартного потенциала и рН: Зависимость потенциалов водородного и кислородного электродов от рН среды а) если потенциал металла положительнее потенциала кислородного электрода (область 3), то коррозия металла невозможна. Например, золото, платина не могут корродировать ни с поглощением О2, ни с выделением Н2, так как Еок < б) если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода, например: в) если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода (область 1) (щелочные, щелочно-земельные металлы, магний, алюминий, цинк и др. цветные металлы). Задача 13. Влияние рН среды на коррозию железа Fe с примесями меди Cu (рН = 3 и рН =10). Решение. 1) Сравниваем потенциалы металлов (основного и примесей, компонентов сплава, основного металла и покрытия и т.д.). Стандартные потенциалы: ЕоFe2+/Fe = - 0,44 В < ЕоCu2+/Cu= + 0,34 В Разрушаться (окисляться) будет металл с более отрицательным потенциалом (более сильный восстановитель), т.е. Fe. 2) Определяем равновесные потенциалы окислителей в заданной среде: рН = 3 рН = 10 3) Сравниваем значения потенциалов окислителей и металла, делаем вывод о возможности данного процесса коррозии: рН = 3 - 0,44 В < 1,05 В возможна коррозия с поглощением кислорода - 0,44 В < -0,18 В возможна коррозия с выделением водорода рН = 10 - 0,44 В < 0,64 В возможна коррозия с поглощением кислорода - 0,44 В > -0,59 В невозможна коррозия с выделением водорода 4) Записываем уравнения коррозионных процессов: рН = 3 (A): Fe → Fe2+ + 2 (К): 2H+ + 2 O2 + 4H+ + 4 есть синее окрашивание: K3[Fe(CN)6] - качественный реагент на ионы Fe2+(гексоцианоферрат калия): 2 K3[Fe(CN)6] +3 Fe2+ = Fe3[Fe(CN)6]2 + 6 K+ синий цвет – «турнбулева синь». рН = 10 (A): Fe → Fe2+ + 2 O2 + 2H2O + 4 Задача 14. Имеется спай Sn с Ag. Определить возможность коррозии при эксплуатации изделия в щелочной среде (рН = 9) при контакте с кислородом. Написать уравнения коррозионных процессов. Решение. По табл.1 приложения определим стандартные электродные потенциалы металлов: т.к. По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2): Поскольку A– : Sn → Sn2+ + 2 K+ : O2 + 2H2O + 4 Задача 15. При коррозии железного изделия с поглощением кислорода за 3 мин образовалось 0,125г Fe(OH)2. Вычислите объем кислорода, израсходованного на коррозию железа, силу коррозионного тока и массу металла, разрушенного коррозией. Решение. Рассчитаем количество моль-эквивалентов образовавшегося Fe(OH)2: 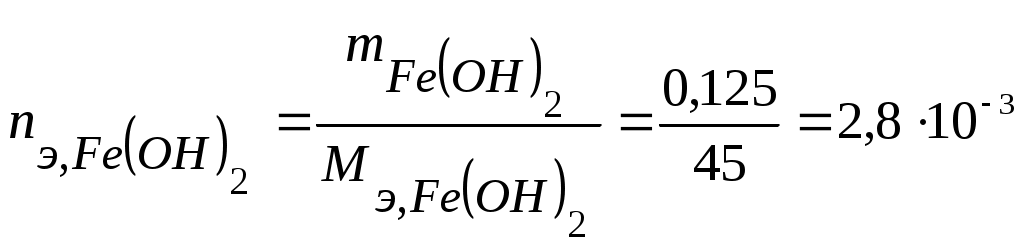 моль-экв. моль-экв.Поскольку все вещества взаимодействуют в эквивалентных количествах, то разрушилось 2,8.10-3 моль-экв. Fe и израсходовалось столько же моль-экв O2. Тогда объем кислорода (н.у.), израсходованного на коррозию железа: По закону Фарадея рассчитаем силу коррозионного тока Определим массу прокорродировавшего железа: Атмосферная коррозия - коррозия М в атмосферных условиях. Первопричина – увлажнение и загрязнение поверхности М. Загрязнители (газы SO2, СО, СО2, NOx…) растворяются во влажной пленке на М: СО2 + Н2 О ↔ Н2СО3↔Н+ + НСО3-(рН падает, Соx увеличивается) Задача 16. Fec примесями Cu в атмосферных условиях. Решение. А: Fe → Fe2+ + 2e K: 2Н+ +2e → H2 O2 +4H++4e→2H2O Дальнейшие превращения М зависят от рН пленки, природы и С загрязнителей. Экспериментально установлено, что в атмосферных условиях на Fe образуется рыхлые слои оксидов: Fe2O3 • FeO; FeOOH+. Анодная реакция идет на поверхности М, катодная – на границе оксидных слоев. В каналах – продукты коррозии (соли М, в основном сульфаты, которые увеличивают электропроводность и V коррозии повышается). Аналогично протекает атмосферная коррозия у др. металлов: М: Pb Al Sn Cu Ni Zn Fe V, мкм/год 4 8 12 12 32 50 200 Vатм.корр.= f (природы М, влажности, природы и С загрязнителей, рН пленки на М) Задача 17. Напишите уравнения электрохимической коррозии пары Sn-Zn при рН=5 и 298 К. Сколько и какого металла прокорродировало, если в процессе коррозии поглотилось 56 мл кислорода и выделилось 22,4 мл водорода? Определите, чему равен коррозионный ток, если продолжительность коррозии 20 мин. Решение. Стандартные потенциалы металлов: т.к. По уравнению Нернста определим равновесные потенциалы вероятных окислителей ( Н+ и О2): Так как A- : Zn → Zn2+ + 2 K+ : O2 + 2H2O + 4 2H2O + 2 В соответствии с заданием определим количество моль-экв. поглотившегося кислорода и выделившегося водорода (условия считаем нормальными, 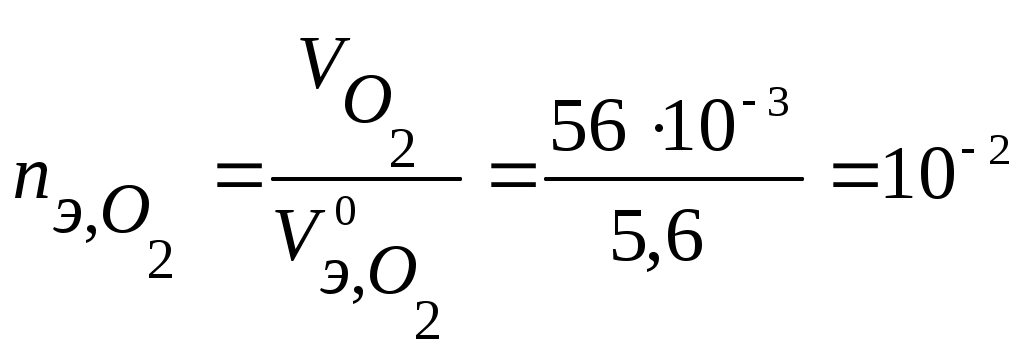 моль-экв, моль-экв, 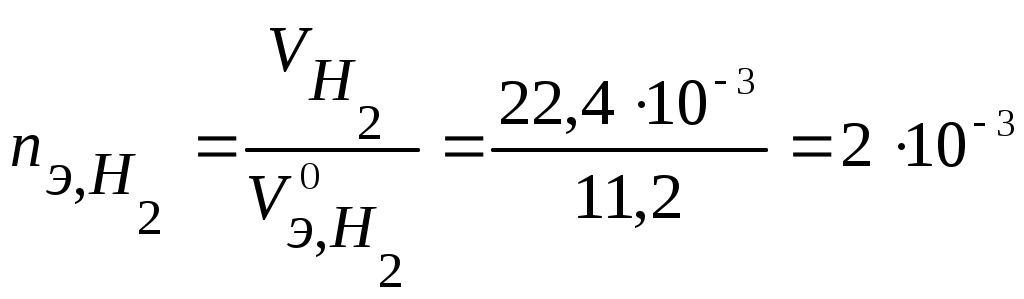 моль-экв. моль-экв. Таким образом, на катоде претерпело изменение 1,2.10-2 моль-эквивалентов вещества. По закону эквивалентов такое же количество вещества растворится на аноде: Величина коррозионного тока определяется по закону Фарадея: 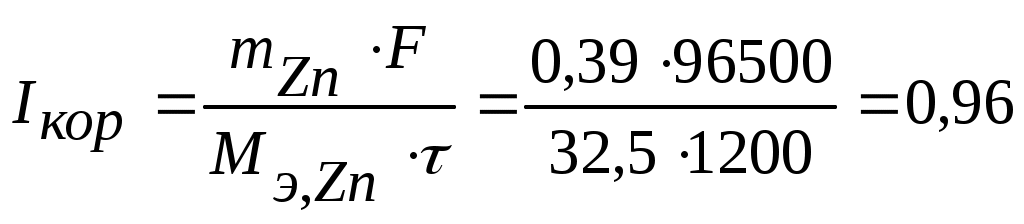 А. А. Скорость электрохимической коррозии. Термодинамика устанавливает возможность протекания процесса коррозии, но не дает реальных представлений о скорости коррозии. 4Al + 3O2 + 6H2О = 4Al(OH)3 , Причина в пассивации металла: продукты коррозии - оксидные, гидроксидные, солевые и др. пленки тормозят дальнейший процесс коррозии. Скорость коррозии: 1) Массовый показатель, Км - потеря массы (в граммах или килограммах) за единицу времени (секунду, час, сутки, год), отнесенная к единице площади (квадратный метр) образца, [г/(м2.сут)]. 2) Глубинный показатель, Кг - уменьшение толщины металла в единицу времени, [мм/год]. Для пересчета единиц есть таблицы. По скорости коррозии 3 группы металлов: а) < 0,15 мм/год – высокая коррозионная стойкость - металлы используют для ответственных изделий: валов, поршней насосов, пружин и др.; б) от 0,15 до 1,5 мм/год – средняя коррозионная стойкость - металлы используют там, где нет повышенных требований к коррозии оной стойкости: емкости, трубопроводы, корпуса вентилей, болтов; в) > 1,5 мм/год – не стойкие, не используются в коррозионной среде. |
