дз. Коррозия металлов Коррозия
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
3) Плотность коррозионного тока (или ток коррозии), iкор (Iкор) - величина тока, приходящегося на единицу площади металла, растворенного в единицу времени. По закону Фарадея: iкор = m F/Mэ S t, где МЭ молярная масса эквивалента металла, г/моль; F – число Фарадея, 96500 кл/моль; iкор плотность коррозионного тока, А/м2; Кm, Кг, iкор — прямые показатели коррозии. Екор - стационарный потенциал корродирующего металла (устанавливается на поверхности металла), при котором протекают сопряженные реакции ионизации Ме и восстановления Ох. для Fe скорость коррозии: Км = 1г/(м2сут) и iкорр=0,04А/м2 При работе КГЭ имеет место поляризация, приводящая к понижению ЭДС и понижению V коррозии. Скорость электрохимической коррозии зависит от скорости лимитирующей стадии: V=Vлим.ст. (анодное растворение М; катодное поглощение О2 – наиболее часто; катодное выделение Н2). Чтобы ↓V нужно ↓Vлим.ст., т.е. ↑ поляризацию. Поляризационные кривые коррозионного микроэлемента – коррозионные диаграммы. 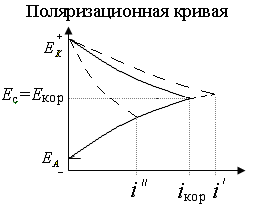 Коррозионная диаграмма . Как и в гальваническом элементе, потенциал анодного процесса смещается в более положительную сторону, а катодного в более отрицательную. При некотором токе iкор кривые пересекаются - ток анодного растворения равен току катодного восстановления окислителя. При этом на поверхности металла устанавливается стационарный потенциал Ес, или потенциал коррозии Екор. 1) Лимитирующая стадия – катодное выделение водорода (обычно в кислых средах). Замедленность стадии определяется электрохимической поляризацией при выделении Н2: 2Н+ +2 Такие примеси как платина, кобальт, никель катализируют выделение водорода, скорость катодного процесса будет выше, чем на чистом М (поляризация катодной кривой уменьшится) точка пересечения сместится вправо, то есть iкор увеличится i’. Другие металлы (например, Hg, Pb, Cd, Zn), напротив, увеличивают перенапряжение водорода (поляризация катодной кривой увеличится), iкор уменьшится i”. V = f (рН, Т, природа катодных участков) Вывод: Скорость коррозии с выделением водорода может быть замедлена снижением температуры, увеличением pH среды, очисткой металла от каталитических примесей, изоляцией поверхности металла. Перемешивание раствора практически не влияет, т.к. поляризация электрохимическая. 2) Лимитирующая стадия – катодное восстановление кислорода. Замедленность вызвана медленной диффузией кислорода из-за его малой растворимости в воде (при 25оС растворимость О2 составляет 2,6.10-7 моль/см3). Поляризация - концентрационная, зависит от СО2 (концентрации кислорода в растворе), D (коэффициента диффузии кислорода), δ (толщины диффузионного слоя), Т. Максимальная скорость определяется предельной плотностью тока iпр= 4F.DO2.СO2.δ-1 V = f(CО2, D, T) ↑Т приводит к ↑D, но и к уменьшению растворимости кислорода в воде. Вывод: коррозия с поглощением кислорода лимитируется стадией диффузии кислорода и возрастает с увеличением его концентрации и при перемешивании, экстремально зависит от температуры (в системе, сообщающейся с атмосферой, максимум при Т=70-800 С). Для борьбы с такой коррозией следует снижать концентрацию кислорода, например, введением восстановителя в раствор (Na2SO3 - сульфит натрия, N2H4 - гидразин…) или снижением давления кислорода над раствором, подбором оптимальной Т, применением ингибиторов (ПАВ), избегать перемешивания. 3) Лимитирующая стадия – анодное окисления металла(для металлов, способных пассивироваться, таких, как 13Al, 22Ti, 24Cr, 28Ni, 40Zr, 73Ta и др.). Пассивность – состояние повышенной устойчивости М, которое вызывается образованием на поверхности металла оксидных или иных защитных слоев (плотной труднорастворимой пленки из продуктов коррозии, например, Сr2О3 на хроме, ТiО2 на титане, Al2О3 на алюминии, Та2О5 на тантале), и приводит к торможению анодной реакции в определенной области потенциалов и скорости электрохимической коррозии в целом. При некотором потенциале Епас скорость растворения анода резко падает металл переходит в пассивное состояние. Во всей области пассивности 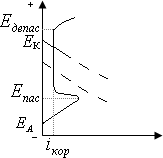 Коррозионная диаграмма для коррозии пассивирующегося металла Сильные окислители способствуют или даже вызывают пассивацию металлов (концентрированные HNO3 и H2SO4 пассивируют железо). Вещества, вызывающие пассивацию М – пассиваторы коррозии (NO3-, Cr2O72-…). Вещества, стимулирующие коррозию – активаторы (Cl-, Br- - активаторы коррозии, что связано с их высокой адсорбционной способностью и восстановлением пассивной пленки на М: 2Cl-→2Cl-адс, 2Cl-адс + M(OH)2→MCl2 + 2OH-. Разбавленные кислоты HNO3, H2SO4 - активаторы коррозии). В разбавленной H2SO4 A: Fe → Fe2+ + 2e К: 2Н+ + 2e → H2 Fe + H2SO4 → FeSO4 + H2 В концентрированной H2SO4 А: 2Fe + 3Н2О - 6e → Fe2O3 + 6H+ K: 3SO42- + 12H+ + 6e → 3SO2 + 6H2O 2Fe + 3H2SO4 → Fe2O3 +3SO2 + 3H2O В разбавленной HNO3 A: Fe → Fe3+ + 3e K: NO3- + 4H+ + 3e → NO + 2H2O Fe + 4HNO3 → Fe(NO3)3 + 2H2O + NO В концентрированной HNO3 A: 2Fe + 3Н2О - 6e→ Fe2O3 + 6H+ K: 6NO3- + 12H+ + 6e→ 6NO2 + 6H2O 2Fe + 6HNO3 → Fe2O3 + 6NO2 + 3H2O Влияние рН на скорость коррозии: Fe при рН >7 пассивируется (пассивная пленка Fe(OH)2 ) V = f (C и природы электролита, природы М, рН). Задача 18. Коррозия Fe-Fe3C (углеродистая сталь) Среда: кислая в отсутствии воздуха (нет О2) Решение. Fe3C - участок К А-: Fe – 2eFe2+ Поляризационная кривая  К+: 2H+ + 2eH2   Екорр ЕкоррЗащита металлов от коррозии Профилактические и дополнительные меры принимаются на стадии проектирования машин и оборудования. Профилактические меры включают: 1) выбор оптимального для данных условий материала (в основном, легированного: легирование металлов - введение в состав материала компонентов, вызывающих не только улучшение механических характеристик, но и пассивацию металла): - жаростойкость – стойкость по отношению к высокотемпературной (газовой, химической) коррозии - легирование стали Cr, Al, Si (образуют плотные защитные пленки оксидов);. - жаропрочность – свойство материала сохранять высокую механическую прочность при высоких Т - легирование стали Mo,Mn, Ni. 2) выбор оптимальных конструкторских форм изделия (избегать щелей, контакта металлов с большой разницей Е и др.); 3) выбор оптимальных технологических параметров (р, Т, С, чистота среды и др. При атмосферной коррозии в цехе необходим контроль влажности и загрязнения воздуха - кондиционеры, осушка воздуха на адсорбентах). Дополнительные меры: 1) меры, обеспечивающие изоляцию поверхности М от среды за счет неметаллических и металлических покрытий; 2) создание электрозащиты; 3)воздействие на окружающую среду. 1) Защитные покрытия: Неметаллические покрытия. Их защитная функция - изолирующая, предотвращение доступа окислителя к поверхности материала. Основное требование к качеству – сплошность, отсутствие пор, эластичность, водонепроницаемость, химическая стойкость: - неорганические (неорганические эмали, оксиды металлов, хромовые и фосфатные); - органические – наиболее распространенные(лакокрасочные покрытия, покрытие смолами, пластмассами, полимерными пленками, резиной). Металлические покрытия (катодные и анодные). Получают электролизом, химическим восстановлением, термодиффузией, металлизацией М покрытий: -чистые металлы (Cr, Ni, Zn, Cd, Al, Cu, , Ag и т.д.); - сплавы (бронза, латунь и др.). Катодные покрытия - потенциалы которых в данной среде более положительные, чем потенциал основного металла, напр. Ni, Cu, Sn на Fe (Ек.п. > Ем). Анодные покрытия - потенциалы которых в данной среде более отрицательные, чем потенциал основного металла, напр. Zn, Cr, Al на стали (Еан.п. < Ем). Задача 19. Процессы, протекающие на Fec покрытиями из Sn и Zn в проводящей среде при рН=3 и доступе воздуха. Решение. Луженое железо Sn/Fe (пищевые емкости, консервные банки и др.) а)Сравниваем стандартные потенциалы основного металла и покрытия: Е0Sn2+/Sn = - 0,136 B > E0Fe2+/Fe = - 0,440 B - покрытие катодное. б) Определяем равновесные потенциалы окислителей в заданной среде (рН=3) в) Сравниваем значения потенциалов окислителей и металла-анода, делаем вывод о возможности данного процесса коррозии Покрытие не нарушено: - 0,136 В < 1,05 В возможна коррозия Sn с поглощением кислорода - 0,136 В >-0,18 В невозможна коррозия Sn с выделением водорода (A) Sn → Sn2+ + 2e (К) O2 + 4H+ + 4 Покрытие нарушено: - 0,44 В < 1,05 В возможна коррозия Fe с поглощением кислорода - 0,44 В < -0,18 В возможна коррозия Fe с выделением водорода (A) Fe → Fe2+ + 2e (К) 2H+ + 2 O2 + 4H+ + 4 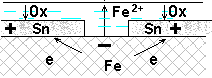 При повреждении катодного покрытия возникает коррозионный ГЭ, в котором основной материал - анод - растворяется, а материал покрытия – катод,на нем выделяется водород или поглощается кислород. Оцинкованное железо Zn/Fe(ведра и др). а) Сравниваем стандартные потенциалы основного металла и покрытия: Е0Zn2+/Zn = - 0,763 B < E0Fe2+/Fe = - 0,440 B - покрытие анодное. б) Определяем равновесные потенциалы окислителей в заданной среде (рН=3) в) Сравниваем значения потенциалов окислителей и металла-анода, делаем вывод о возможности данного процесса коррозии Покрытие не нарушено: - 0,763 В < 1,05 В возможна коррозия Zn с поглощением кислорода - 0,763 В < -0,18 В возможна коррозия Zn с выделением водорода (A) Zn → Zn2+ + 2e (К) O2 + 4H+ + 4 2H+ + 2 Покрытие нарушено. - 0,763 В < 1,05 В возможна коррозия Zn с поглощением кислорода - 0,763 В < -0,18 В возможна коррозия Zn с выделением водорода (A) Zn → Zn2+ + 2e (К) 2H+ + 2 O2 + 4H+ + 4 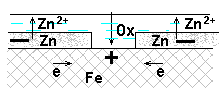 При повреждении анодного покрытия возникает коррозионный ГЭ, в котором основной материал - катодне растворяется, на нем выделяется водород или поглощается кислород, а материал покрытия – анод - разрушается. ВЫВОД:Катодные покрытия (например, Pb, Cu, Ni) защищают М изделия в основном механически. Основное требование - сплошность, отсутствие пор, эластичность, водонепроницаемость, хим. стойкость. Анодные покрытия (например, Al, Zn, Cd) защищают изделие не только механически, но главным образом электрохимически, участвуя в анодном процессе. Задача 20. Предложите анодное покрытие для защиты железного изделия от электрохимической коррозии в кислородсодержащей среде при рН = 7, ргаз =1. Напишите уравнения коррозионных процессов при нарушении целостности покрытия. Решение. В качестве анодного покрытия для Fe можно использовать металлы с более отрицательным значением потенциала, (например, Zn, Cr, Al и др.). Например, выберем хром, стандартный потенциал По уравнению Нернста определим равновесные потенциалы вероятных окислителей ( Н+ и О2): т.к. Так как A- : Cr → Cr3+ + 3 K+ : O2 + 2H2O + 4 2H2O + 2 Задача 21 Предложите катодное покрытие для защиты железного изделия от электрохимической коррозии в кислородсодержащей среде при рН = 8 и ргаз =1. Напишите уравнения процессов в коррозионном гальваническом элементе при нарушении целостности покрытия. Решение. В качестве катодного покрытия для Fe можно использовать металлы с более положительным значением потенциала, (например, Ni, Cu, Ag и др.). Например, выберем медь, стандартный потенциал Так как По уравнению Нернста определим равновесные потенциалы вероятных окислителей ( Н+ и О2): Так как A- : Fe → Fe2+ + 2 K+ : O2 + 2H2O + 4 Железное изделие при этом будет разрушаться. |
