дз. Коррозия металлов Коррозия
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
2) Электрохимическая защита от коррозии - состоит в катодной или анодной поляризации защищаемого М. Катодная поляризация. Суть - если на изделие извне наложить более отрицательный потенциал, чем анод коррозионной пары, то анод растворяться не будет. Два способа: - Катодная протекторная защита: к металлическому изделию, подвергающемуся электрохимической коррозии, подсоединяют протектор - металл с более отрицательным потенциалом, чем металл изделия. Материалы протекторов - Al, Mg ,Zn и сплавы на их основе в виде пластин, брусков и др., которые непосредственно прикрепляются к защищаемому изделию. В коррозионной среде протектор - анод, разрушается, изделие - катод, остается неизменным, идет восстановление окислителя. Например, бронзовый подшипник (Sn/Cu) и шейка вала гребного винта (Fe) корабля создают коррозионную пару, в которой разрушается поверхность стального вала, что очень опасно (потеря винта). Если в непосредственной близости прикрепить к корпусу цинковую пластину, то она будет растворяться и держать под отрицательным потенциалом возникшую коррозионную пару, запрещая ее работу. - Катодная защита (от внешнего источника постоянного тока): конструкцию (изделие) подключают к отрицательному полюсу – это катод, к положительному полюсу - анод (жертвенный анод) - он разрушается (например, отработанный стальной рельс и др. лом). Катодная поляризация используется для защиты подземных трубопроводов, кабелей, шлюзовых ворот, обшивки подводных лодок, водных резервуаров, морских трубопроводов и оборудования химических заводов, корпусов автомобилей.  К+ А- Задача 22. Протектор Al или Mg на стальном (Fe) изделии в морской воде(рН = 8) Решение. Протектор Al → Al3+ + 3eили Mg → Mg2+ + 2e, на стальном (Fe) изделии 2Н2О + 2е → Н2 + 2ОН- Задача 23. Выберите протектор для защиты стальной конструкции (Fe ) в кислой среде ( рН=4) на воздухе. Напишите уравнения процессов коррозии. Рассчитайте, как изменится масса протектора, если за некоторое время в процессе коррозии поглотилось 112 мл кислорода и выделилось 112 мл водорода. Решение. При протекторной защите к металлическому изделию непосредственно или через металлический проводник подсоединяются металл или сплав с более отрицательным значением потенциала, чем потенциал защищаемого изделия. Для железа ( Согласно уравнению Нернста равновесные потенциалы вероятных окислителей (Н+ и О2) равны: Так как A- : Мg → Мg2+ + 2 K+ : O2 + 4H+ + 4 2H+ + 2 В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными, 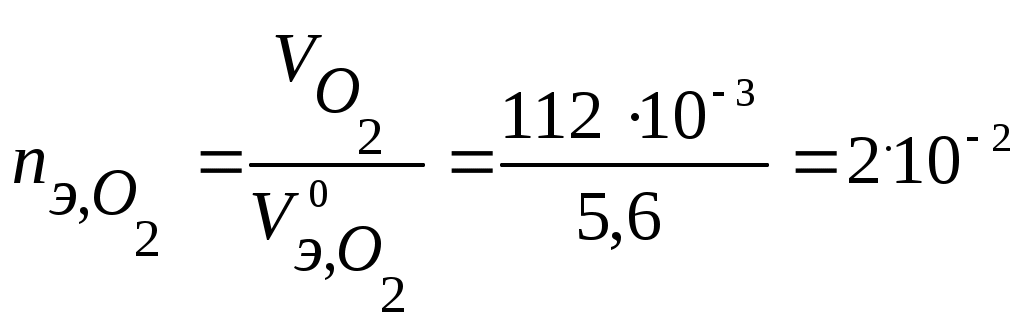 моль-экв, моль-экв, 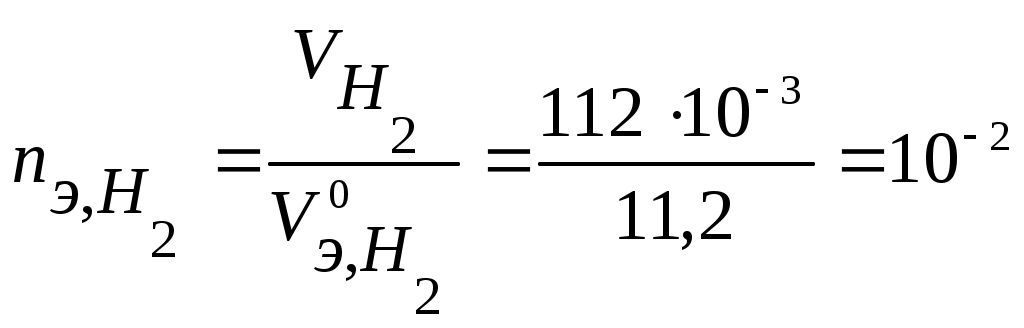 моль-экв. моль-экв.Таким образом, на катоде претерпело изменение 3.10-2 моль-эквивалентов окислителя. По закону эквивалентов такое же количество протекторного материала растворилось на аноде: Анодная защита - наложение на конструкцию положительного потенциала и перевод ее в пассивное состояние. Метод применим для металлов, способных пассивироваться. Требует строгого контроля потенциала, что трудно осуществимо на практике. А: 2Cr + 3H2O – 6e→ Cr2O3 + 6 H+ Электрозащита от коррозии применяется при работе гидростанций, морских портовых устройств и т. д. 3) Изменение свойств коррозионной среды (основной метод в теплоэнергетике) Уменьшение концентрации коррозионно опасных компонентов (O2, H+, Cl-, СО2 и др.) Введениеингибиторов -специальных добавок, замедляющих коррозию. Уменьшение выбросов в атмосферу (NOx, SO2, CO2 и др.), осушение воздуха (на адсорбентах). Уменьшение концентрации кислорода О2: деаэрация (кипячение), барботаж неактивного газа (N2), восстановление с помощью сульфитов, гидразина и др. O2 + N2H4 = N2 + 2H2O 2Na2SO3 + O2 = 2Na2SO4 Уменьшение концентрации растворенного СО2 (СО2 + Н2О↔Н2СО3↔Н+ +НСО3-): NH3 + H2CO3 = NH4НСО3 Снижение концентрации ионов Н+: (гидразин-аммиачный режим ТЭС, рН = 9-9,2; нейтральный режим АЭС) рН↑ вводя известь CaO +H+→Ca2++ OH- Снижение общего содержания солей (различные методы водоочистки); Замена более агрессивных ионов (Cl-) менее агрессивными (NO3-); Применение ингибиторов: Ингибиторы – вещества-замедлители коррозии. Ингибиторы: ♦ Жидкофазные применяют в замкнутых системах при V = const. ♦ Газофазные применяют при эксплуатации М на воздухе. Механизм действия - ингибитор, адсорбируясь на поверхности М тормозит: - или анодный процесс - анодный ингибитор, - или катодный процесс – катодный ингибитор, - или и анодный и катодный процесс - экранирующий ингибитор. Пример. Анодный ингибитор As2O3 (жидкофазный), отравляет катодные участки поверхности М (где идет выд. Н2, → Еа↑, Vкорр. ↓). Анодные ингибиторы (нитриты, хроматы,бихроматы и т.д.). Действие - окисление поверхности М с образованием тонкой пленки (0,01 мкм) трудно растворимого соединения с М, которая тормозит анодную реакцию, смещая потенциал в положительную сторону. Экранирующие ингибиторы коррозии - ПАВ, в основном органические соединения, содержащие аминогруппу NH2-. Действие - адсорбция на границе раздела М - кислота. В результате адсорбции - торможение анодных и катодных процессов. ВЫВОД: Выбор методов защиты от коррозии определяется природой защищаемого металла, параметрами коррозионной среды, конструкцией, условиями эксплуатации и экономическими соображениями. |
