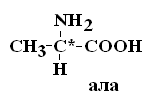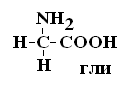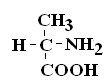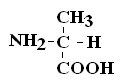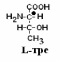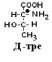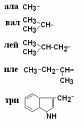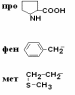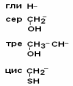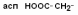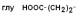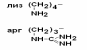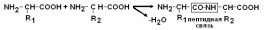Коллоквиум по БиоХимии. Краткая история развития биохимии
 Скачать 250.38 Kb. Скачать 250.38 Kb.
|
|
Коллоквиум по БиоХимии Вопрос№1 Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей. Современная биохимия решает следующие задачи: Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок. (это связывает БХ с фармакологией) Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков. (Биология) Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками. (Генетика) Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач. КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ БИОХИМИИ Биохимия – это сравнительно молодая наука, она возникла на рубеже 19 в. Впервые в научной литературе термин «биохимия» использовал в 1903 году немецкий химик Карл Нойберг. Как наука биохимия сформировалась относительно недавно, однако корни ее уходят в глубокую древность. Так на основе биохимических процессов развивались такие производства как сыроварение, хлебопечение, виноделие, выделка кожи и т.д. Необходимость борьбы с болезнями заставляла задумываться о преврщении веществ в организме, искать объяснение целебным свойствам растений. Авиценна (980-1037) – разработал первую химическую классификацию веществ, применяемых в медицине, и изложил ее в труде «Канон врачебной науки». Средние века, период «алхимии» – это попытки создания химическим путем «панацеи» от всех болезней. 16-17 вв. – появилось особое направление «ятрохимия» от греч. «ятрос» – врач). Немецкий врач-ятрохимик Парацельс выдвинул прогрессивное по тем временам предположение о тесной связи химии и медицины. Ван-Гель-Монт высказался о наличии в живых организмах факторов, участвующих в различных химических процессах. 17-18 вв. – немецкий химик и врач Шталь сформулировал теорию горючего начала – теорию «флогистона»: якобы в процессе горения из горючего вещества выделяется особое невесомое вещество – флогистон. Эти метафизические воззрения были опровергнуты работами Ломоносова и Лавуазье, которые открыли законы сохранения массы. Лавуазье показал, что при горении, также как и при дыхании поглощается О2 и выделяется СО2. К концу 18 в. был накоплен большой практический материал и выделено огромное количество органических соединений растительного и животного происхождения. Работы Реомюра и Спалланцони положили начало изучению ферментов пищеварительных соков. 1814 г. – русский ученый Кирхгофф описал осахаривание крахмала под действием фермента амилазы. Либих (1839) выяснил, что главные компоненты животных и растений – это белки, жиры, углеводы. Бертло (1854) – провел синтез жиров; Бутлеров (1861) – синтез углеводов. Накопление большого числа сведений о химическом составе животных и растений, химических превращениях, которые в них происходят, привело к систематизации уже имеющихся данных в учебных руководствах Либиха – в Европе, Ходнева – в России. Повсеместно в медицинских институтах открывались соответствующие кафедры. Таким образом, в конце 19 в., появилась новая отрасль химии – биологическая химия, т.е. химия жизни, химия жизненных процессов. При этом: были заложены главные направления биохимии; открыты основные классы соединений, содержащиеся в живых организмах; были выделены белки из многих животных и растительных организмов; изучение продуктов гидролиза белков привело к открытию аминокислот (АК). Открытие швейцарским ученым Мишером в 1869 г. ДНК привело к изучению нуклеиновых кислот (НК). Были поставлены первые опыты по взаимопревращению жиров, белков, углеводов. Возникло учение о витаминах (Лунин, Эйкман, Функ и другие), о ферментах (Манасеина, Павлов), гормонах (Бернар). В 20 в. биохимия достигла подлинного расцвета: Фишером была обоснована пептидная теория строения белков; Кноопом, Ленинджером – окисление и биосинтез жирных кислот; Кребсом, Мейергофом – созданы схемы биохимических превращений углеводов и образования АТФ. К середине 20-го столетия были заложены серьезные основы к развитию таких направлений как биоэнергетика, генная инженерия, молекулярная биология и др. Достижения биохимии широко применяются в медицине, фармации, народном хозяйстве. Вопрос№2 Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структуре хирального атома С. Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):
Оптически неактивной является только АК глицин, которая не имеет хирального центра. Существуют два вида изомеров – структурные и стереоизомеры. Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.
Стереоизомеры – это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.
Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами. Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – левовращающим («–»). Природные аминокислоты являются как «+», так и «–». Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью. Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L–ряда. Для определения принадлежности АК к Д– или L–ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА). 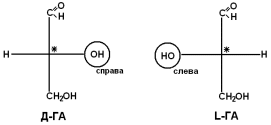 По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если слева – L–АК.
Все аминокислоты природных белков являются α–АК. Вопрос№3 α-АК являются строительными блоками, из которых образуются белковые полипептидные цепи (ППЦ) и, собственно, сами белки. Аминокислоты – это производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на R. Путем гидролиза из животных белков выделяют 19-25 α-АК, но обычно их получают 20. Общая формула аминокислот: 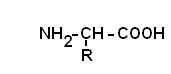 Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (250С). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α-АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+–группой. 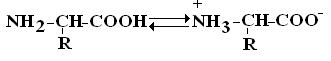 цвиттер-ион В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм. В сильнокислой среде АК присутствуют в виде катионов (q +) 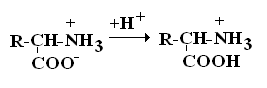 в сильнощелочной среде – в виде анионов (–q) 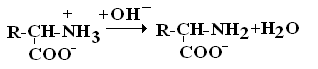 Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная концентрация «+» и «–» q аминокислот, а также белков, называется изоэлектрической точкой(pI). При достижении такой рН белок становится неподвижным в электрическом поле и выпадает в осадок, что используется в электрофоретических методах анализа белков и аминокислот. Современная рациональная классификация аминокислот в соответствии с ней все аминокислоты делятся на 4 группы. I – Неполярные гидрофобные аминокислоты – их 8.
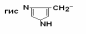
II –Полярные гидрофильные незаряженные аминокислоты – их 7.
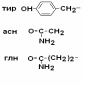
III – Отрицательно заряженные кислые аминокислоты
IV Положительно заряженные основные аминокислоты
Образование пептидных связей. –СООН группа одной аминокислоты может реагировать с –NH2 группой другой аминокислоты с образованием пептидных связей.
Пептидные цепи белков – это линейные полимеры –АК, соединенных пептидной связью. Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым. Пептиды пишутся и читаются с N–конца. Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R. 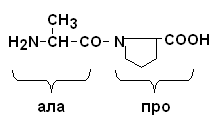 Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие t и , кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (), называемых протеазами или пептидгидролазами. Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана. Вопрос№4 |